天敌声音应激对SD 大鼠的焦虑样行为的影响
陈超杰,钟志凤,何嘉莉,张水华
(1.梧州学院,化学工程与资源再利用学院,广西 梧州 543002; 2.福建医科大学,福建省新药安全性评价中心,福州 350122; 3.陆军军医大学,高原军事医学系高原作业医学教研室,重庆 400038)
焦虑症(anxiety disorders)是一类以发作性或持续性情绪焦虑,并伴有自主神经紊乱、肌肉紧张与运动不安等症状的精神性疾病。 近年来,该病的发生率随着社会压力的增加而逐年上升,已经成为影响人们生活质量的主要精神疾病之一[1]。 焦虑症的病因仍不明确,而在临床中抗焦虑药因其不良反应较多受到限制[2]。 因此,焦虑症以及抗焦虑新药成为医药学研究的热点。 焦虑症的动物模型是研究焦虑症和研发抗焦虑新药的重要载体,为该病的诊断、预防和治疗提供线索和理论指导。 目前有关焦虑症的动物模型多达30 种,大多经过临床有效的抗焦虑药物检验后建立起来的[3-4]。 但部分模型在维持动物焦虑状态和评价不同种类抗焦虑药等方面存在局限性[5]。
防御行为焦虑模型最初是通过受试动物与天敌动物的接触,造成受试动物的焦虑状态,但这种方法易致使受试动物躯体创伤;随后,又发展为通过暴露天敌气味来引起受试动物焦虑样行为的动物模型[6]。 这类模型可称之为天敌焦虑模型,其优点是操作简便,对动物应激的时间短,而焦虑效应可持续1 周以上,便于多个时间点和不同检测方法对动物模型进行综合研究[7-9]。 该类模型可用于评价包括苯二氮卓类和三环类等多种抗焦虑药,也可用于焦虑症机制的探索[10]。 因此它可能是一类较为全面地反映焦虑行为表现、作用机制及药物治疗等多方面的焦虑症动物模型,有利于焦虑症的发病机制研究和新药筛选。 然而,在实际操作中,该类模型所需的天敌动物(猫)在微生物控制等级难以达到动物屏障系统的要求,使之在SPF 级动物实验室中应用带来困难。 而天敌气味的应用也存在诸多不足,包括不好控制气味的投放量,气味投放过程失当容易污染动物房,从而影响其他试验的进行等。
有研究者发现声音惊吓能诱导动物焦虑样行为的产生。 Kaltwasser[11]利用10 kHz、110 dB 纯音对大鼠进行刺激,成功诱导出动物的焦虑状态。 但该模型的缺点是声音强度太大,一般单调而高分贝的声音也可诱发啮齿类动物癫痫发作,提示这种方法还会引起中枢神经系统的其他神经精神性病变[12]。 有研究人员发现83.9 dB 的雷鸣声能引起比格犬产生焦虑状态,提示在声音强度不大的情况下,利用恐吓声也能诱导出焦虑效应,为本文提供了很好的思路[13]。 结合天敌暴露和声音惊吓的特点,本课题组尝试利用适当声音强度的天敌声音(猫叫声)对大鼠建立焦虑症模型。
1 材料和方法
1.1 实验动物
SPF 级雄性SD 大鼠72 只,体重180 ~200 g,2月龄,购自北京维通利华实验动物技术有限公司[SCXK(京)2012-0001]。 动物在福建医科大学新药安全性评价中心SPF 屏蔽系统动物实验室[SYXK(闽)2013-0001]饲养和实验,实验开展前经过福建医科大学实验动物伦理委员会的审查批准(批准号:2017-14)。 大鼠在标准饲养盒内喂养,每盒5 只,每周换笼两次,人工照明,明暗各12 h,室温20℃~26℃,湿度40%~70%。 并严格按照实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂和仪器
地西泮注射液(天津金耀氨基酸有限公司,批号1201301);0.9%氯化钠注射液(福州海王福药制药有限公司,批号:150401B21);地西泮均用生理盐水配制到相应浓度的溶液进行腹腔注射给药。 动物视频行为分析系统(Smart V2.5,Panlab 公司,西班牙);旷场试验箱(上海移数信息科技有限公司);大鼠高架十字迷宫(上海移数信息科技有限公司);音响(SPA 1312,飞利浦,荷兰); 数字声级计TES1350A(泰仕电子工业股份有限公司,计量鉴定号:1212130252)。
1.3 实验方法
1.3.1 天敌声音应激
录制猫叫声音和白色噪音音频作为天敌刺激物和参照物,两种声音的频率分别是0 ~22 kHz(中心频率:2.541 kHz)和0~8 kHz,均在大鼠可接受的听力范围内[14]。 音频通过电脑控制音响循环播放,音响距离应激动物笼具1 m 远,声音强度通过数字声级计控制在(60.0 ± 5.0) dB。 测试房间的背景声音强度为51.2 dB。
1.3.2 旷场试验(open-field test, OFT)
大鼠放置于方形敞口的旷场箱(100 cm×100 cm×38 cm)内,通过动物视频监测系统观察和分析其在旷场箱内5 min 的自主活动情况,记录和分析的指标包括:平均速度、中央区(50 cm×50 cm)路程比例和中央区停留时间比例。 平均速度作为评价动物自主活动的指标。 中央区的路程比例和停留时间比例则是反映动物焦虑行为的指标,两者的数值越小则说明动物的焦虑状态越严重。 每测试完一只动物需清洗旷场箱的底部和侧壁以使之清洁无异味,测试均在上午九点到中午十二点之间进行。
1.3.3 高架十字迷宫测试(evaluated-plus maze,EPM)
大鼠EPM 是由两个开臂(50 cm×10 cm)和两个相对闭臂(50 cm×10 cm×50 cm)及中央平台区(10 cm×10 cm)连接而成,装置离地面高度为50 cm。 放置大鼠于中央平台区,头朝开臂,通过动物视频监测系统观察和分析记录其在5 min 内平均速度、开臂区路程比例和开臂停留时间比例。 平均速度作为评价动物自主活动的指标。 开臂区路程比例和停留时间的比例则是反映动物焦虑行为的指标,两者的数值越小则说明动物的焦虑状态越严重。 每测试完一只动物需清洗实验装置以使之清洁无异味,测试均在上午九点到中午十二点之间进行。
1.3.4 单次天敌声音应激
大鼠按体质量随机分为空白对照组(CON)、白色噪音刺激10 min(WN10) 和60 min 处理组(WN60)、天敌声音刺激10 min(PS10)和60 min 处理组(PS60),每组8 只。 各组动物在应激前(D0),应激后第1(D1)和第3 天(D3)进行OFT 测试,以及第7 天(D7)进行EPM 测试,行为学测试安排见如图1。
1.3.5 重复天敌声音应激
大鼠按体质量随机分为空白对照组(CON)、白色噪音处理组(RWN60)、天敌声音处理组(RPS60)和天敌声音+阳性对照处理组(RPS60+DZP),每组8 只。 动物经连续5 d,每天1 次60 min 的应激后,分别于第1 天(D1)和第7 天(D7)进行EPM 测试,第3 天(D3)OFT 测试,行为学测试安排见如图2。其中,RPS60+DZP 组的动物是在D7 测试前1 h 给予1 mg/kg 的DZP,其余处理同RPS60 组。
1.4 统计学分析
通过Graph Pad Prism 7.0 软件,采用单因素方差分析处理数据,结果以平均数±标准差(±s)表示,P<0.05 为差别有统计学意义。
2 结果
2.1 大鼠单次天敌声音应激的行为学变化
在单次声音应激前的OFT 结果(图3A)提示,各组大鼠在平均速度(图3B)、中央区的运动路程比例(图3C)和停留时间比例(图3D)均未见显著性差异(P>0.05)。 由此可见,各组大鼠的总体运动情况相似,未见显著的焦虑样行为,以此推断同一批购进的SD 大鼠在行为学上未见明显的个体差异。 因为重复应激测试的动物与单次应激为同一批次,因此重复应激试验未进行类似的验证。
图1 大鼠单次应激的行为学测试安排示意图Figure 1 Schematic diagram of behavior experimental procedures for rats by single stress

图2 大鼠重复应激的行为学测试安排示意图Figure 2 Schematic diagram of behavior experimental procedures for rats by repeated stresses

图3 单次应激前大鼠在OFT 中的活动情况Figure 3 Activity of rats the before single stress in OFT
经过单次声音应激1 d 后(图4),各组大鼠在旷场中的运动速度相似(P>0.05,图4B)。 10 min和60 min 天敌声音应激的大鼠在中央区的运动路程比例和停留时间比例均显著低于空白对照组和白色噪音处理组(P<0.01,图4C、4D),而这两组不同时长天敌声音应激处理组之间则无统计学差异(P >0.05)。 由此可见,不同时长的天敌声音刺激在不影响大鼠的总体运动情况下,经过1 d 后均能有效引起它们的焦虑样行为,而相同时长的白色噪音则无焦虑样行为的变化。
经过单次声音应激3 d 后(图5),各组大鼠在旷场中的运动速度相近(P>0.05,图5B)。 10 min和60 min 天敌声音应激的大鼠在中央区的运动路程比例和停留时间比例均显著低于空白对照组和白色噪音处理组(P<0.01,图5C、5D),而这两组不同时长天敌声音应激处理组之间则无统计学差异(P >0.05)。 由此可见,经过天敌声音刺激3 d 后,大鼠仍处于焦虑状态。

图4 单次应激后第1 天(D1)大鼠在OFT 中的活动情况Figure 4 Activity of the rats at day 1 (D1) after single stress in OFT
经过单次声音应激7 d 后(图6),各组大鼠在EPM 中的运动速度一致(P>0.05,图6B)。 10 min和60 min 天敌声音应激的大鼠在开臂区的运动路程比例和停留时间比例均显著低于空白对照组和白色噪音处理组(P <0.01,图6C、6D),而这两组不同时长天敌声音应激处理组之间则无统计学差异(P >0.05)。 由此可见,经过单次天敌声音刺激的大鼠能持续焦虑状态不少于7 d。
2.2 大鼠重复天敌声音应激的行为学变化
单次天敌声音应激能使大鼠持续呈现焦虑样行为,但重复刺激是否仍能保持这种效应? 反复应激是否会使大鼠对天敌声音产生耐受呢? 由图7 的结果可见,经过重复声音应激1 d 后,各组大鼠在EPM 中的运动速度类似(P>0.05,图7B)。 重复天敌声音应激的大鼠在开臂区的运动路程比例和停留时间比例均显著低于空白对照组和白色噪音处理组(P<0.01,图7C、7D)。 由此可见,重复天敌声音刺激在不影响大鼠的总体运动情况下,经过1 d后能有效引起它们的焦虑样行为。 同样条件下的白色噪音则无焦虑样行为的改变。
经过重复声音应激3 d 后(图8),各组大鼠在旷场中的运动速度相似(P>0.05,图8B)。 重复天敌声音应激的大鼠在中央区的运动路程比例和停留时间比例均显著低于空白对照组和白色噪音处理组(P<0.01,图8C、8D)。 由此可见,经过重复天敌声音刺激3 d 后,大鼠仍处于焦虑状态。
经过重复声音应激7 d 后(图9),各组大鼠在EPM 中的运动速度保持一致(P >0. 05,图9B)。 重复天敌声音应激的大鼠在开臂区的运动路程比例和停留时间比例均显著低于空白对照组和白色噪音处理组(P <0. 01),而1 mg/kg 地西泮能显著提高天敌声音应激大鼠在开臂区的运动路程比例和停留时间比例(P <0. 01,图9C、9D)。 由此可见,重复天敌声音刺激仍能引起大鼠持续的焦虑样行为,而且大鼠不会对此声音产生耐受。
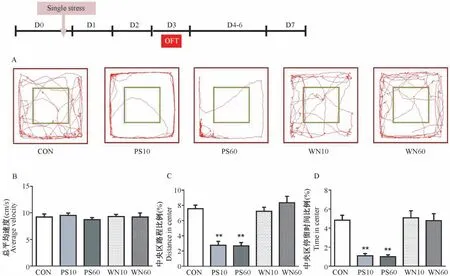
图5 单次应激后第3 天(D3)大鼠在OFT 中的活动情况Figure 5 Activity of the rats at day 3 (D3) after single stress in OFT

图6 单次应激后第7 天(D7)大鼠在EPM 中的活动情况Figure 6 Activity of the rats at day 7 (D7) after single stress in EPM
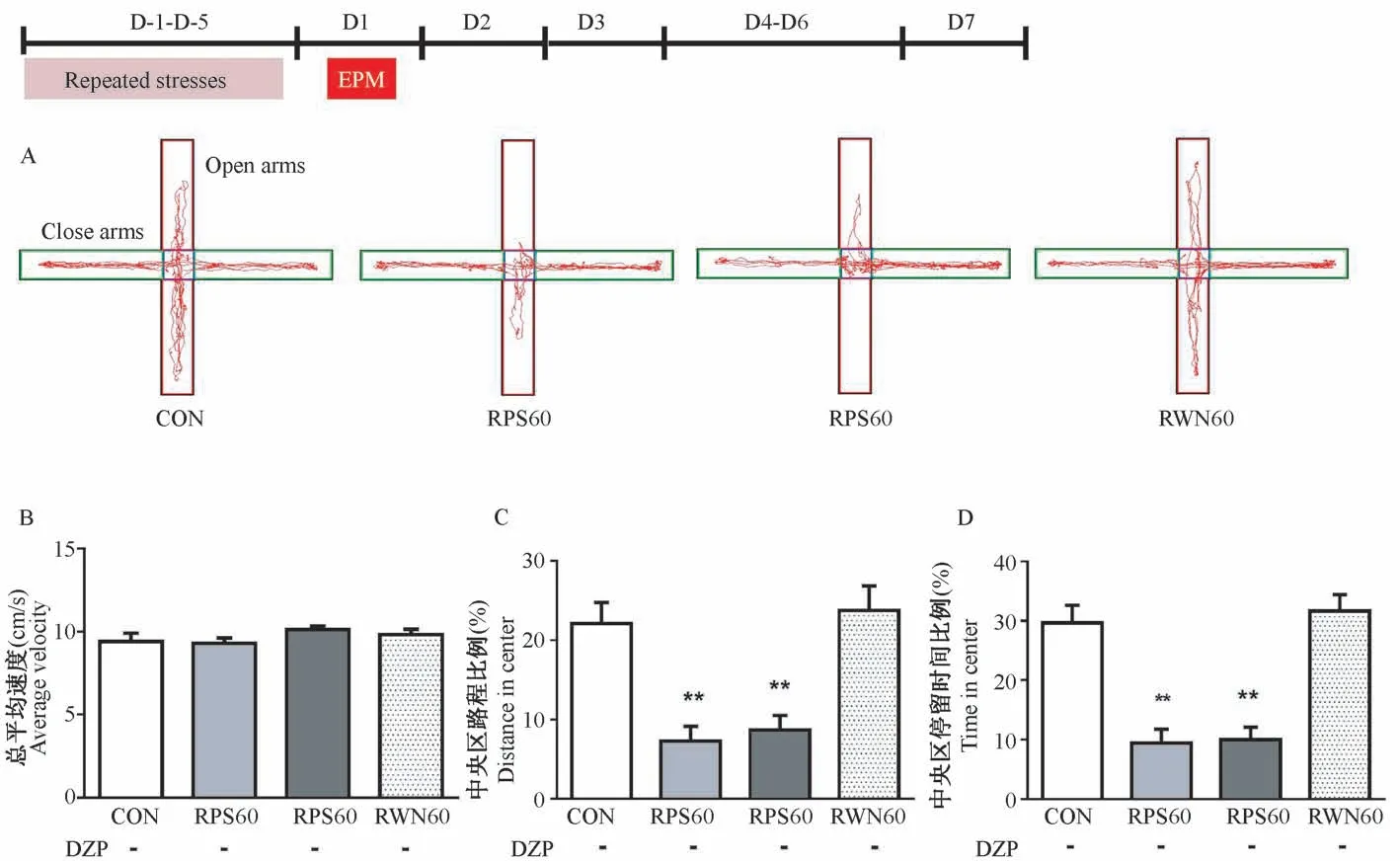
图7 重复应激后第1 天大鼠在EPM 中的活动情况Figure 7 Activity of the rats at D1after repeated stresses in EPM
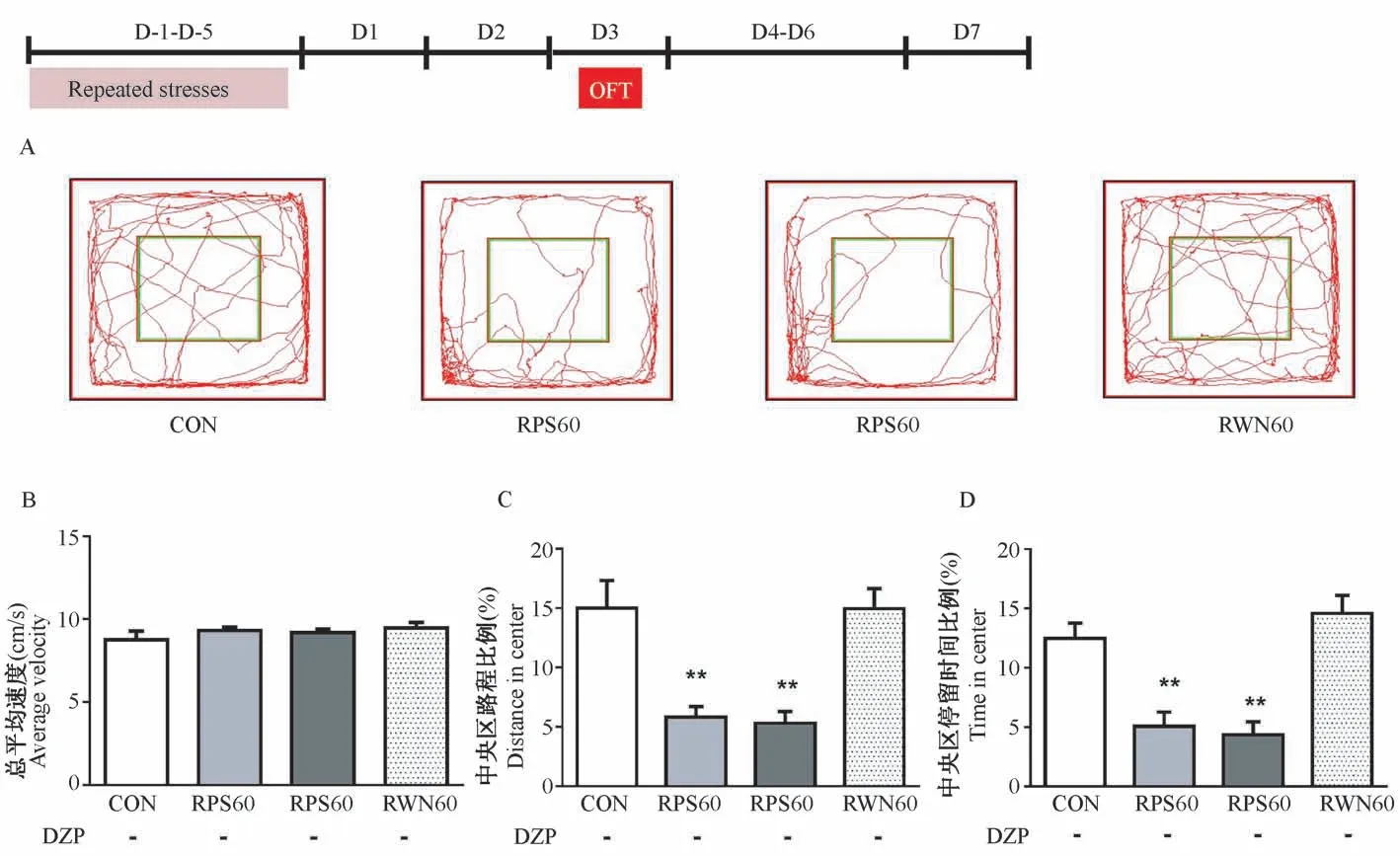
图8 重复应激后第3 天大鼠在OFT 中的活动情况Figure 8 Activity of the rats at D3 after repeated stresses in OFT

图9 重复应激后第7 天大鼠在EPM 中的活动情况Figure 9 Activity of the rats at D1after repeated stresses in EPM
3 讨论
OFT 和EPM 是评价动物焦虑情绪的经典测试方法[15]。 OFT 是由Hall 于1934 年最先提出用于实验动物行为学评价,后经发展为评价动物自主行为活动和焦虑行为的经典方法[16]。 啮齿类动物单独进入旷场后,由于脱离了以往的群居生活,而且旷场面积要比饲养环境更为宽广,从而导致动物产生恐惧,尤其是在旷场的中间区域相比外周区域更容易受到威胁或攻击;鉴于啮齿类动物对旷场中间区域的好奇探索特性与其顾虑情绪的矛盾冲突,从而使其产生焦虑样行为,通过记录动物在旷场中央区的行为变化,可以作为动物焦虑情绪的评价指标[17]。 EPM 源于高架Y 字型迷宫(elevated Y maze),经改进后正式用于焦虑研究[14]。 EPM 用于动物焦虑评价的原理是,EPM 装置距离地面的高度能使啮齿类动物在开臂区产生畏惧情绪,基于啮齿类动物对高架十字迷宫开臂区的好奇探索和在开臂区的危险意识而产生恐惧逃避的心理冲突,而产生焦虑行为的改变,通过记录动物在EPM 开臂区的行为变化,可以作为动物焦虑情绪的评价指标[18]。需要明确指出的是,这两种测试方法有时会被误以为是“焦虑动物模型”,但它们仅能在测试过程中反映动物自身的焦虑行为变化,不能使动物表现出持续性的焦虑状态,也不能造成相应的病理改变,即焦虑症的发生。 因此OFT 和EPM 可用于监测动物的焦虑行为变化或评价药物的抗焦虑效果,但并不能作为探究焦虑症的发病机制和针对焦虑症治疗药物评价的动物模型[5]。 焦虑症动物模型应该是在一定外界刺激条件下产生持续性的焦虑情绪、相关的行为学指征和生化指标的变化,而且能被抗焦虑药所验证。 本课题组前期研究发现,60 dB 天敌声音刺激能引起SD 大鼠的焦虑样行为的增加和血浆中ACTH 和皮质酮水平的升高,由此提示天敌声音诱导动物焦虑症模型的可行性[19]。 然而这个模型还有很多影响因素有待进一步探索,例如天敌声音的刺激时长和反复刺激是如何影响该模型的焦虑样行为变化等。 故本课题组对此进行了探索。
本研究的结果提示,大鼠在单次天敌声音刺激后,能维持较高的焦虑效应至少7 d,而且10 min 和60 min 的刺激时长引起的焦虑效应无差异,从实验人员便捷省时的角度来看,天敌声音10 min 刺激的造模条件似乎更佳。 相同条件下的白色噪音则无法增加大鼠的焦虑样行为。 此外,为了考察天敌声音刺激的次数和每次刺激的时长两方面对模型的影响,本研究进一步通过每天天敌声音60 min 刺激,持续5 d 的造模条件,观察大鼠对刺激源的耐受性。 在重复天敌声音刺激5 d 后,大鼠仍能产生焦虑样行为,其效应可持续至少7 d,相同条件下的白色噪音则无此效应。 地西泮作为经典的抗焦虑药,可用于验证焦虑动物模型[20]。 本研究发现,地西泮能有效抑制重复天敌声音应激7 d 后大鼠的焦虑效应,进一步证明天敌声音大鼠模型的有效性,并提示该模型可用于抗焦虑药疗效和机制探索的可能性。
由此可见,天敌声音的强度仅在60 dB、应激10 min 内即可起焦虑样行为,其效应能持续至少7 d,而且重复应激不耐受。 因此,天敌声音诱导的大鼠焦虑模型具有以下优势:(1)操作简便。 天敌声音可以直接在笼具旁或测试的动物房内播放,避免天敌动物及其气味进入动物房造成污染,可同时对多只动物进行应激。 (2)天敌声音应激的指标可控性强。 包括天敌声音的强度和频率均可检测,其强度和播放时长亦易于人为控制。 (3)对操作者和动物的损害较小。 高分贝噪音长时间的刺激会对机体造成损伤,尤其是实验动物可能会有癫痫、耳聋等的损害[12,21];而因天敌声音的声响低和播放的时长较短,不会引起操作者的不适,对动物产生器质性病变的风险也能有所降低。 鉴于以上,本课题组利用天敌声音诱导建立了一种便捷可靠的大鼠焦虑模型,可能为焦虑症的认识和抗焦虑新药筛选提供便利有效的模型工具。

