丹酚酸A对肝纤维化大鼠TGF-β1/Smad信号通路的影响*
吴雄健,郑 虹
(赣南医学院 1.第一附属医院消化内科;2.2016级硕士研究生,江西 赣州 341000)
肝纤维化是机体对各种原因所致的慢性肝损伤的修复反应,是各种慢性肝病向肝硬化发展的中间环节,其本质是机体对慢性肝损伤修复过程中的代偿反应。在发达国家,肝纤维化的主要病因是乙醇滥用、慢性丙型肝炎(HCV)和非酒精性脂肪性肝病(NAFLD)[1],而在我国则以慢性乙型肝炎为主。肝纤维化可通过戒酒、调整饮食结构和减肥及抗病毒等去除病因的方法来治疗。然而,绝大多数肝病难以从根本上去除病因,如乙肝、自身免疫性肝炎等。由于供体的短缺限制了大多数患者接受肝移植这种失代偿肝病公认有效的治疗方法[2]。因此,针对肝纤维化的发病机制,干预某些发病环节,成为纤维化治疗的有效手段。
1 材料和方法
1.1实验动物健康雄性SD大鼠48只,赣南医学院实验动物研究所提供[许可证号:SCXK(赣)2014-0001],体重(200±20) g。
1.2主要实验试剂丹酚酸A标准品(成都德锐可生物科技有限公司,纯度>95%),CCL4(麦克林生化科技有限公司),BCA蛋白定量试剂盒(美国Thermo Fisher)。α-SMA 兔抗鼠多克隆一抗(碧云天生物技术),TGF-β1、Smad3兔抗鼠单克隆一抗(英国Abcam公司),辣根过氧化酶标记山羊抗兔IgG(碧云天生物技术)。
1.3方法
1.3.1造模及给药随机将48只大鼠分为对照组(N)、模型组(M)、丹酚酸A组(S)和TGF-β1+丹酚酸A组(T),各12只。除了对照组以外,其余大鼠均以花生油稀释的40%的CCL4溶液(3 mL·kg-1)皮下注射,每周2次,共8周。对照组注射等量生理盐水。造模完成后,丹酚酸A组和TGF-β1+丹酚酸A组腹腔注射丹酚酸A 10 mg·(kg·d)-1和TGF-β15 μg·(kg·d)-1+丹酚酸A 10 mg·(kg·d)-1,共6周。6周后处死大鼠取肝组织。一部分用10%的甲醛固定后留备后续制作石蜡切片,另一部分则保存于-70 ℃冰箱中,用于后续的分子生物学检测。
1.3.2 HE染色在组织块经过固定后,常规进行石蜡包埋、切片。对切片进行HE染色。根据Ishak评分对各组大鼠的纤维化程度进行评分。0分:无纤维化改变;1分:少数汇管区域的纤维增生,伴或不伴纤维间隔;2分:多数汇管区域的纤维增生,伴或不伴纤维间隔;3分:多数汇管区域的纤维增生,偶见汇管区的纤维桥连;4分:汇管区域的纤维增生伴明显的纤维桥连(汇管-汇管之间及汇管-中央静脉之间);5分:明显的桥接纤维化(汇管-汇管之间及汇管-中央静脉之间),偶尔可见肝硬化结节(不完全硬化);6分:可能或明确的肝硬化。
1.3.3RT-PCR
1.3.3.1肝组织总RNA的提取取60 mg肝组织,加1 mL的Trizol匀浆后冰上放置5 min;加200 μL的氯仿,震荡混匀30 s后冰上静置4 min,离心15 min(4 ℃、12 000 rpm);取上层的无色水相加等体积异丙醇混匀室温放置15 min,离心15 min(4 ℃、12 000 rpm);弃上清,加1 mL 75%的乙醇混匀后离心5 min(4 ℃、12 000 rpm);弃上清后晾干2~3 min;加DEPC水使RNA能够充分溶解;用酶标仪检测RNA纯度。
1.3.3.2逆转录合成cDNA RNA逆转录合成cDNA。按照TIANGEN公司FastQuant RT Kit(with gDNase)试剂盒说明书操作,建立逆转录的反应体系。将5×gDNA Buffer、FQ-RT Primer Mix、10×Fast RT Buffer、RNase-Free dd H2O及样品RNA置于冰上。gDNA去除反应体系是按说明书配置并混匀,瞬时离心,42 ℃,孵育3 min,冰上放置。反转录反应体系的混合液加入到gDNA去除反应体系中并混匀,42 ℃,孵育15 min,95 ℃,孵育3 min,置于冰上或-70 ℃保存备用。
1.3.3.3RT-PCR溶解2×ChamQ SYBR qPCR Master Mix、cDNA模板,α-SMA、TGF-β1、Smad3、β-actin基因引物和RNase-Free dd H2O。在冰上配置Real Time PCR反应体系,标记八连管后短暂离心,放于PCR仪中,进行反应。对α-SMA、TGF-β1、Smad3和β-actin基因相对表达量进行计算,进而得到目的基因的相对表达量。
1.3.4 Western Blot检测各组目的蛋白表达情况
1.3.4.1肝组织总蛋白的提取取肝组织20 mg用剪刀剪碎。加200 μL含有PMSF的裂解液后匀浆。几分钟后重复匀浆尽量使组织碾碎。置于冰上30 min后离心5 min(4 ℃、12 000 rpm)。取上清,使用Pierce®BCA Protein Assay Kit试剂盒检测蛋白浓度。
1.3.4.2 Western Blot方法检测各组目的蛋白表达情况根据蛋白浓度,每孔上样50 μg蛋白。蛋白样品与6×蛋白上样缓冲液以5∶1的比例混合,100 ℃,10 min使蛋白变性。配置12%的分离胶和5%的浓缩胶,上样后开始电泳(80 V),然后恒流转膜200 mA,时间60 min。封闭液封闭1 h,一抗:α-SMA(1∶300),TGF-β1(1∶1 000),Smad3(1∶5 000),4 ℃过夜,二抗:1∶1 000,1 h。β-actin作为内参。化学发光后,在成像系统中曝光。

2 结 果
2.1肝脏大体形态观察皮下注射CCL4后的大鼠精神萎靡,摄入减少,活动量减少。肉眼可见所取得的对照组大鼠肝脏表面平滑,质软,呈红褐色,模型组大鼠肝脏表面有颗粒状凹凸不平,触之有韧性,呈黄褐色,部分可见腹腔积液。丹酚酸A组大鼠肝脏表面较光滑,质地较柔软,较少出现腹腔积液,TGF-β1+丹酚酸A组大鼠与模型组大鼠相似,部分大鼠可见腹腔积液。
2.2肝脏组织病理学观察HE染色后对照组大鼠组织标本可见肝小叶完整,肝细胞围绕中央静脉向周围放射状排列,分布规则。模型组大鼠肝小叶结构明显改变,肝组织内可见大量脂滴,可见炎性细胞浸润在门静脉和中央静脉周围,细胞外基质增生明显,纤维间隔较长,且部分形成早期肝硬化的大小结节。丹酚酸A组大鼠肝小叶结构改善明显,炎性细胞浸润减轻,坏死程度降低。TGF-β1+丹酚酸A组大鼠肝小叶结构改变明显,肝组织内存在大量脂滴,且可见炎性细胞浸润在门静脉和中央静脉周围,细胞外基质增生明显,细胞间纤维间隔增加(图1)。
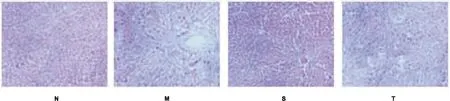
图1 各组大鼠肝脏细胞HE染色(40×)
2.3肝脏纤维化评分各组大鼠肝纤维化程度分级见表1,结果可见,对照组肝小叶结构正常,模型组肝纤维化改变明显,丹酚酸A组与模型组相比肝纤维化程度明显改善(P<0.05),与模型组比较,TGF-β1+丹酚酸A组肝纤维化程度无明显差异。

表1 各组肝脏纤维化评分
注:与对照组比较,*P<0.05;S组与M组相比,T组与S组相比,#P<0.05。
2.4 RT-PCR检测细胞中α-SMA、TGF-β1、Smad3mRNA的表达模型组、丹酚酸A组及TGF-β1+丹酚酸A组中α-SMA mRNA的相对表达量明显高于对照组(P<0.05)。与模型组相比,丹酚酸A组α-SMA mRNA的表达量降低(P<0.05)。TGF-β1+丹酚酸A组α-SMA mRNA表达量与模型组比差异无统计学意义(P>0.05)。与丹酚酸A组比,TGF-β1+丹酚酸A组α-SMA mRNA表达量增高(P<0.05)。模型组、丹酚酸A组及TGF-β1+丹酚酸A组TGF-β1mRNA的相对表达量明显高于对照组(P<0.05)。丹酚酸A组TGF-β1mRNA的表达量比模型组大鼠降低明显(P<0.05)。TGF-β1+丹酚酸A组TGF-β1mRNA表达量与模型组相比差异无统计学意义(P>0.05)。与丹酚酸A组相比,TGF-β1+丹酚酸A组TGF-β1mRNA表达量明显增高(P<0.05)。模型组、丹酚酸A组及TGF-β1+丹酚酸A组Smad3 mRNA的相对表达量比对照组升高明显(P<0.05)。丹酚酸A组大鼠Smad3 mRNA的表达量比模型组低(P<0.05)。TGF-β1+丹酚酸A组Smad3 mRNA的表达量与模型组相比差异无统计学意义(P>0.05)。与丹酚酸A组比,TGF-β1+丹酚酸A组Smad3 mRNA的表达量增高(P<0.05)。见表2。
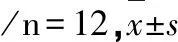
表2 各组大鼠肝细胞中mRNA的相对表达量
注:与对照组比较,*P<0.05;S组与M组相比,T组与S组相比,#P<0.05。
2.5 Western Blot法检测各组细胞中α-SMA、TGF-β1、Smad3的蛋白表达模型组、丹酚酸A组和TGF-β1+丹酚酸A组α-SMA蛋白的相对表达量比对照组明显增高(P<0.05)。与模型组比,丹酚酸A组α-SMA蛋白的相对表达量降低(P<0.05)。TGF-β1+丹酚酸A组α-SMA蛋白的相对表达量与模型组大鼠相比差异无统计学意义(P>0.05)。与丹酚酸A组比,TGF-β1+丹酚酸A组α-SMA蛋白的相对表达量增高(P<0.05)。模型组、丹酚酸A组和TGF-β1+丹酚酸A组TGF-β1蛋白的相对表达量比对照组高(P<0.05)。丹酚酸A组TGF-β1蛋白的相对表达量比模型组低(P<0.05)。TGF-β1+丹酚酸A组TGF-β1蛋白的相对表达量与模型组相比差异无统计学意义(P>0.05)。与丹酚酸A组比,TGF-β1+丹酚酸A组TGF-β1蛋白的相对表达量增高(P<0.05)。模型组、丹酚酸A组和TGF-β1+丹酚酸A组Smad3蛋白的相对表达量比对照组高(P<0.05)。丹酚酸A组Smad3蛋白的相对表达量比模型组低(P<0.05)。TGF-β1+丹酚酸A组Smad3蛋白的相对表达量与模型组比差异无统计学意义(P>0.05)。与丹酚酸A组比,TGF-β1+丹酚酸A组Smad3蛋白的相对表达量增高(P<0.05)。见表3、图2。
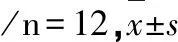
表3 各组大鼠细胞中蛋白的相对表达量
注:与对照组比较,*P<0.05;S组与M组相比,T组与S组相比,#P<0.05。

图2 各组大鼠细胞中蛋白电泳图
3 讨 论
肝纤维化是在各型肝炎病毒感染、酒精和脂肪性肝病、胆汁和自身免疫性肝病后发生的一种肝损伤后的慢性修复反应。其本质是ECM的过度沉积和HSCs的活化[3]。目前认为,肝纤维化发展的核心在于HSCs的激活[4-6]。活化的HSCs的主要特征包括HSCs的增殖和HSCs内α-SMA的表达[7-8]。活化的HSCs不仅可以自分泌大量生长因子促进自身增殖和胶原分泌,还可以分泌MMPs和TIMPs等。ECM的动态平衡有赖于MMP及TIMP之间的动态平衡,ECM的生成与降解失衡是肝纤维化发生的最主要原因[9-12]。
目前已知,TGF-β1/Smad信号通路与肝纤维化的发生发展紧密相关。TGF-β1/Smad信号通路现已明确可以刺激HSCs的活化进而转化为MFB,在HSCs活化早期刺激ECM的合成与沉积。HSCs活化后也可分泌TGF-β1,使其在体内的表达量增高。TGF-β包括许多亚型,在脊椎动物中分为TGF-β、活动素(activin)和骨成型蛋白(BMPs)[13];在哺乳动物中则分为TGF-β1、TGF-β2和TGF-β33种,TGF-β1在肝脏中的含量最高[14]。正常情况下肝脏中TGF-β1的表达量很少,主要在Kupffer细胞、储脂细胞等细胞中产生。当致病因子作用时TGF-β1会大量合成和分泌[15]。在肝纤维化的形成过程中,TGF-β1是一种促纤维化的细胞因子[16],其下游的胞内信号分子是Smad蛋白,它是TGF-β1信号通路中重要的胞内激酶的底物。当TGF-β1信号通路激活后,可通过Smad蛋白调控膜受体到核内基因信号的转导。Smad蛋白包括至少8个亚型,可分为3大类:第一类是膜受体激活的Smad(R-Smad),R-Smad主要包括Smad1、Smad2、Smad3、Smad5、Smad8。第二类是通用的Smad(Co-Smad),Co-Smad目前只包含Smad4。第三类则是抑制性Smad(I-Smad),I-Smad包括Smad6、Smad7,这类Smad蛋白是TGF-β信号通路的抑制因子[17-18]。活化的HSCs可刺激体内TGF-β1的分泌,当TGF-β1/Smad信号通路激活后,使胞内R-Smad(Smad2、Smad3和Smad4)激活并发生磷酸化,此时它将从胞内转移至核内,其在核内的作用可促使TIMPs、各类胶原纤维表达增加,从而破坏ECM的动态平衡。MMPs对ECM的降解具有重要作用,TGF-β1/Smad信号通路激活后,一方面加快了肝纤维化的进程,另一方面可激活HSCs并转化为MFB,从而使TIMPs的合成增加,抑制MMPs的作用,使ECM的产生增加,导致肝纤维化的形成。本实验中丹酚酸A组的α-SMA、TGF-β1和Smad3 mRNA和蛋白的表达量均降低,从而降低了CCL4所致的肝纤维化的程度,保护了肝脏组织。而在TGF-β1+丹酚酸A组中,虽然有丹酚酸A致纤维化的延缓作用,然而,TGF-β1作为外源性的TGF-β1/Smad信号通路的激活因子,促进了信号通路激活后的致纤维化作用,因此,丹酚酸A在TGF-β1+丹酚酸A组中的治疗作用不显著。通过本实验研究表明丹酚酸A可以通过抑制TGF-β1/Smad信号通路达到缓解肝纤维化发展的作用。
本实验研究结果表明,丹酚酸A可以通过抑制TGF-β1/Smad信号通路来发挥延缓大鼠肝纤维化进展的生物学作用。

