腐植酸改性强化磁铁矿吸附水体中铅镉的实验研究
邵坤, 赵改红, 赵朝辉
(中国地质科学院矿产综合利用研究所, 四川 成都 610041)
铅镉在土壤、地下水和地表水中检出浓度较高,已成为备受关注的环境污染问题。工业废水和矿山废水是环境中铅镉的主要来源[1]。由于铅镉具有生物富集性、持久性和高毒性等特征,严重危害公众健康和生态安全,因此是优先控制的重金属污染物。常见废水中铅镉的处理方法有化学沉淀、螯合沉淀、离子交换、膜分离、电化学、浮选、吸附等[2]。其中,吸附法因操作简单、成本低廉、稳定高效等优点受到广泛青睐,常用的吸附材料有合成树脂[3]、纳米材料[4]、矿物材料[5]、微生物[6]、生物炭[7]等。
自然界中,矿物材料广泛存在并且价廉易得,大多具备比表面积大、吸附容量高、环境相容性好及毒性低等特征,已成为重金属吸附材料的重点研究对象之一[8]。已报道的矿物吸附材料有蛭石[9]、沸石[10]、鸟粪石[11]、褐铁矿[12]、黄铁矿[13]、针铁矿[14]、磁铁矿[15]等。磁铁矿是以Fe3O4为主的金属变价氧化矿物,表面富含水合羟基[16],易与重金属离子通过静电作用、离子交换和氧化还原等形式发生吸附反应。此外,其特有的磁性易于被外部磁场分离,避免了吸附剂与水体难以快速有效分离而造成二次污染的潜在风险,因此是一种非常难得的环境友好型吸附材料。但是,天然磁铁矿在吸附时易出现吸附容量偏低、选择性差、矿粒易团聚等现象,实际应用时需要进行改性以提高其吸附性能。目前对天然磁铁矿的改性方式有两种:一是无机改性法,即通过无机酸碱、盐类、焙烧等方法改变磁铁矿表面形态和微观结构,从而改善其吸附性能[17],但是靶向识别重金属离子的能力不强,如大量吸附位点易被碱金属或碱土金属占据。二是有机改性法,其优点是实现了磁铁矿的有机化,通过交联反应将具有靶向识别重金属离子的功能基团接枝到磁性颗粒表面,实现对水中重金属离子的靶向吸附[18-20]。但是大多的有机改性所采用的改性剂都需经过化学合成,易产生二次污染,且合成条件控制严格,成本过高,因此有必要制备一种低成本、少污染的磁性吸附材料以进一步改善其吸附性能。腐植酸是一类带电荷的天然高分子化合物,含有羧基、羟基等活性官能团,对环境中许多重金属离子具有很强的靶向螯合能力[5,21-24]。本文基于磁铁矿易分离、腐植酸靶向螯合的特点,采用常温水相反应制备了腐植酸改性磁铁矿吸附材料,经多种表征手段和吸附实验证实该材料强化了磁铁矿的吸附性能。
1 实验部分
1.1 标准溶液和主要试剂
硝酸铅、硝酸镉标准溶液:购自国家有色金属及电子材料分析测试中心。
磁铁矿粉:购自上海肴弋合金材料有限公司,比表面积为35m2/g。
腐植酸(主要成分为胡敏酸,分析纯,天津市光复精细化工研究所),预处理方法为:5%氢氧化钠溶解,过滤,滤液用1%硝酸沉淀,过滤,水洗,烘干,使用前配成质量浓度为500mg/L的水溶液。
盐酸、硝酸、氢氧化钠等均为分析纯,购自西陇化工股份有限公司。实验用水为蒸馏水。
1.2 仪器与设备
材料的表面官能团类型采用傅里叶红外光谱仪(Nicolet 6700,美国ThermoFisher公司)表征;表面形貌观察使用场发射扫描电镜(SIGMA500,德国卡尔.蔡司公司);表面元素形态及组成测定采用X射线光电子能谱仪(250xi,美国ThermoFisher公司);重金属离子浓度测定采用电感耦合等离子体质谱仪(NexIon 350s,美国PerkinElmer公司)和电感耦合等离子体发射光谱仪(ICP 5300V,美国PerkinElmer公司)[25]。
材料制备及吸附实验使用振荡器(HY-8A,金坛天竞实验仪器厂);溶液pH测定采用pH计(PHS-3,上海佑科仪器有限公司)。
1.3 材料制备
磁铁矿颗粒投入0.5mol/L盐酸(固液比1∶10)中室温(25℃)浸泡12h,过滤,60℃烘干[17],此为表面活化磁铁矿。然后称取5g活化磁铁矿投入200mL 500mg/L腐植酸溶液中,用0.1mol/L盐酸和0.1mol/L氢氧化钠调节pH 2~3[26],室温振荡(转速150r/min)72h。采用磁铁分离出混合物,水洗至中性,于60℃干燥12h,即制备成腐植酸改性磁铁矿吸附材料。
1.4 吸附实验
初始pH影响实验:以静态批式吸附实验进行。取质量浓度均为10mg/L Pb2+、Cd2+混合溶液100mL于250mL锥形瓶中,用0.1mol/L盐酸和0.1mol/L氢氧化钠调节pH分别为3、4、5、6、7、8、9,准确加入一定量的腐植酸改性磁铁矿,于室温(25℃)振荡(转速150r/min)至吸附平衡。磁铁分离,测定剩余溶液中重金属离子的质量浓度。
吸附动力学实验:配制一组初始质量浓度均为10mg/L的Pb2+、Cd2+混合溶液于250mL锥形瓶中,加入500mg/L腐植酸改性磁铁矿,室温(25℃)振荡(转速150r/min),分别于30、60、120、180、240、300、360、420、480min后用磁铁分离,测定剩余溶液中重金属离子的质量浓度。
吸附等温线实验:配制初始质量浓度分别为5、10、15、20、25、30、40mg/L的Pb2+、Cd2+混合溶液于250mL锥形瓶中,加入500mg/L腐植酸改性磁铁矿,室温(25℃)振荡(转速150r/min)360min。磁铁分离,测定剩余溶液中重金属离子的质量浓度。
按下列公式计算腐植酸改性磁铁矿对Pb2+、Cd2+的吸附容量q(mg/g)和吸附率η(%):
q=(ρo-ρe)×V/m
(1)
η=(ρo-ρe)/ρo×100%
(2)
式中:ρo和ρe分别为金属离子的初始质量浓度和吸附后的平衡质量浓度(mg/L);V为溶液的体积(mL);m为改性磁铁矿的质量(mg)。

图1 磁铁矿(a)、腐植酸(b)和腐植酸改性磁铁矿(c)的红外光谱图Fig.1 FTIR spectrograms of (a) magnetite, (b) humic acid and (c) humic acid-modified magnetite
2 磁铁矿改性性能表征
2.1 磁铁矿改性前后的红外光谱特征

2.2 磁铁矿改性前后的扫描电镜特征
图2为磁铁矿改性前后的扫描电镜图(SEM)。对比图2a和b可以看出,改性前的磁铁矿颗粒呈现片层状,表面比较平滑和坚固(图2a)。经过改性后,磁铁矿颗粒的表面粗糙不平,包覆有大量的腐植酸颗粒,部分颗粒呈球状且粒径较小,并有小孔出现(图2b)。可见改性后的磁铁矿比表面积显著增大,吸附位点明显增多。
2.3 磁铁矿改性前后的X射线光电子能谱特征
图3为磁铁矿改性前后的X射线光电子能谱图(XPS)。改性后的磁铁矿(图3b)的C1s和O1s电子峰强度较改性前(图3a)有明显增加,说明含有C、O的官能团被接枝到了磁铁矿表面,这与红外光谱图1c中出现有羧基和羟基特征峰的结论相一致。另外改性后的磁铁矿(图3b)的Si 2p、Al 2p电子峰强度较改性前(图3a)有明显减弱,根据扫描电镜图2b可知,磁铁矿表面被大量腐植酸颗粒包覆,因此可认为是Si 2p、Al 2p的光电子经过包覆层后强度减弱所致。综合以上可以说明本研究制备的腐植酸改性磁铁矿吸附材料具有一定的实用性。

图2 磁铁矿(a)和腐植酸改性磁铁矿(b)扫描电镜图Fig.2 SEM images of (a) magnetite and (b) humic acid-modified magnetite

图3 磁铁矿(a)和腐植酸改性磁铁矿(b)的X射线光电子能谱图Fig.3 XPS spectrograms of (a) magnetite and (b) humic acid-modified magnetite
3 吸附改性条件的影响和吸附动力学机理
3.1 初始pH的影响
溶液初始pH会影响吸附材料的表面电荷状态、重金属离子解离程度和存在形式,进而改变吸附材料与重金属离子间的相互作用[21]。图4为溶液初始pH对Pb2+、Cd2+吸附率的影响,可见初始pH对两元素的吸附率明显不同,初始pH对Pb2+几乎无影响,但是对Cd2+的影响较大。一般认为,天然腐植酸吸附重金属离子的机理主要包括两部分:pH<4时发生离子交换作用,如2R-AH+M2+=(R-A)2M+2H+;pH4~7时发生螯合作用,如nR-A+mM2+=Mm(A-R)n[23]。朱丽珺等[24]研究也表明在pH很低时,羧基和羟基仍能与Pb2+进行螯合反应。因此在低pH时,可以认为游离态Pb2+主要通过离子键和配位键与腐植酸改性磁铁矿表面的羧基、羟基发生吸附作用。随着pH升高,在中性或弱碱性介质中,腐植酸改性磁铁矿表面吸附的H+被解离,增加了羧基、羟基等游离官能团,导致吸附位点进一步增多。同时,Pb2+在低酸度时容易发生如式(3)的水解反应[27],有利于增强羧基、羟基与Pb2+水解产物之间的交换亲和力。
mPb2++nH2O→Pbm(OH)n(2m-n)+nH+
(3)

图4 初始pH对腐植酸改性磁铁矿吸附Pb2+和Cd2+的影响Fig.4 Effect of initial pH on the adsorption of Pb2+ and Cd2+ by humic acid-modified magnetite
由以上公式(3)可知,Pb2+有多种水解产物,但是Cd在水中多以二价离子态存在,部分以Cd(OH)+的形态存在[28],因此pH对Cd2+吸附率的影响比Pb2+大。由图4可见,在pH 3~5的范围内Cd2+吸附率快速增加,直至pH 6时Cd2+的吸附率和Pb2+基本一致。推测在pH较低时,大量H+会生成H3O+结合在腐植酸改性磁铁矿表面,导致吸附位点质子化,表面带正电荷。Cd2+由于静电斥力无法靠近吸附位点,从而抑制了对Cd2+的吸附。当pH升高时,腐植酸改性磁铁矿表面的电负性增强,对Cd2+产生了静电引力作用,同时部分Cd2+与OH-结合形成Cd(OH)+,提高了吸附位点与Cd2+之间的结合能力[29]。陆中桂等[21]认为,腐植酸对Pb2+、Cd2+吸附存在差异的主要原因是它们的电子层分布、水合离子半径、电荷性质以及水合能不同。铅外层电子层分布为6s26p2,Pb2+半径为120pm,镉外层电子层分布为4d105s2,Cd2+半径为97pm,说明Pb生成的水合离子较Cd更加稳定,因此腐植酸改性磁铁矿对Pb2+的螯合能力强于Cd2+。
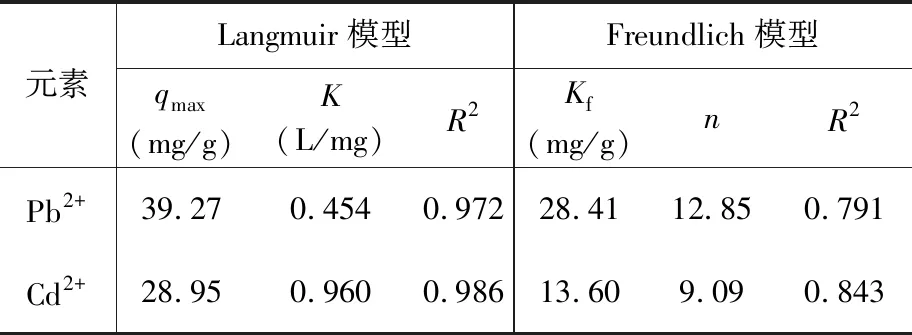
总体来看,适当提高pH对吸附有利,但是随着pH升高Pb2+、Cd2+均会以沉淀形式析出,因此很难判断在碱性条件下Pb2+、Cd2+是被材料吸附还是本身生成了沉淀[4]。本文通过理论推算:在pH=7,室温25℃时,对于Pb2+,Ksp[Pb(OH)2]=1.43×10-20,[Pb2+][OH-]2=2.4×10-7×1×10-14=2.4×10-21 吸附动力学主要研究吸附容量随时间的变化规律,反映了吸附速率的大小[7]。按照1.4节实验方法考察了腐植酸改性磁铁矿对Pb2+、Cd2+吸附容量随时间的变化规律,结果表明腐植酸改性磁铁矿对Pb2+、Cd2+的吸附具有较快的动力学速度,其中对Pb2+的吸附约240min达到平衡,对Cd2+的吸附约360min达到平衡,以后随着时间的增加吸附容量增加不大。考虑使吸附反应完全,本研究最终确定的静态吸附时间为360min。 运用准二级反应动力学模型对实验数据进行分析,模型方程如下[13]: 式中:k2是准二级吸附速率常数,qt、qe分别为t时刻、吸附平衡时吸附材料对重金属离子的吸附容量(mg/g)。 Pb2+、Cd2+准二级动力学模型拟合方程分别为t/qe=0.0259t+1.2604(R2=0.993),t/qe=0.0453t+0.7482(R2=0.995),可以看出其相关系数(R2)均在0.99以上。根据准二级动力学方程计算得到Pb2+、Cd2+的qe值分别为33.29、22.35mg/g,与实际测定的平衡吸附容量(31.74、24.18mg/g)非常接近,说明准二级动力学可以较好地描述腐植酸改性磁铁矿对Pb2+、Cd2+的吸附过程,该吸附可能包括物理扩散过程和化学吸附过程,化学吸附是吸附过程速率的控制步骤[21]。 吸附等温线用于描述不同平衡浓度下的吸附容量,在一定程度上反映出吸附质和吸附剂相互作用的强度,以及吸附质在吸附剂界面的状态和吸附层结构[16]。按照1.4节实验方法进行腐植酸改性磁铁矿对Pb2+、Cd2+的等温吸附实验,结果表明随着初始质量浓度的增加,Pb2+、Cd2+两者的吸附容量随之增大。浓度较低时,吸附等温线的斜率较大,曲线急剧上升,表明吸附容量随浓度增加很快,但达到一定浓度时,曲线随着平衡浓度的增大趋于平缓。通过对比发现,腐植酸改性磁铁矿对Pb2+、Cd2+的吸附存在着明显差异,对Pb2+的亲和能力大于Cd2+,这可能与离子电负性大小有关[30],其他研究中也观察到类似的竞争吸附现象[21,28]。 利用Langmuir 和Freundlich吸附等温线模型对实验数据进行拟合,相关参数见表1。由表1可知,Pb2+、Cd2+的LangmuirR2值大于FreundlichR2值,因此吸附过程更适合用Langmuir等温吸附模型描述。基于Langmuir方程的假定条件推断,该吸附过程为表面均匀的单分子层吸附,拟合得到Pb2+、Cd2+饱和吸附容量分别为39.27、28.95mg/g,吸附性能显著优于磁铁矿[29,31]。 表1Langmuir及Freundlich模型拟合参数 Fig.1 Fitting parameters of the Langmuir and Freundlich models 元素Langmuir模型Freundlich模型qmax(mg/g)K(L/mg)R2Kf(mg/g)nR2Pb2+39.270.4540.97228.4112.850.791Cd2+28.950.9600.98613.609.090.843 表2为腐植酸改性磁铁矿与钒钛磁铁矿、针铁矿、蒙脱石等常见改性吸附材料对Pb2+、Cd2+吸附性能的比较,可以看出腐植酸改性磁铁矿对Pb2+、Cd2+具有较好的吸附效果,是一种有较好应用前景的重金属吸附材料。 表2不同改性材料对Pb2+、Cd2+的吸附性能比较 Table 2 Comparison of adsorption properties of Pb2+, Cd2+with various modified minerals 矿物材料改性方法pHPb或Cd的吸附容量(mg/g)参考文献钒钛磁铁矿pH 3,与腐植酸溶液振荡24h,70℃干燥24h7Pb2+ 14.41[5]针铁矿腐植酸溶液与针铁矿1∶1混匀,60℃烘干-Cd2+ 45.46[32]蒙脱石pH5,与腐植酸混合振荡20h,45℃风干5Cd2+ 11.87[33]累托石与腐植酸混匀,再与氯化钙和硼砂混合,50℃干燥24h6Cd2+ 5.97[34]菱铁矿小麦秸秆和菱铁矿500℃碳化60min6~9Cd2+ 19.42[35]腐植酸磺化后进行接枝反应,形成不溶性腐植酸7~9Pb2+ 8.24[24]腐植酸400℃加热1h,冷后2mol/L氯化钙中浸泡2h6Cd2+ 20.00[36]磁铁矿水洗70℃烘干,室温粉碎至20~200目6Pb2+ 16.98[31]磁铁矿0.5mol/L盐酸浸泡48h,150℃灼烧10min7Cd2+ 18.93[29]磁铁矿与腐植酸溶液混合,pH 2~3,振荡72h,60℃干燥72h7Pb2+ 39.27, Cd2+ 28.95本文 以腐植酸为改性剂,室温下直接在水溶液中制备了腐植酸改性磁铁矿吸附材料,材料表征结果证实了磁铁矿表面接枝有羧基、羟基官能团,吸附实验结果表明腐植酸改性磁铁矿对Pb2+、Cd2+的吸附性能明显优于磁铁矿。 本研究可在初始pH为中性的条件下对水中Pb2+、Cd2+进行靶向吸附,通过外加磁场快速分离吸附后的磁性混合物,保证了吸附的便捷性和实用性,有利于在自然条件下开展水污染治理。采用的材料制备方法及吸附条件实验对环境影响小,操作简便,兼具靶向吸附和易分离的优点,有望应用于废水中Pb2+、Cd2+的污染治理。3.2 吸附动力学
3.3 吸附等温线
4 腐植酸改性磁铁矿与其他改性材料的吸附性能比较

5 结论

