黄淮麦区小麦苗期在热胁迫下耐热机理的探索与研究
贾明珠

摘 要:本研究选用在黄淮麦区大面积推广的八种小麦作为实验材料,测定幼苗在热胁迫后的质膜透性、存活率等耐热生理指标。采用细胞膜热稳定性检测方法,测量出相对电导率,分析质膜透性差异的显著性。通过cDNA凝胶电泳检查提取基因的完整性,热激相关基因的实时荧光定量表达分析法,对热激关键基因及蛋白进行定量分析。研究结果发现,中麦175、烟农19、良星99和石优17等新品种在热胁迫后的质膜透性相对比较小,热稳定性比较好,热胁迫后存活率比较高,热激相关基因HSP70的表达水平也比较高,表现出相对耐热性。本研究的数据及结果,为黄淮麦区小麦耐热机理和耐热品种的培育提供了一定的理论基础。
关键词:黄淮麦区小麦;热休克蛋白;质膜透性;耐热性
中图分类号:S512.1 文献标识码:A 文章编号:1671-2064(2019)21-0186-05
1 研究背景
小麦是我国重要的粮食作物,在粮食安全中具有非常重要的作用。随着全球气候变暖和人口的增长,研究和培育耐热高产的农作物新品种是当前一个十分重要的课题。黄淮麦区小麦近年来经常性受到干旱、高温的影响,致使小麦种子干瘪,造成产量严重下降[1-2]。研究表明,高温胁迫对小麦的生长发育、产量和品质均产生不利影响[3]。高温时,植物可以通过热激反应产生热激蛋白来保护植物,可以降低高温的伤害,也可以被称作高温胁迫或者高温锻炼,可以使植物获得耐热性,从而更好地适应高温环境。
细胞或生物体(或离体培养的细胞)受到热激条件影响,伴随着正常蛋白质的合成被抑制,新合成的一类遗传上高度保守的特异蛋白质被诱导且表达,称为热激蛋白(Heat Shock Proteins,HSPs)。热激蛋白的积累是生物对于高温的基本响应,在高于植物正常生长温度刺激下,HSP会被诱导合成,这个反应从细菌到人类都存在,普遍存在于整个生物界。根据分子量(kD)的大小,热激蛋白分为3类:HSP110s、HSP90s、HSP70s、HSP60s和小分子热激蛋白。在应激条件下,高等植物产生高分子量的热休克蛋白(范围在70000~100000之间),主要有HSP100s、HSP90s、HSP70s它们在热胁迫下被显著诱导。热激蛋白通常分布在细胞壁、叶绿体、核糖体和线粒体中,这些组织都是高温传感器分布的部位。在正常生理状态下,热激蛋白主要存在于细胞质中,应激状态时,热激蛋白迅速进入细胞核和核仁行使功能。
HSP70家族包括4种高度保守的蛋白:HSP70、HSC70、GRP75和GRP78,这些蛋白具有多重功能。有研究者认为HSP70可作为感温计,细胞可以通过它感受特定的代谢失调。高温时,植物可以通过热激反应产生热激蛋白来在保护植物,以降低高温的伤害。高粱(Sorghum bicolor)中HSP90基因在热胁迫30~60min时,定量表达水平达到最高。小球藻HSP70B在热胁迫2h后增加最明显。HSPs的合成水平与植物生长的温度密切相关,诱导合成HSP的理想条件是比正常温度高出10℃的热机处理。
细胞膜系统是热损伤和抗热的中心,细胞膜的热稳定性反应了植物耐热能力的大小。其原理是因为在高温条件下细胞膜蛋白变性,膜脂液相化,膜透性增大,导致电解质大量外渗,从而表现出热损害。因此,认为可以测定叶片外渗电导率来确定高温的伤害。随着胁迫温度的升高,细胞膜透性均呈增加趋势,因此细胞膜的热稳定性可以作为抗热性指标。本研究以目前黄淮麦区正在推广的8个小麦品种(系)为材料,对耐高温抗逆性进行了探讨,为小麦耐热机理的研究和耐热品种的培育提供了一定的理论基础。
2 材料、仪器与实验方法
2.1 实验材料及种植
本实验选用的小麦品种农大212(中国农业大学农学与生物技术学院选育)、中麦175(中国农业科学院作物科学研究所选育)、有济麦22号(山东省农业科学院作物研究所选育)、中优206、烟农19(烟台市农科院小麦研究所选育)、新麦26(河南省新乡市农业科学院选育)、石优17(河北石家庄市农林科学院选育)、良星99(山东德州市良星种子研究所选育),都是目前华北地区生产上大面积种植的优良品种。每个小麦品种选饱满、大小一致的籽粒各80粒,经0.3%的双氧水处理过夜后,均匀播种到装有营养土的8×8cm的小花盆中,每盆种20粒。置光照培养室内(光16:暗8小时)培养10天,备用。
2.2 实验仪器
分光光度计ScanDrop,PCR擴增分析仪(powerCycler),化学发光凝胶电泳分析仪azurec300,qRT-PCR定量分析(Qtower2.2),TDS-3/TEMP,超净纯水机,光照培养箱。
2.3 实验方法
2.3.1 质膜透性(细胞膜热稳定性)测定
(1)取小麦幼苗叶片(10天龄),分为三份,用去离子水冲洗数次,使用医疗消毒剪刀将麦苗剪成1厘米长左右,分装入编号的试管内。加入去离子水10ml,用锡纸包住试管口,放在49±1℃水浴锅中处理40min,取出后,室温静置20h。
(2)将试管内浸泡液轻轻摇匀,静置,测定电导率为T1。
(3)将试管口包好后放入120℃高温灭菌锅处理15min。
(4)取出试管后轻轻摇匀静置,测定电导率为T2。
(5)由RI=T1/T2算出相对电导率,分析品种间质膜透性差异。
2.3.2 幼苗存活率测定
(1)取10d未处理的小麦植株,计数每盆中的小麦苗数量。
(2)在培养箱内培养20h,恒温后,取出样苗计存活数量,计算存活率。
2.3.3 小麦幼苗RNA的提取与纯化
(1)实验器材的处理:玻璃器皿经180℃高温处理6小时以上,研钵经燃烧处理,消除RNA酶污染。
(2)药品的处理:氯仿、异戊醇、乙醇等试剂要专用。
(3)其它器材如枪头、离心管,其它试剂如超纯水、醋酸钠等,均需经1‰DEPC水37℃处理过夜。
2.3.4 RNA的提取
在小麦幼苗进行45℃处理的0、4、8、20小时,及恢复7天时,每盆分别剪取少量叶片,液氮速冻,用于RNA的提取。
(1)将上述小麦幼苗叶片在液氮中研磨成粉末,研磨过程中保持粉末的冷冻状态。将0.1g左右的粉末转移到2mL的离心管中。
(2)加入1ml Trizol试剂(RNA提取液,北京天根生化科技有限公司产品),震荡混匀,静止5分钟,再加入200μL氯仿,震荡混匀。
(3)在4℃,12000rpm条件下离心10分钟。
(4)转移600μL上清至另一新的2mL离心管中,注意小心不要取到中间物质。
(5)加入600μL氯仿,震荡混匀。4℃,12000rpm离心10分钟。
(6)将450μL上清转移至一个新的1.5mL离心管中,加入300μL的冰异丙醇,混匀,-20℃放置30分钟。
(7)4℃,12000rpm离心15分钟;弃上清,用1mL70%的乙醇(用DEPC水配制)漂洗RNA沉淀。
(8)在4℃,9000rpm条件下离心5分钟;弃上清,自然晾干(注意不要使RNA彻底干燥,否则很难溶解)。
(9)将RNA用50μL DEPC灭菌水溶解;用分光光度计检测RNA的质量和浓度,A260/A280比值在1.8~2.0之间;取2μlRNA进行琼脂糖凝胶电泳,检测其完整性。
2.3.5 RNA的纯化
(1)每一个离心管中分别加入以下试剂,轻轻混匀(若是从-80℃冰箱中取出RNA,需要先融化,混匀后才使用):
RNA xμL
10×DNase I buffer 10μL
DNase 10μL
DEPC 水 (80-x)μL
RNAsin(40 U/μL) 1μL
Total 100μL
(2)于37℃水浴30分钟;反应体系中加入300μLDEPC灭菌水;
(3)加入等体积的酚:氯仿(1:1),(200μL氯仿+200μL水饱和酚),冰上剧烈混匀10分钟,尽量避免分层,静置10分钟;
(4)条件4℃ 15000g离心10分钟;
(5)取上清350μL,加入1/10体积的3M乙酸钠(pH5.2),混匀,然后,加入2倍体积的无水乙醇,混匀;-80℃放置1小时以上;
(6)于4℃ 15000g离心15分钟;弃上清,用1mL70%的乙醇(DEPC水配制)洗涤沉淀,离心;晾干沉淀(3-5分钟);
(7)加入30μLDEPC灭菌水溶解;
(8)紫外分光光度计检测RNA浓度,将其配成1ug/μL的工作液;
(9)取2μL RNA进行电泳检测其完整性。
2.3.6 RNA的反转录(cDNA第一链合成)与cDNA质量检测
(1)取一离心管(200μL),分别加入以下试剂:
总RNA 2μg
M13apn(10μM) 4μL
DEPC處理的双蒸水 (11-X)μL
Total 15μL
(2)轻轻混匀,70℃水浴5分钟;
(3)冰上冷却5分钟;
(4)加入以下试剂,反应总体积为25 μL:
5×RT-buffer 5μL
dNTPs(25 mM) 1μL
RNAsin(40 U/μL) 1μL
M-MLV反转录酶 1μL
ddH2O 2μL
Total 10μL
(5)用移液器轻轻吸打混匀,37℃温浴90分钟;
(6)于70℃温浴15分钟,灭活反转录酶活性;
(7)将合成产物稀释5倍,即为工作液;
(8)用引物Tubulin2(5-ACCGCCAGCTCTTCCACCCT-3)和Tubulin3(5-TCACTGGGGCATA GGAGGAA-3)做PCR,检测反转录效果。
2.3.7 PCR反应体系
LA Taq的反应体系:
LA Taq (5 U/μL) 0.2μL
10 × bufferⅡ(Mg) 2μL
dNTP (2 mM) 4μL
上游引物(4 μM) 2μL
下游引物(4 μM) 2μL
ddH2O 9μL
模板DNA 1μL
反应体系为 20μL
普通Taq酶的反应体系:
Taq(2.5U/μL)0.2μL
10×buffer 2μL
dNTP(2mM) 2μL
上游引物(4μM) 1μL
下游引物(4μM) 1μL
ddH2O 13μL
模板DNA 1μL
反应体系 20μL
以上体系可以根据实际情况做适当调整。
PCR反应过程
95℃ 3-4min
95℃ 30sec
55-65℃ 40sec 35个循环
72℃ 1-2min
72℃ 10min
15℃ 5min
2.3.8 小麦幼苗热激相关基因的表达分析
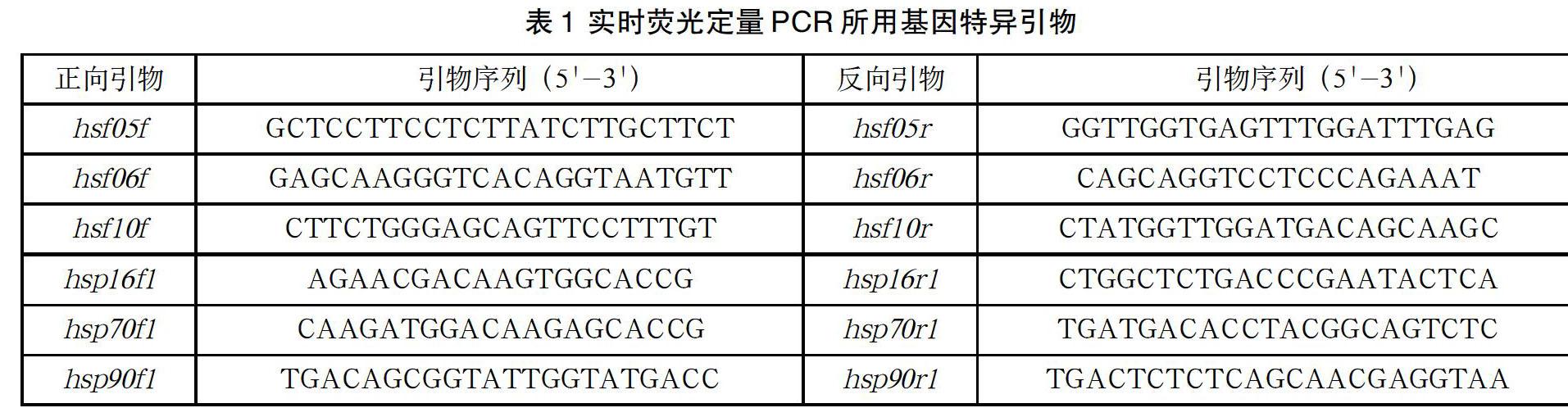
以合成的cDNA为模板,以小麦Ta4045(ubiquinol-cytochrome C reductase iron-sulfur subunit)为内参基因,用hsf05、hsf06、hsf10、hsp16、hsp70及hsp90基因特异正向、反向引物在德国analytikjena qRT-PCR定量分析(Qtower2.2)进行实时荧光定量PCR,检测不同处理时间热激相关基因的表达模式。
3 實验结果与分析
3.1 比较恒温培养不同时间后小麦的形态差异
中麦175、石优17、良星99、烟农19和农大212等5个品种在经过恒温培养22h、44h的热激处理后,麦苗长势比较稳定,麦叶葱绿,表现出较高的耐热性能。中优206、新麦26和济麦22在经过长达22h、44h的热激处理后,麦叶有枯黄现象,出现萎蔫,从麦叶外形上表现出耐热性较差。
3.2 质膜透性检测
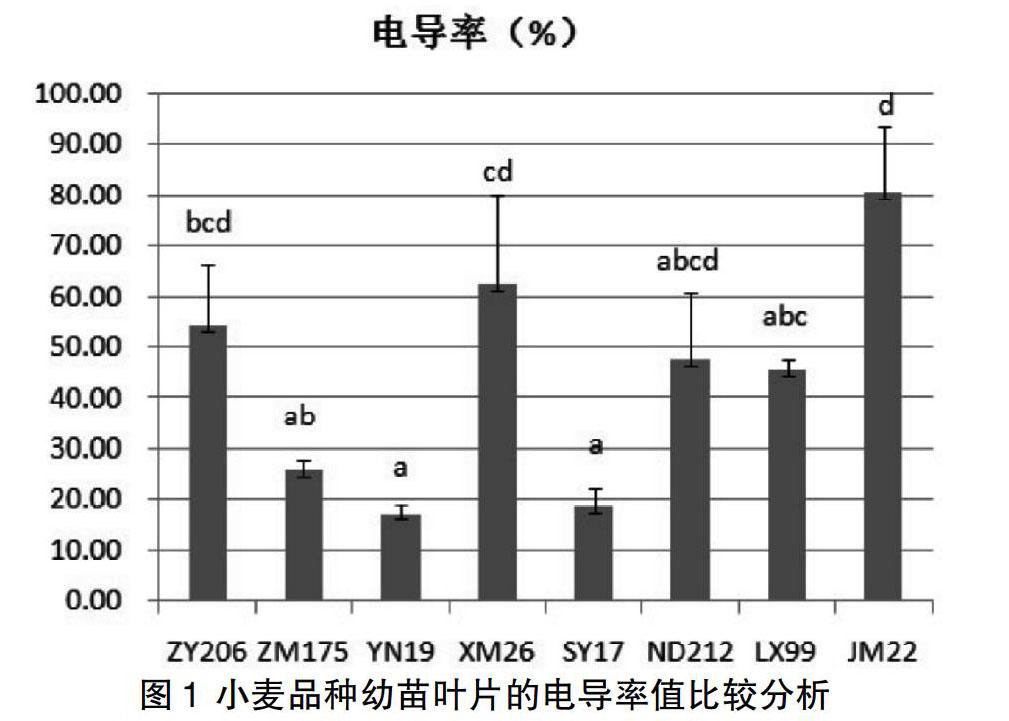
为了明确本实验8个小麦品种幼苗的耐热性,我们测定了其幼苗叶片在热激处理后的电导率,电导率的大小反映出质膜透性的大小,即质膜的热稳定性能。烟农19、石优17和中麦175的幼苗叶片在热激处理后的电导率比较低,说明其质膜透性小,热稳定性比较好;良星99、农大212和中优206的电导率中等,而新麦26和济麦22的电导率高,说明其质膜透性大,热稳定性差,其中以济麦22为最大,其电导率高达80%以上(见图1)。
3.3 幼苗存活率检测
农大212和烟农19的存活率分别为48.8%和55.8%;而中优206和新麦26存活率较低,其存活率分别为20.7%和26%;济麦22的存活率最低,其存活率只有9.5%。说明这几个小麦品种的幼苗耐热性有较大差异,中麦175、石优17、良星99、烟农19和农大212几个品种耐热性较好,而中优206、新麦26和济麦22耐热性较差(见表2)。这跟上述质膜透性的检测结果基本一致。
3.4 小麦材料中提取的RNA和cDNA凝胶电泳
分别提取小麦材料的总RNA,并经RNAseI处理后,用MMLV酶反转录成cDNA。然后用小麦的持家基因TaTubulin引物检测cDNA的质量。如图2A所示,所有样品的RNA都含有完整的未降解的RNA,电泳图谱应可清晰看到18s rRNA、28s rRNA、5s rRNA的三条带且28s rRNA的亮度应为18s rRNA的两倍。提取的总RNA必须完整,凝胶电泳图中条带包括18s,28s的完整性以及5s的完整性。图2B所示所有样品都能扩增出目的产物,表明合成的cDNA质量比较好,可以用于下一步的表达分析。
3.5 小麦的持家基因TaTubulin引物特异性检测
为了准确获知小麦热激相关基因的表达情况,我们首先对这些基因表达引物的特异性进行了检测,如图3所示,绝大多数基因均能扩增出单一目的条带,说明引物特异性比较好,可用于实时荧光定量PCR实验。
3.6 热激相关基因实时荧光定量表达模式分析
高温时,植物可以通过热激反应产生热激蛋白来在保护植物自身,以降低高温的伤害。HSPs的合成水平与植物生长的温度密切相关,诱导合成HSP的理想条件是比正常温度高出10℃的热机处理。HSPs在细胞活力的保护和细胞受高温到胁迫后其功能的恢复上具有重要作用。热应激蛋白按分子量大小可分为HSP100、HSP90、HSP70、HSP60及小分子HSP,每个家族又有多个成员。由于近年来小麦产区持续干旱,使干旱造成的生产损失越来越严重,因此对作物抗旱性的研究已经引起人们广泛重视。
本研究中,通过对8种小麦热激相关基因进行实时荧光定量分析(图4A、B、C),HSP90和HSP70在热胁迫后,所有品种中其相对表达水平比较高,尤其是HSP90基因。它们的表达趋势是先升后降,HSP90的相对表达水平在热激4小时不同品种间除中优206外差异不是很显著,在热激处理8小时烟农19和济麦22达最高表达水平。而HSP70基因在热激处理后,烟农19,良星99,济麦22和新麦26的表达水平明显比其他四个品种高。HSP16则对热激处理反应比较弱,除济麦22和烟农19在热激处理20小时表达水平升高较多外,其余品种的表达水平都较低。说明HSP90、HSP70和HSP16都受热激诱导表达,但HSP90和HSP70可能在热胁迫中起着更重要的作用。
热激转录因子(HSFs)具有调控热激蛋白的表达作用,在植物热激反应中发挥重要作用。图5、6、7、8所示,HSF5、HSF6、HSF10在8个小麦品种受热胁迫后表达水平都增高,也基本表现出先升后降的趋势。其中烟农19,良星99,济麦22和新麦26的表达水平相对比其他四个品种高,三个基因在中优206中的表达水平都比较低。说明HSF5、HSF6、HSF10均受到热胁迫的诱导表达,尤其以HSF5的表达最为明显。
4 实验结论
随着全球气候变暖的日益加剧和人口的增长,粮食安全始终是一个值得人们关注的重要问题,科研工作者和育种家们一直致力于提高农作物的产量和品质以满足人们日益增长的需要。小麦的耐热性机理研究和耐热品种选育就是近年来的一个热点。不同小麦品种因遗传背景不同,其耐热机理也具有明显差异。
本研究选用了8个在黄淮麦区大面积推广的小麦品种作为研究对象,分析了它们苗期的耐热机理,从热胁迫后的质膜透性、存活率,以及热激相关基因的表达分析发现,中麦175、烟农19、良星99和石优17的质膜的热稳定性比较好,热胁迫后存活率比较高,热激相关基因的表达水平也比较高,表现相对耐热。但苗期耐热性较差的济麦22和新麦26的热激相关基因如HSP90,HSP70等的表达水平比较高,可能其遗传背景的差异导致的,其机理需要进一步的深入研究。
参考文献
[1] 董建力,李树华,王敬东,等.热胁迫下春小麦品种产量性状耐热性差异及相关分析[J].西北农業学报,2008,17(2):70-73.
[2] 耿晓丽,张月伶,臧新山,等.北方冬麦区与黄淮北片优良小麦品种(系)耐热性评价[J].麦类作物学报,2016,36(2):172-181.
[3] 郭秀林,李慧聪,刘子会,等.不同基因型小麦对热处理的响应[J].麦类作物学报,2013,33(3):514-519.

