含微乳头成分的乳腺浸润性黏液癌的分析
陈舒婕, 陈小松, 籍 敏, 邵玉国, 沈坤炜, 何 奇
(1.上海交通大学医学院附属国际和平妇幼保健院乳腺科,上海 200030;2.上海交通大学医学院附属瑞金医院外科 乳腺疾病诊治中心,上海 200025)
乳腺黏液癌(mucinous carcinoma,MC)和浸润性微乳头状癌 (invasive micropapillary carcinoma,IMpC)均是特殊类型乳腺癌。MC好发于老年人,通常肿瘤生长缓慢,转移较少见,预后比其他类型乳腺癌好[1-2]。IMpC是一类罕见的乳腺癌。WHO乳腺肿瘤分类将其定义为:在类似脉管的间质腔隙中肿瘤细胞呈小簇状排列的浸润性癌,通常淋巴结转移多见,较易复发,预后较差[3-4]。因此,IMpC与MC的生物学行为截然相反[5]。有时这两种不同类型的乳腺癌会同时存在。2002年,Ng[6]报道21例MC的研究,其中5例为含微乳头成分的浸润性黏液癌(invasive micropapillary mucinous carcinoma,IMpMC),并首次将其作为一种新的黏液癌亚型提出。目前,只有少数研究报道IMpMC[7-9]。由于其较罕见,故样本量均较小。因此,IMpMC的预后情况尚不明确。本研究探讨纯黏液癌 (pure mucinous carcinoma,PMC)与IMpMC这两种类型乳腺癌的临床病理特征以及预后的差异,从而阐述微乳头成分在MC预后中的意义。
资料与方法
一、病人资料
收集2009年1月至2017年12月于上海交通大学医学院附属瑞金医院外科乳腺疾病诊治中心和2008年9月至2016年12月于上海交通大学医学院附属国际和平妇幼保健院乳腺科接受手术、病理诊断为单侧PMC与IMpMC病人的临床病理资料。其中,上海交通大学医学院附属瑞金医院外科乳腺疾病诊治中心的数据来源于上海交通大学乳腺癌数据库 (Shanghai Jiao Tong University Breast Cancer Database,SJTU-BCDB)。病人有完整的临床资料包括病理及免疫组织化学检查结果,以及随访资料,不伴有其他部位恶性肿瘤;免疫组织化学和FISH检测结果采用当时的结果,HER2检测2+且未做FISH检测的病人则排除在外。PMC定义为肿瘤含有≥90%黏液成分。微乳头成分定义为肿瘤细胞簇呈桑葚样或腺管、腺泡样,周围环绕组织空隙,呈现出“极性翻转”现象,即细胞簇的腔面向外[10]。IMpMC定义为微乳头成分占肿瘤细胞50%以上的MC。病人入选流程见图1。
收集入组病人的发病年龄、月经状态、肿瘤直径、淋巴结状态、脉管浸润情况、免疫组织化学检查结果、分子分型、治疗以及复发转移或死亡等信息。参照第8版AJCC乳腺癌分期系统进行解剖学分期[11]。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和HER2免疫组织化学阳性标准如下:①ER、PR阳性为≥1%细胞的细胞核强染色;②HER2阳性为免疫组织化学检查示HER2 3+或FISH (+),如免疫组织化学检查为HER2 2+,进一步作FISH检测。根据2013年St Gallen乳腺癌专家共识[12],PR和Ki67低表达分别为PR<20%和Ki67<14%。Luminal A型为ER阳性、PR高表达、HER2阴性且Ki67低表达。Luminal B型为ER阳性且HER2阴性、PR低表达或Ki67高表达,或ER阳性且HER2阳性、PR和Ki67任何状态。HER2阳性型为ER和PR均阴性、HER2阳性。三阴型为ER、PR及HER2均阴性。

图1 239例病人入选的流程图
统计无病生存(disease free survival,DFS)和总生存 (overall survival,OS),随访截止时间为2018年12月31日。
二、统计学方法
采用SPSS 23.0软件进行统计分析。临床病理特征与治疗方案单因素分析采用χ2检验,多因素分析采用Logistic回归分析,结果用优势比(odds ratio,OR)以及 95%可信区间(confidence interval,CI)表示。DFS及OS的生存曲线采用Kaplan-Meier法绘制,组间生存曲线比较采用Log-Rank检验。DFS相关的单因素分析采用Kaplan-Meier法及Log-Rank检验,多因素分析采用COX比例风险模型,结果用风险比(hazard ratio,HR)以及95%CI表示。所有统计学检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
一、临床病理特征
共239例女性乳腺癌病人纳入研究,平均年龄(59.8±14.8)(25~92) 岁。 IMpMC 和 PMC 分别为27例(11.3%)和 212例(88.7%)。141例(59.0%)肿瘤直径≤2.0 cm,215例(90.0%)淋巴结阴性。Ⅰ期和Ⅱ~Ⅲ期分别为134例(56.1%)和 105例(43.9%)。ER阳性和PR阳性分别为225例(94.1%)和203例(84.9%),16 例(6.7%)HER2 阳性,162 例(67.8%)Ki67低表达。入组病人包括Luminal A型、Luminal B型、HER2阳性型和三阴型,分别为117例(49.0%)、111 例(46.4%)、5 例(2.1%)和 6 例(2.5%)(见表 1)。
单因素分析显示,IMpMC与PMC病人在淋巴结、脉管浸润、ER、PR、HER2状态以及Ki67表达和分子分型方面差异具有统计学意义。IMpMC病人较PMC具有较高的淋巴结阳性率(44.4%比5.7%,P<0.001)和脉管浸润比例 (33.3%比 1.9%,P<0.001)。IMpMC病人的HER2阳性率为29.6%,显著高于PMC的3.8%(P<0.001)。IMpMC病人Ki67高表达显著多于PMC病人 (63.0%比28.3%,P=0.001)。但IMpMC病人ER和PR阳性率低于PMC病人:ER阳性率分别为81.5%和95.8%(P=0.012);PR阳性率分别为66.7%和87.3%(P=0.009)。在分子分型方面,PMC和IMpMC差异具有统计学意义(P=0.008),其中50.5%PMC为 Luminal A型乳腺癌,高于 IMpMC的 37.1%;而 PMC的HER2阳性型病人只有2例(0.9%),低于IMpMC的11.1%(见表 1)。
对单因素分析有差异的指标进一步行多因素分析。由于分子分型包含ER、PR、HER2及Ki67的相关信息,故未将其纳入多因素分析。多因素分析显示淋巴结阳性率、脉管浸润和Ki67高表达在两组之间差异具有统计学意义。IMpMC病人较PMC,具有较高的淋巴结阳性率(OR=4.84,95%CI:1.37~17.13,P=0.014)、较多的脉管浸润(OR=13.38,95%CI:2.88~62.15,P=0.001) 以及较多的 Ki67 高表达(OR=4.07,95%CI:1.04~15.94,P=0.044)(见表 2)。

表1 IMpMC与PMC临床病理特征比较[n(%)]
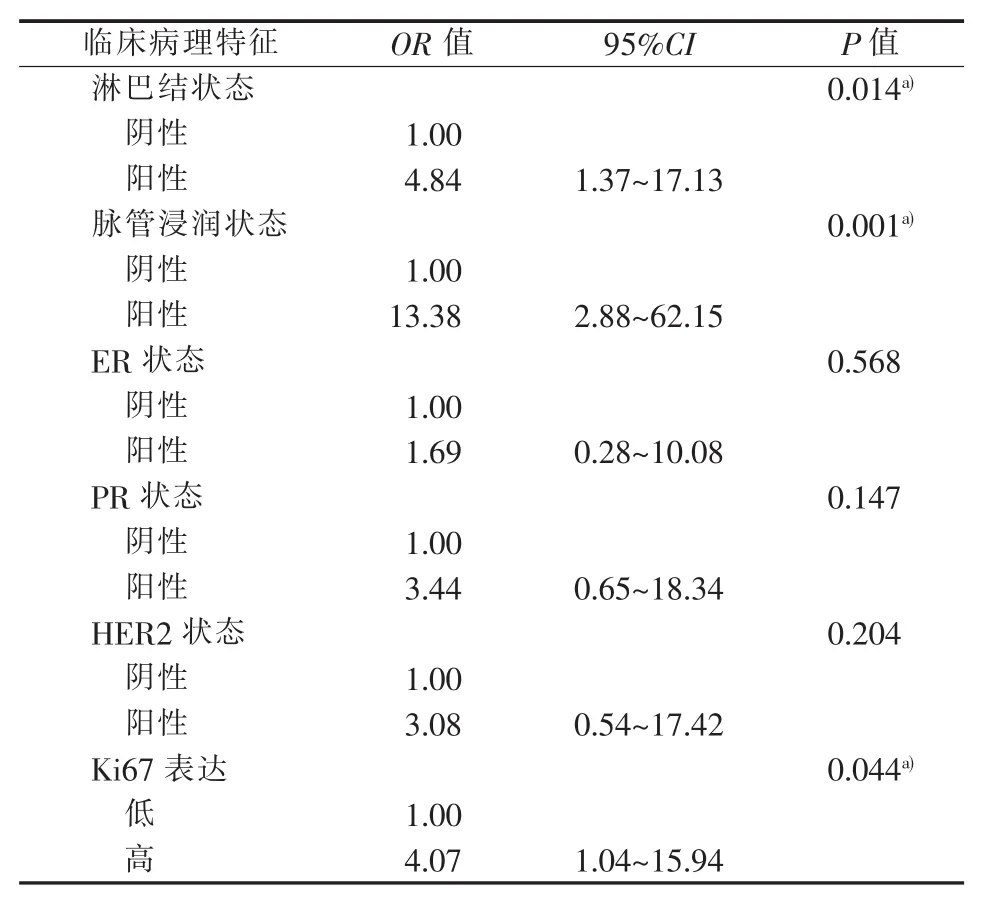
表2 IMpMC与PMC临床病理特征的多因素分析
二、治疗情况
在乳腺癌手术治疗方面,IMpMC病人行保乳手术的比例为11.1%,显著低于PMC病人的36.3%(P=0.009)。在辅助治疗方面,IMpMC病人接受辅助化疗、放疗和靶向治疗的比例分别为70.4%、55.6%和14.8%,显著高于PMC病人的13.7%(P<0.001)、33.5%(P=0.033)和 1.9%(P=0.007)。 PMC 病人接受内分泌治疗的比例为93.9%,显著高于IMpMC病人的 77.8%(P=0.011)(见表 3)。
进一步行多因素分析显示,IMpMC与PMC病人更多接受乳房切除术 (OR=10.00,95%CI:2.13~46.87,P=0.003)、辅助化疗(OR=7.11,95%CI:2.40~21.11,P<0.001)与放疗(OR=5.33,95%CI:1.63~17.39,P=0.006);但在接受靶向治疗及内分泌治疗方面,两组病人差异无统计学意义(P>0.050)(见表 3)。
三、生存分析
病人的中位随访时间为53(12~122)个月。IMpMC组病人DFS事件数为4例。其中局部复发1例、远处转移2例、第二原发肿瘤1例,5年DFS为79.2%。PMC组病人DFS事件数为10例。其中局部复发3例、远处转移4例、第二原发肿瘤3例,5年 DFS为 92.5%,P=0.011(见图 2A)。 两组共9例死亡,IMpMC组3例,PMC组6例,其中因乳腺癌死亡两组均为2例。5年OS分别为93.8%和98.6%,P=0.022(见图 2B)。
对全部239例乳腺癌病人行单因素生存分析显示,病理类型(P=0.011)、肿瘤直径(P=0.005)、淋巴结(P=0.033)以及病理分期(P=0.013)与病人DFS显著相关。由于病理分期包含肿瘤直径与淋巴结的相关信息,故未将其纳入多因素分析。多因素分析显示,病理类型(HR=10.39,95%CI:1.61~66.86,P=0.014)和肿瘤直径(HR=13.61,95%CI:1.45~127.80,P=0.024)是DFS的独立影响因素,IMpMC病人较PMC复发风险显著升高(见表4)。

表3 IMpMC与PMC治疗方案比较

图2 Kaplan-Meier法绘制按病理类型分层的生存曲线
讨 论
本研究共分析212例PMC和27例IMpMC病人的临床病理特征及预后情况。IMpMC较PMC病人有较高淋巴结阳性率、较多脉管浸润以及较多Ki67高表达,其预后较PMC差。多因素生存分析显示,病理类型和肿瘤直径是DFS的独立影响因素。
与乳腺浸润性导管癌相比,PMC具有良好的预后,区域淋巴结阳性率低,生存率高[2]。这种惰性行为与肿瘤低增殖活性,激素受体阳性和HER2低扩增有关[2,13]。本研究评估212例PMC病人的病理特征及预后情况,结果与既往文献报道一致。PMC病人有较好的生物学行为,即淋巴结阳性率低、脉管浸润少、激素受体阳性率高、HER2低扩增及Ki67低表达,且预后好。
临床病理特征方面,有限的文献报道显示,IMpMC淋巴结阳性率高于其他类型的MC[14-15]。Ranade等[14]45例乳腺MC的研究发现,淋巴结阳性的病例60%具有微乳头状结构,而淋巴结阴性的病例仅 14%具有该结构。Shet等[15]报道 68例IMpMC病人的淋巴结阳性率为33.8%。本研究发现IMpMC病人的淋巴结阳性率为44.4%,远高于PMC病人(5.7%),与既往文献报道相符。笔者还发现IMpMC病人在其他临床病理特征方面与PMC病人不同,IMpMC病人脉管浸润及Ki-67高表达较多,提示IMpMC的生物学行为具有较强的侵袭性。另外本研究发现,IMpMC与PMC病人的分子分型不同。PMC病人Luminal A型最多,IMpMC病人Luminal B型最多。IMpMC与PMC病人相比,HER2阳性型及三阴型较多。
预后方面,既往研究报道微乳头成分在MC中的预后意义尚不明确。Liu等[9]报道,IMpMC病人预后优于 IMpC,但比 PMC 病人差(P<0.05)。 IMpMC与PMC两组病人多因素生存分析显示,微乳头成分、肿瘤直径以及淋巴结状态是影响MC预后的独立因素。Kim 等[8]比较17例IMpMC、19例 PMC、15例IMpC与13例含有微乳头成分的浸润性导管癌病人的预后,结果提示差异无统计学意义。多因素生存分析显示,IMpMC中的微乳头成分并未增加肿瘤的侵袭性,仅肿瘤直径是OS的独立影响因素。本研究补充了既往这些研究的结果。发现IMpMC病人的5年DFS和OS均比PMC病人差,可能与IMpMC病人较差的生物学行为,即较高的淋巴结阳性率、较多脉管浸润以及较多的Ki67高表达密切相关。且多因素生存分析也证实,病理类型即肿瘤细胞是否含有微乳头成分明显增加肿瘤复发的风险,是DFS的独立影响因素。
对于IMpMC与PMC病人临床病理特征及预后不同的原因,有研究认为,在病理形态学方面,IMpMC肿瘤细胞的排列模式与IMpC相似,癌细胞呈现 “细胞极性倒置”及“内面朝外”的生长模式。IMpMC与PMC形态学上本质的区别在于癌巢周围是否被黏液占据[5,15]。Shet等[15]发现,多数含微乳头成分的MC病灶在转移至淋巴结后,肿瘤组织的黏液量显著减少,有些病例甚至丢失全部的黏液成分而在转移灶中变为IMpC。IMpMC术后出现局部复发时,有时也会完全失去黏液成分而以IMpC的形态出现。因此该研究认为,与微乳头成分相比,丰富的黏蛋白可能是更重要的预后因素。刘芳芳等[16]也认为,IMpMC这种黏蛋白的丧失以及向IMpC的转变可能是其晚期复发、转移和生存率下降的主要原因。IMpMC与IMpC可能处于同一肿瘤谱系,其区别在于所含黏液量的多少。这说明MC中的微乳头模式可能与IMpC的组织遗传学相关。但目前对于IMpMC的研究仅限于群体分析,缺乏分子机制方面的报道。因此,两者在分子及遗传学水平的区别和联系尚待进一步的基础研究。

表4 单因素与多因素分析临床病理特征与DFS的关系
治疗方面,2018年乳腺癌NCCN指南建议,对于组织学类型良好的MC病人,如ER和(或)PR阳性、pT1~3、腋窝淋巴结阴性或微转移,则不需辅助化疗[17]。但越来越多的研究显示,MC有一定异质性。临床上对其中生物学行为较差的MC亚型应采取更积极的治疗方式。本研究IMpMC与PMC病人相比,较多接受化疗,这与IMpMC病人有较高的淋巴结阳性率以及较少激素受体表达有关。PMC病人保乳手术率高于IMpMC病人,较少接受放疗,这与IMpMC病人有较高的淋巴结阳性率有关。笔者发现IMpMC较PMC病人生物学行为差,且微乳头成分是影响PMC病人DFS的独立因素,因此临床对于IMpMC病人治疗上应区别于一般的MC,给予更积极的治疗。但在积极治疗的同时如何避免 “过度治疗”,这就要求区分复发风险较高的IMpMC病人。有研究报道21基因复发风险评分与MC临床病理的关系,并提出目前已有的临床病理指标可能不足以完全覆盖所有MC病人的疾病评估。21基因复发风险评分在整合已有临床病理指标基础上,可提供额外的疾病评估信息[18]。笔者也期待21基因复发风险评分等方法在IMpMC治疗方案选择中的应用。
本研究存在不足之处。由于IMpMC较罕见,研究纳入的样本量较小,因此需要继续病例研究以及更长时间的随访,来验证微乳头成分在MC中的预后意义。
本研究发现,MC中的微乳头成分增加肿瘤的侵袭性,IMpMC较PMC病人有较高的淋巴结阳性率、较多的脉管浸润以及较多的Ki-67高表达,其预后较PMC差。

