基于Mn(Ⅱ)络合环丙沙星的电化学检测
欧阳文鹏,郭佩佩,黄家怿,2
(1.广州市健坤网络科技发展有限公司,广东 广州 510630;2.广东省现代农业装备研究所,广东 广州 510630)
0 引言
环丙沙星作为第三代氟喹诺酮类抗生素,对肠杆菌科细菌具有极强的抗菌活性,因而被广泛应用于临床、兽药、农业等方面,但大量不科学的使用导致环丙沙星在动物性食品中残留,造成人体的危害也越来越严重,从而引起人们的广泛关注[1,2]。因此,建立灵敏、可靠、简便的环丙沙星测定方法具有重大实际意义。目前已报道测定环丙沙星的方法主要有紫外分光光度法[3]、色谱法[4]、化学发光法[5]、电化学分析法等方法。其中电化学方法操作简单、仪器成本低,且具有较高的灵敏度和选择性。电化学方法不仅可用于无机重金属离子的痕量检测,如郭佩佩等利用差分脉冲溶出伏安法研究痕量Hg2+在传感器上的响应行为[6],吴文展等采用微分脉冲溶出伏安法检测痕量的铅和镉[7],而且还在有机物的检测中广泛应用。环丙沙星具有电活性基团,可使用电化学方法进行检测。电化学方法有多种,常见测定环丙沙星以电流-电位曲线的极谱法和伏安法为主。袁英贤等[8]研究单扫描极谱法测定环丙沙星成品药含量,还原峰电流与环丙沙星质量浓度在3.3~15.0μg/mL范围内成正比。Kasarla Ramakrushna Reddy等[9]采用方波伏安法在纳米金/壳聚糖复合物薄膜构建的丝网印刷电极上测定环丙沙星的含量,在0.1~150.0μmol/L范围内呈现很好的线性相关性。
本研究以Mn(Ⅱ)为增敏剂,以氧化石墨烯为修饰电极,采用差分脉冲溶出伏安法(DPSV)作为检测手段,构建了一种较为简便可靠的测定环丙沙星的新方法。该法避免了多种复合物修饰玻碳电极的复杂制备过程,同时选用对环丙沙星具有较强络合作用的微量Mn(Ⅱ),增大了环丙沙星的检测信号。
1 试验内容
1.1 仪器与试剂
仪器:CHI760E电化学工作站(上海辰华仪器公司),超声清洗器,采用三电极系统,玻碳电极及修饰电极作为工作电极,Ag/AgCl作为参比电极,铂片电极作为辅助电极。
试剂:氧化石墨烯(GO);纳米三氧化二铁(nano-Fe2O3,30 nm,上海阿拉丁生化科技股份有限公司);纳米氧化锡(nano-SnO2,30 nm,上海阿拉丁生化科技股份有限公司);盐酸(HCl)、氯化钾(KCl)、甘氨酸(glycine)、冰醋酸(HAc)、磷酸(H3PO4)、硼酸(H3BO3)、氢氧化钠(NaOH)、浓氨水(NH3·H2O)、氯化铵(NH4Cl,广州试剂厂);环丙沙星(上海阿拉丁生化科技股份有限公司);试验中所用试剂均为分析纯;试验用水为三次去离子水。
环丙沙星标液的配制:取一定量的环丙沙星粉末于50 mL容量瓶中,加入少量稀盐酸,加水定容,配成浓度1×10-2mol/L 标液。
Mn(Ⅱ)的配制:取一定量的MnSO4固体粉末于50 mL容量瓶中,加水定容,配置成1×10-2mol/L标液。
不同pH的B-R缓冲液的配制:取一定量的磷酸、冰醋酸和硼酸混合加水定容配成浓度均为0.05 mol/L的溶液,再加入NaOH调节至所需pH值。
1.2 修饰电极的制备
1.2.1 玻碳电极的预处理
玻碳电极(GCE)依次在0.30,0.05μm三氧化二铝悬浊液中抛光成镜面,依次在1︰1乙醇、1︰4硝酸和超纯水中超声清洗3次,然后在空气中自然晾干。
1.2.2 修饰电极的制备
GO-nafion/GCE:将GO与nafion混合,用异丙醇配制成0.5 mg/mL GO-0.01% nafion的悬浊液,超声分散30 min,形成稳定的分散液。用微量进样器取适量的分散液,均匀滴涂于处理好的玻碳电极表面,干燥箱晾干,即得到GO-nafion/GCE。
Fe2O3-GO-nafion/GCE:将nano-Fe2O3、GO与nafion混合,用异丙醇配制成1.0 mg/mL nano-Fe2O3-0.5 mg/mL GO-0.01% nafion的悬浊液,制备Fe2O3-GO-nafion/GCE。
SnO2-GO-nafion/GCE:将 nano-SnO2、GO 与nafion混合,用异丙醇配制成1.0 mg/mL nano-SnO2-0.5 mg/mL GO-0.01% nafion的悬浊液,制备SnO2-GO-nafion/GCE。
MWCNT-nafion/GCE:将羧基化碳纳米管(MWCNT)与nafion混合,用异丙醇配制成1.0 mg/mL MWCNT-0.01% nafion的悬浊液,制备MWCNT-nafion/GCE。
1.3 试验方法
试验采用传统的三电极体系,以玻碳电极及其修饰电极为工作电极,Ag/AgCl电极作为参比电极,铂片电极作为辅助电极,在0.05 mol/L B-R缓冲电解液(pH=8.0)中进行电化学检测。DPSV扫描电位范围为-1.0~+1.0V,在电位-0.8 V的富集下,通过响应电流与浓度的关系曲线确定线性范围和检出限。
2 结果与讨论
2.1 修饰电极的选择
采用玻碳电极进行电化学检测时,对电极进行适当修饰可达到提高待测物电化学响应的目的。图1为在含有20μmol/L Mn(Ⅱ)和3μmol/L CIP的B-R缓冲溶液(pH=8.0)中多种修饰电极对CIP的电化学响应曲线。可看出,MWCNT- nafion/GCE、bare GCE对应的差分脉冲溶出伏安曲线中+0.2 V左右只出现Mn(Ⅱ)溶出峰,在+0.4 V左右未出现CIP与Mn(Ⅱ)的络合峰;而在相同条件下,GO-nafion/GCE和 SnO2- GO-nafion/GCE、Fe2O3-GO-nafion/GCE对应的溶出伏安曲线在+0.4 V左右均出现CIP与Mn(Ⅱ)的络合峰,而未在+0.2 V左右出现Mn2+的溶出峰,可知随着络合反应的进行,Mn(Ⅱ)峰减弱,络合峰增强,但SnO2-GO-nafion/GCE、Fe2O3-GO-nafion/GCE和 GO-nafion/GCE只对络合峰响应,且GO-nafion/GCE所响应的电化学信号更显著,而Fe2O3-GO-nafion/GCE响应的很弱或无响应,其原因可能是氧化物的存在阻碍了活性物的吸附。因此,选择GO-nafion/GCE为最佳修饰电极。

图1 CIP在多种修饰电极上的差分脉冲溶出伏安曲线Fig.1 Differential pulse stripping voltammetry curves of CIP on a variety of modified electrodes
2.2 Mn(Ⅱ)浓度的影响
Mn(Ⅱ)作为一种检测CIP的络合增敏剂,可加强CIP的峰电流检测信号。试验中分别考察了GO-nafion/GCE在pH=8.0的NH4Cl-NH3缓冲液中不同数量级的Mn(Ⅱ)浓度(20、100、200、1 000、2 000μmol/L)对检测同一浓度 CIP(5μmol/L)下络合峰电流的影响,如图2所示。发现当无Mn(Ⅱ)加入时,CIP无响应;随着Mn(Ⅱ)浓度的增大,+0.18 V左右出现的Mn(Ⅱ)尖峰电流增大,络合峰反而减弱;当Mn(Ⅱ)浓度达到1 000μmol/L时,在溶液中出现大量的红棕色悬浮物,干扰CIP的检测。因此,选择20μmol/L作为检测CIP的最佳Mn(Ⅱ)浓度。

图2 不同浓度Mn2+对CIP络合峰信号的影响Fig.2 Effect of Mn2+ concentration on CIP complex peak signal
2.3 支持电解液的选择
支持电解液的选择是影响CIP络合峰大小的一个重要因素。试验中采用GO-nafion/GCE为修饰电极和20μmol/L Mn(Ⅱ)为增敏剂,分别在pH均为8.0的0.05 mol/L 甘氨酸(glycine)-NaOH、0.05 mol/L KCl、B-R缓冲溶液、NH4Cl-NH3支持电解液中研究CIP络合峰的情况。由图3可见,在glycine -NaOH和KCl中,在+0.4 V左右无明显电化学响应;而在NH4Cl-NH3缓冲液中,+0.4 V左右出现的络合峰虽然电流最大,但峰型较差、多组峰出现且背景电流较大,同时在测试过程中散发浓烈的刺激性气味,污染空气。因此综合考虑,选择B-R缓冲溶液作为最佳支持电解液。
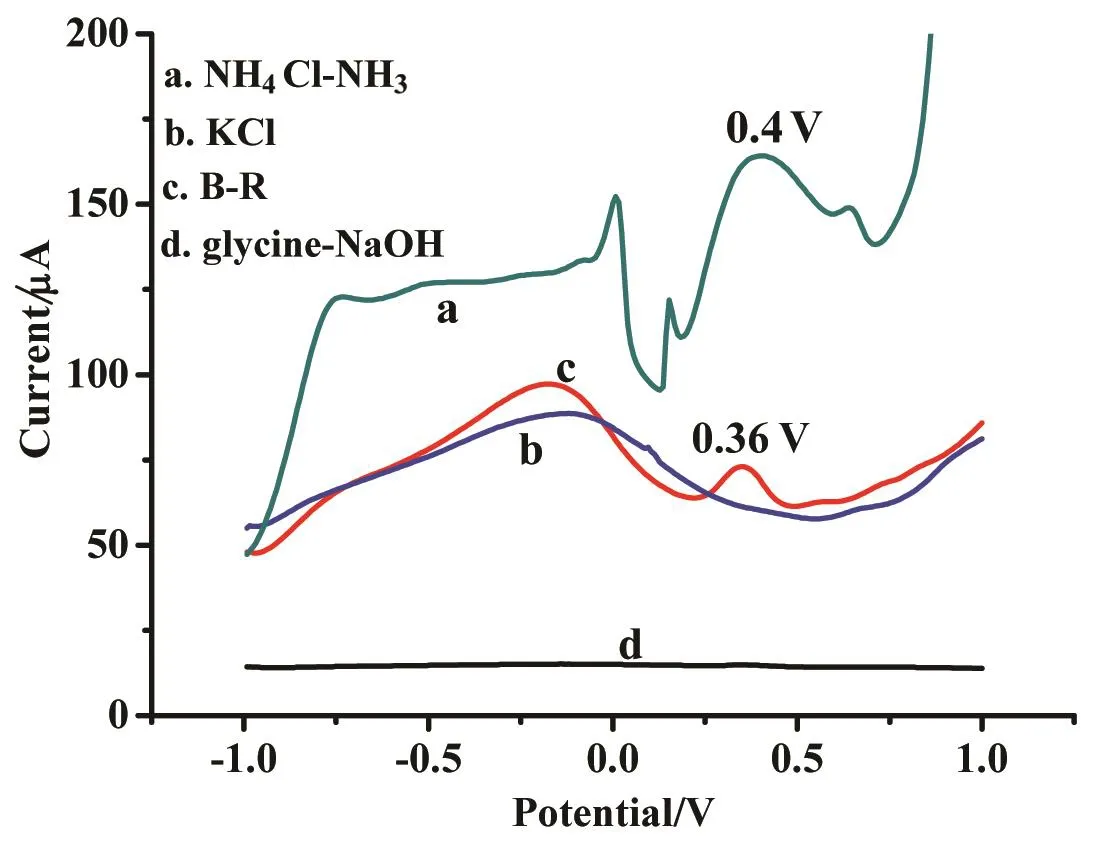
图3 不同支持电解液对CIP络合峰信号的影响Fig.3 Influence of different supporting electrolytes on CIP complex peak signal
2.4 不同pH值的选择
由于B-R缓冲溶液具有较宽的缓冲范围,所以试验中采用GO-nafion/GCE为修饰电极和20μmol/L Mn(Ⅱ)为增敏剂,研究在不同pH的B-R缓冲液中对3μmol/L CIP络合峰电流的影响,如图4—5所示。结果表明,随着溶液pH的增大,络合峰电流先增大后减小,在pH=8.0时达到最大,且随着pH减小,峰电位正移,说明H+参与了CIP的质子化氧化过程,这与之前报道[10]相一致。因此,选择pH=8.0作为最佳pH值。

图4 CIP在不同pH条件下的溶出伏安曲线Fig.4 Stripping voltammetry curves of CIP complex under different pH values

图5 不同pH值对CIP络合峰信号的影响Fig.5 Effect of different pH values on CIP complex peak signal
2.5 不同富集电位的影响
富集电位选择对溶出峰电流具有重要影响。试验考察了不同富集电位(-1.2、-1.0、-0.8、-0.6、-0.4、-0.2 V)对CIP络合峰信号的影响,如图6—7所示。发现富集电位从-1.2~-0.8 V,络合峰电流逐渐增大,且背景电流较小,峰型较好,但随后富集电位越正,峰电流反而减小。因此,选择-0.8 V为最佳富集电位。

图6 CIP在不同富集电位下的溶出伏安曲线Fig.6 Stripping voltammetry curves of CIP complex un der different enrichment potentials

图7 不同富集电位对CIP络合峰信号的影响Fig.7 Effect of different enrichment potentials on CIP complex peak signal
2.6 线性范围、检测限和重现性
在最佳试验条件下,采用标准曲线法建立络合峰电流和CIP浓度之间的定量分析标准。络合峰的峰电流I(μA)与溶液中CIP的浓度(CCIP)在5.0×10-7~2.0×10-5mol/L分段成良好的线性关系。在5.0×10-7~1.4×10-5mol/L范围内,回归方程为I(μA)=4.18CCIP-4.177,线性相关系数为R2=0.977 8。在1.4×10-5~2.0×10-5mol/L范围内,回归方程为I(μA)=1.75CCIP+30.83,线性相关系数为R2=0.995 2,其检出限为5×10-7mol/L,如图8—9。由表1对比多种不同修饰电极检测CIP的检出限结果可知,相比于其他方法,本研究只使用简单修饰的电极便可达到更低的检出限,节约成本和时间[11-13]。

图8 最佳条件下不同浓度CIP络合物溶出伏安图Fig.8 Stripping voltammetry curves of CIP complexes with different concentrations under optimal conditions

图9 最佳条件下不同浓度CIP络合物标准工作曲线图Fig.9 Standard operating curves of CIP complexes with different concentrations under optimal conditions

表1 几种不同修饰电极检测CIP的检出限的比较Tab.1 Comparison of detection limits of CIP with different modified electrodes
3 结论
本文制备的基于氧化石墨烯修饰玻碳电极的电化学传感器,对CIP与Mn(Ⅱ)络合物的溶出伏安行为有着良好的增强作用,且Mn(Ⅱ)的存在有利于CIP的检测。试验结果表明,络合峰的峰电流与溶液中CIP的含量在5×10-7~2×10-5mol/L分段成线性关系,线性相关系数分别为R2=0.977 8 和R2=0.995 2,检出限为5×10-7mol/L。该传感器具有检测结果准确、重现性较好、对环境无污染等优点,有望在基体复杂的实际样品中广泛应用。

