HC-1119对三阴性乳腺癌BT549细胞生物学行为的影响*
黄 钱, 任秋宇, 张春燕, 何 涛, 甘 淋△
(西南医科大学基础医学院 1生物化学与分子生物学教研室, 2肿瘤医学研究所, 四川 泸州 646000)
三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达均为阴性的乳腺癌[1]。研究显示TNBC约占所有新诊断乳腺癌总量的15%~20%,约占每年乳腺癌死亡总数的5%[2]。TNBC具有恶性程度高、侵袭能力强和复发率高的特点,与其它类型的乳腺癌相比,其5年生存率及总生存率更低。故目前TNBC患者均接受标准的多药辅助化疗,但治疗效果不佳,约30%~40%的早期TNBC患者会发生转移,生存周期短[3]。鉴于目前在雌激素受体阳性的乳腺癌中进行靶向治疗已取得巨大临床成功[ 4 ],有研究提出针对雄激素受体(androgen receptor,AR)阳性的TNBC,将 AR作为其分子靶点进行靶向治疗具有一定的可行性[5]。
AR是核受体家族的一员,属于配体激活的转录因子,易被睾酮及其代谢物二氢睾酮(dihydrotestosterone,DHT)等雄激素所激活。研究发现在高达70%~90%的乳腺癌中均可检测到AR的表达,这使得乳腺癌中AR成为比ER和PR更广泛的受体[6],是潜在的治疗靶点,为缺乏ER、PR和HER2表达的TNBC的治疗提供了新的方向和思路。尽管越来越多的证据支持雄激素和AR在乳腺癌诊断治疗中发挥一定作用,但其具体机制仍不太清楚,尤其是AR在TNBC中的作用有待深入研究[7-9]。
根据AR 拮抗剂的化学结构,可将其分为甾体类AR拮抗剂和非甾体类AR 拮抗剂。甾体类AR拮抗剂的代表药物有醋酸环丙孕酮,非甾体类雄激素受体拮抗剂种类较多,如氟他胺和比卡鲁胺等[10]。HC-1119是一种全新的人工合成的非甾体类AR拮抗剂,前期的细胞和动物实验均发现HC-1119能明显抑制雄激素受体信号。目前,此化合物已经被中国食品药监局批准作为前列腺治疗药物进入一期临床实验,可望成为前列腺癌的治疗药物。
材 料 和 方 法
1 材料
人乳腺癌细胞株MCF-7、MDA-MB-231、SKBR3、BT549和T47D由西南医科大学基础医学院肿瘤研究所惠赠。CCK-8购自日本同仁公司; 细胞凋亡检测试剂盒、细胞周期检测试剂盒和Matrigel均购自BD;DMEM和RPMI-1640培养基购自Gibco;抗体稀释液购自北京碧云天公司;抗E-cadherin、vimentin、GAPDH抗体购自Abcam; 抗AR和P21抗体购自CST。
2 方法
2.1细胞系、细胞培养及细胞分组 将BT549细胞培养在RPMI-1640培养基中,将MDA-MB-231、T47D、MCF-7和SKBR3细胞培养在DMEM高糖培养基中,并添加10% FBS、1×105U/L青霉素和100 mg/L链霉素。将细胞在37 ℃、5% CO2的加湿细胞培养箱中培养过夜,根据细胞生长状态更换培养基,所有纳入研究的细胞都处于生长对数期。以适宜浓度的HC-1119刺激细胞为实验组(HC-1119组),相应体积DMSO溶剂刺激细胞为对照(control)组。
2.2Western blot检测AR、E-cadherin、vimentin、P21和GAPDH的蛋白表达 取对数生长期的细胞,待细胞生长密度达到90%时,消化裂解细胞,抽提蛋白质。BCA法测定蛋白含量,按35 μg蛋白含量上样, 10% SDS-PAGE分离蛋白质,转膜至0.45 μm聚偏二氟乙烯膜上, 5%脱脂牛奶室温封闭1 h。分别加入抗AR(1∶2 000)、E-cadherin(1∶2 000)、vimentin(1∶2 000)、P21(1∶1 000)和GAPDH(1∶5 000)抗体在4℃下孵育过夜。TBST洗涤3次后,相应 II 抗(1∶5 000)孵育1 h,洗膜3次后上机扫膜。Image Studio软件扫描条带,用Image-Pro Plus软件进行灰度值测定,将目的蛋白灰度值与内参照GAPDH灰度值的相对比值来反映目的蛋白的表达量。
2.3CCK-8法检测细胞活力 取对数生长期的BT549细胞消化后制备单细胞悬液,按每孔5 000个细胞接种于96孔板内,24 h细胞充分贴壁后,用不同浓度(0、10、20、40、80、100和160 μmol/L)的HC-1119刺激细胞24 h,向每个孔中加入10 μL CCK-8溶液,37 ℃温育1.5 h,酶标仪测定450 nm处的吸光度(A)值。计算细胞活力抑制率(%)=(1-实验孔平均A值-调零孔平均A值)/(空白对照孔平均A值-调零孔平均A值)×100%。
2.4流式细胞术检测细胞凋亡 取对数生长期的BT549细胞制备单细胞悬液,按每孔5×105个细胞接种于6孔板中,培养24 h后分为control组和HC-1119组,给药,每组3个复孔,药物刺激24 h后,用不含EDTA的胰酶消化收集细胞,1 200 r/min离心3 min弃上清,用预冷PBS重悬后1 200 r/min离心3 min弃上清,加300 μL 1×binding buffer重悬细胞,加入5 μL annexin V-FITC混匀,避光室温孵育15 min,上机前5 min加5 μL PI,流式细胞术检测。
2.5流式细胞术检测细胞周期分布 取对数生长期的BT549细胞制备单细胞悬液, 按每孔5×105个细胞接种于6孔板,培养24 h后分组给药和收集细胞同2.4。细胞加入4 ℃ 70%乙醇,-20 ℃固定24 h。PBS洗涤细胞2次。每管加入PI试剂液0.5 mL重悬细胞,37 ℃避光孵育30 min,流式细胞术进行细胞周期分析。
2.6Transwell实验 用无血清培养基稀释Matrigel至1 g/L备用。行侵袭实验时,在Transwell上室内加入100 μL稀释的Matrigel溶液,放入细胞培养箱温育4 h。待基质胶凝固后,下室加入600 μL含20% FBS的培养基,Transwell上室按每孔2×104个细胞进行接种。分组(control组和HC-1119组)给药,每组3个复孔,细胞培养36 h后,用棉签尽量擦去Transwell小室上室细胞,75%甲醇固定30 min,PBS清洗2遍,然后用0.1%结晶紫染色10 min,PBS清洗2遍,镜下拍照记录。行迁移实验时,除不采用Matrigel进行铺板,余下步骤同侵袭实验。
3 统计学处理
统计学分析软件为SPSS 20.0。数据以均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间均数比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
结 果
1 AR在不同乳腺癌细胞株中的表达
Western blot结果显示,AR在MDA-MB-231和SKBR3细胞中基本不表达,在MCF-7细胞中低表达,在人乳腺导管癌T47D细胞和BT549细胞中表达水平较高,见图1。因T47D细胞还表达PR,MCF-7细胞还表达ER,故后续的实验我们选择AR高表达的TNBC细胞株BT549作为研究对象。
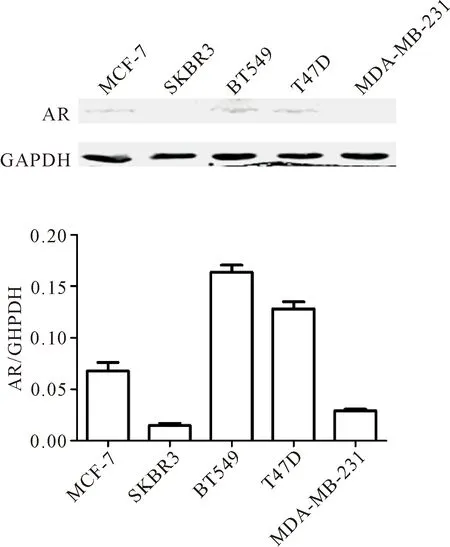
Figure 1.AR expression in different breast cancer cell lines. Mean±SD. n=3.
2 AR人工合成拮抗剂HC-1119降低BT549细胞的活力
用CCK-8法检测不同浓度(0、10、20、40、80和160 μmol/L) HC-1119作用BT549细胞24 h对细胞活力的影响,发现HC-1119呈浓度依赖性抑制BT549细胞的活力(P<0.05),计算得出HC-1119的IC50=90.1 μmol/L,故选择100 μmol/L进行下一步实验,见图2A。我们进一步检测100 μmol/L的HC-1119在24 h、48 h和72 h对BT549细胞活力的影响,结果发现HC-1119呈时间依赖性抑制BT549细胞的活力(P<0.05),见图2B。

Figure 2.The effect of HC-1119 on the viability of BT549 cells. A: the exposure to HC-1119 at different concentrations (0, 10, 20, 40, 80 and 160 μmol/L); B: the exposure to HC-1119 at 100 μmol/L for different time (24 h, 48 h and 72 h). Mean±SD. n=3. *P<0.05, **P<0.01 vs control group.
3 HC-1119对BT549细胞凋亡和细胞周期分布的影响
流式细胞术及annexin V/PI双染法结果显示,与control组相比,100 μmol/L的HC-1119能够明显促进BT549细胞早期凋亡(P<0.01),见图3。

Figure 3.HC-1119 inhibits BT549 cell apoptosis. Mean±SD. n=3. **P<0.01 vs control group.
流式细胞术结果显示,control组S期细胞的百分比为(15.86±1.86)%,HC-1119刺激BT549细胞24 h后S期的百分比显著增高[(44.2±3.7)%,P<0.01],提示HC-1119能够明显阻滞BT549细胞于S期,见图4。
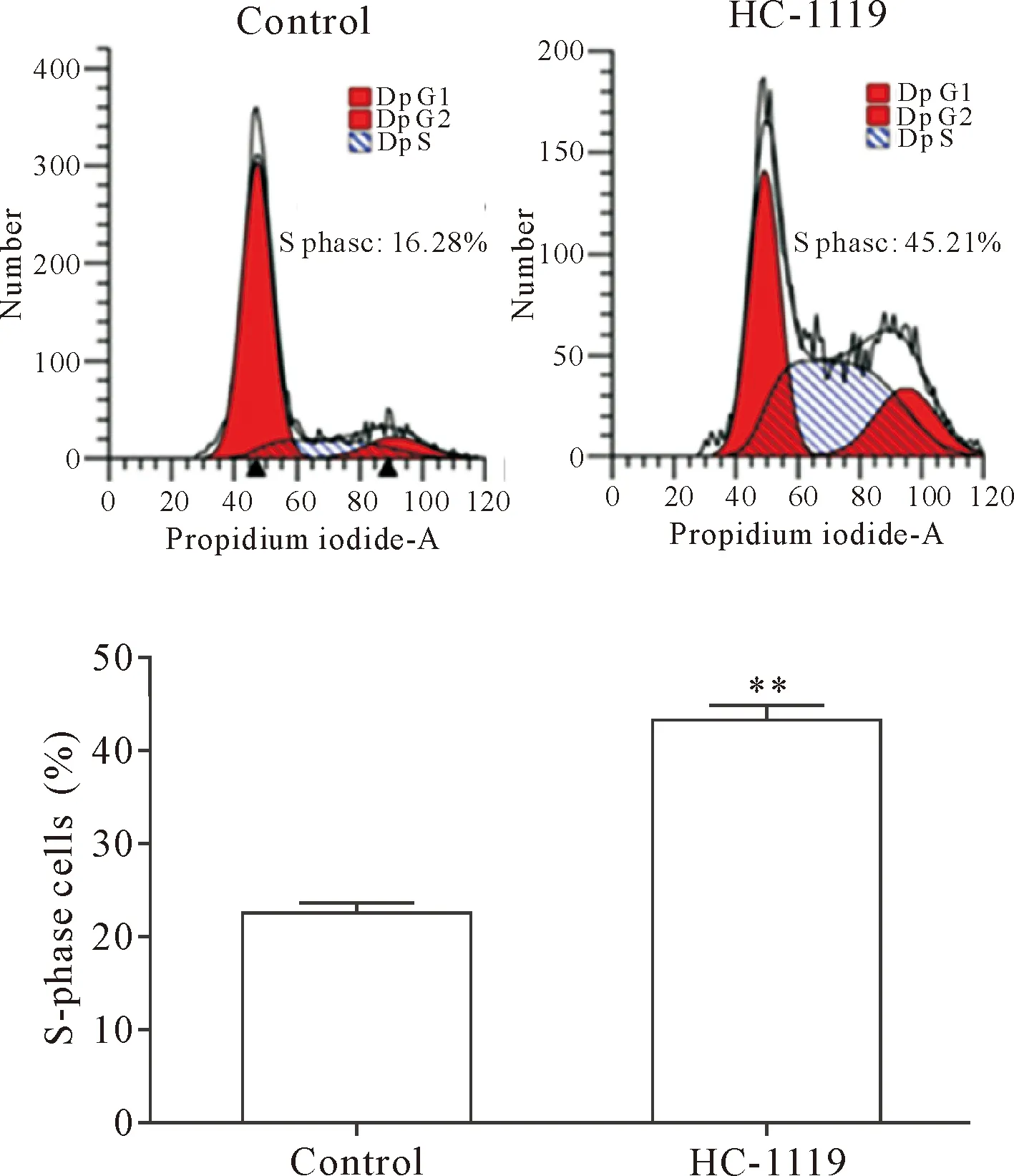
Figure 4.The effects of HC-1119 on BT549 cell cycle distribution. Mean±SD. n=3. ** P<0.01 vs control group.
4 HC-1119抑制BT549细胞的迁移和侵袭能力
采用Transwell体外实验比较100 μmol/L HC-1119对BT549细胞迁移和侵袭能力的影响,实验结果表明与control组相比,HC-1119能够明显抑制BT549细胞的迁移和侵袭(P<0.01),见图5。
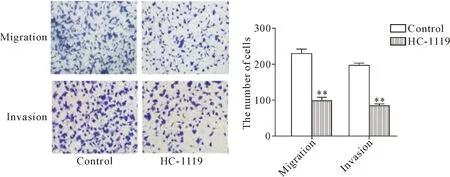
Figure 5.The effects of HC-1119 on the migration and invasion abilities of BT549 cells (×100). Mean±SD. n=3. ** P<0.01 vs control group.
5 Western blot 检测E-cadherin、vimentin和P21的表达
Western blot结果显示,与control组比较,HC-1119作用的BT549细胞中上皮标志分子E-cadherin和间充质标志分子vimentin表达水平的差异没有统计学显著性,提示HC-1119不经过上皮-间充质转化(epithelial-mesenchymal transition,EMT)参与细胞的迁移过程;与control组比较,HC-1119刺激组的P21表达水平明显降低(P<0.01),提示HC-1119通过P21参与三阴性乳腺癌细胞株BT549的细胞周期调控,见图6。
讨 论
AR是乳腺癌中表达最广泛的受体[ 6],这为AR阳性的TNBC的治疗提供了新的研究方向和思路,使AR成为一种潜在的乳腺癌治疗靶点。最新研究发现AR在AR+/ER-的乳腺癌中发挥重要的致癌作用,故AR拮抗剂能够抑制乳腺癌细胞存活和生长[11-13]。目前常用于去势抵抗性前列腺癌的新一代AR拮抗剂Enzalutamine能够减少TNBC细胞增殖并诱导细胞凋亡[14-15]。近来关于AR拮抗剂用于AR+乳腺癌治疗的报告越来越多,研究结果虽然提示AR拮抗剂可以通过促进细胞凋亡,影响细胞周期相关蛋白的表达来影响细胞生长,但其具体的分子机制仍不清楚[16]。本文选取新型人工合成AR拮抗剂HC-1119,检测其对TNBC细胞BT549功能的影响,并进一步探讨其分子机制。
有研究从细胞水平上证明了AR拮抗剂可以抑制AR+乳腺癌细胞的生长。Min等[17]通过使用新型AR拮抗剂AZD3514治疗乳腺癌时发现,AZD3514对常见乳腺癌细胞(包括MDA-MB-157、MDA-MB-231、BT-549、HCC70、HCC1143、Hs578T、MDA-MB-453、MDA-MB-468、BT-474、MCF7、T47D和 SKBR3)均具有较轻微的抗增殖作用,但是这种抗增殖与AR的表达水平无关,而是通过下调DNA损伤应答(DNA damage response,DDR)分子的表达而发挥作用,这些结果为AR抑制剂AZD3514治疗AR+的乳腺癌提供了初步的分子机制基础。大量的临床实验也证明了AR拮抗剂可以提高AR+的乳腺癌病人的生存率。Kensler等[18]对4 147例浸润性乳腺癌患者进行了平均16.5年的随访调研,发现AR的表达与ER+肿瘤的预后改善相关。另有一项II期临床试验也发现:在局部晚期或转移性的AR阳性的TNBC患者中,Enzalutamide具有临床疗效,且安全性良好,提示Enzalutamide可能是一种晚期TNBC患者的有效药物[19]。本研究表明AR的新型拮抗剂HC-1119呈浓度依赖和时间依赖性地抑制BT549细胞活性,且明显促进细胞的早期凋亡率,提示HC-1119能通过抑制AR的表达降低TNBC细胞株BT539的细胞增殖能力。这个结论我们进一步通过细胞周期的检测得以验证,HC-1119可以显著阻滞BT549细胞于S期。有趣的是,另有文献报道Enzalutamide虽然能够抑制BT549细胞活性,但是它并不能促进细胞早期凋亡,也不会改变细胞周期分布[15]。我们考虑这可能与不同AR拮抗剂的分子机制不同有关。
目前普遍认为抑癌基因p21的正常功能是通过停滞细胞周期,阻断细胞分裂,有利于基因组的损伤后修复。且大量文献报道,抗肿瘤药物可通过增加P21的表达而促进乳腺癌细胞凋亡,证实了P21在抗肿瘤中的重要作用[ 20-21]。我们进一步探讨HC-1119抑制BT549细胞增殖的分子机制时却发现,HC-1119可能通过抑制细胞周期相关蛋白P21的表达,明显增加S期细胞的比例,抑制细胞的活力,促进细胞凋亡,这与上述P21经典机制并不一样。我们考虑这可能与我们选择的细胞系有关,本实验选择的BT549是一株特殊的P53缺失的人乳腺癌细胞株。有文献报道在P53受损或缺失的细胞中,当P21在细胞质富集时,可使细胞株获得一定的致癌特性,进而显著促进细胞增殖,抑制细胞凋亡,促进细胞迁移[22-23]。这就较好地解释了我们的实验结果与常规结论不一致的原因。
此外我们还发现HC-1119还能够明显降低BT549细胞的迁移和侵袭能力。但是,当我们进一步研究其细胞侵袭分子机制时,却发现作为侵袭的关键步骤EMT的分子标志物E-cadherin和vimentin在control组和实验组的变化趋势并不明显,提示HC-1119不是通过EMT过程抑制BT549的侵袭转移。至于HC-1119如何调控三阴性乳腺癌细胞BT549的侵袭和转移,尚有待进一步研究。
综上所述,我们的研究发现新型人工AR拮抗剂HC-1119能够通过P21的表达降低抑制AR阳性的TNBC细胞BT549的细胞活力,且不通过EMT过程抑制侵袭和迁移能力,提示HC-1119可能成为AR阳性表达的TNBC的一种潜在的有效的治疗药物。

