大黄黄连泻心汤对2 型糖尿病大鼠骨骼肌中AMPKα、PGC-1α、GLUT4 表达的影响
郝建华 包毅敏 包 芸 鹿 伟 张超伟 郝艺杰
1.内蒙古医科大学中医学院,内蒙古呼和浩特 010030;2.内蒙古医科大学附属医院骨科,内蒙古呼和浩特 010050;3.内蒙古医科大学附属医院中医科,内蒙古呼和浩特 010050
随着人们生活水平和饮食结构的改变,糖尿病(diabetes mellitus,DM)发病率呈逐年上升趋势,已经成为继心血管疾病和肿瘤之后,排名第三位的威胁人类健康的慢性系统性疾病[1-2]。DM 中90%以上的患者属于2 型糖尿病(type 2 diabetes mellitus,T2DM),其发病率高,病程长,易引发心脑血管、肾脏、神经系统等多种并发症,使T2DM 的预防和治疗成为研究的热点;T2DM 的发病因素多,病理机制复杂,研究发现,其发病机制与体内多种代谢相关酶、血糖调节相关信号通路关系密切,腺苷酸活化蛋白激酶(AMP-acticated protein kinase,AMPK)、PI3K/Akt、缺氧诱导因子(HIF-1)、肿瘤坏死因子α(TNF-α)、血管内皮生长因子(VEGF)、FoxO、NF-κB 等多种信号通路广泛参与了血糖的调控[3-4],使T2DM 的发病机制成为研究的难点。通过对T2DM 代谢相关信号通路的研究,明确作用靶点,开发调节血糖代谢相关信号通路的抑制剂或激活剂,对临床治疗具有重要意义。
中药治疗T2DM 具有多途径、多通道、多靶点、多效应的优势,在临床中被广泛应用。大黄黄连泻心汤出自《伤寒杂病论》,临床应用能够降糖、降脂、减轻体重,能够改善患者多饮、多食等症状,对于T2DM 有较好的疗效[5-8]。本实验采用高糖高脂饲料联合小剂量链脲佐菌素(STZ)法构建T2DM 大鼠模型,观察大黄黄连泻心汤对糖脂代谢的影响,对骨骼肌中腺苷酸活化蛋白激酶α(AMPKα)、过氧化物酶体增殖活化受体γ共激活因子-1α(peroxisome proliferator activated receptor-γ coactivator-1α,PGC-1α)、葡萄糖转运蛋白4(glucose tRNAsporter 4,GLUT4)表达的影响,探讨大黄黄连泻心汤调节糖脂代谢与AMPK 信号通路的相关性,寻找其作用靶点,为临床应用提供理论和实验依据。
1 材料与方法
1.1 实验动物与饲料
SPF 级健康雄性Wister 大鼠40 只,体重(200±20)g,8 周龄,购自内蒙古医科大学实验动物中心。动物生产许可证号:SCXK(蒙)2015-0001,SPF 级使用环境由内蒙古医科大学实验动物中心提供,动物使用许可证号:SYXK(蒙)2015-0001,经内蒙古医科大学医学伦理委员会批准,饲养于内蒙古医科大学实验动物中心非屏障室,室温20℃,湿度50%~70%,光暗周期(12 h/12 h),动物自由摄食饮水;高糖高脂饲料(猪油10%、糖20%、胆固醇2.5%、胆酸钠0.5%、基础饲料67%)购于北京科澳协力饲料有限责任公司。
1.2 实验药物及主要试剂
大黄黄连泻心汤(根据《金匮要略》所载的配比剂量,大黄∶黄连∶黄芩为2∶1∶1)购于内蒙古自治区中医院;二甲双胍(北京利龄制药厂,生产批号:161014);STZ(美国SIGMA 公司,货号:SO-130,批号:18883-66-4);大鼠葡萄糖试剂盒(上海荣盛生物药业有限公司,批号:YZB/沪2624-40-2014);三酰甘油(TG)ELISA 试剂盒(南京建成生物工程研究所,批号:A110-1);总胆固醇(TC)ELISA 试剂盒(南京建成生物工程研究所,批号:A111-1);低密度脂蛋白胆固醇(LDL-C)ELISA 试剂盒(南京建成生物工程研究所,批号:A113-1);Phospho-AMPKα(Thr172)(40H9)Rabbit mAb(美国CST 公司,批号:CST 2535S);AMPKα Rabbit mAb(美国CST公司,批号:CST 2603S);PCG-1α Mouse mAb(美国CST 公司,批号:CST 2705S);GLUT4 Mouse mAb(美国CST 公司,批号:CST 2823S);AMPKα PGC-1α GLUT4 引物设计合成(生工生物工程股份有限责任公司,批号:111085660);血糖仪(北京华益静点生物技术有限公司,批号:878P19904000266);PrimeScript RT 试剂盒(thermo 公司,批号:K1622);BCA 试剂盒(Solarbio 公司,批号:PC0020)。
1.3 造模方法
40 只大鼠适应性喂养7 d 后,采用随机数字表法分为空白对照组10 只和造模组30 只。空白对照组以普通饲料喂养,造模组以高糖高脂饲料喂养,4 周后禁食12 h,造模组腹腔内注射STZ(25 mg/kg),空白对照组注射等体积柠檬酸-柠檬酸钠缓冲液。各组按照原方案继续喂养7 d 后,禁食12 h,取尾静脉血,用血糖仪测定空腹血糖(FPG),以FPG≥7.8 mmo1/L 作为T2DM 模型成功与否的判断标准[9-10],造模组90%达到标准。3 只大鼠造模未成功,再次腹腔内注射半剂量STZ(12.5 mg/kg),再以上述指标评估,均造模成功。造模成功后所有大鼠以普通饲料喂养。
1.4 动物分组与给药方法
将造模成功的30 只大鼠按照随机数字表法分为中药组、二甲双胍组、模型组,每组10 只。中药组以大黄黄连泻心汤灌胃,按照《动物与人体的每公斤体重计量折算系数表》折算,给药量为1 g/(100 g·d),二甲双胍组按照18 mg/(100 g·d)以二甲双胍灌胃,模型组、空白对照组予以等体积的生理盐水灌胃,共4 周。实验过程中有3 只大鼠死亡,空白对照组、中药组及模型组各1 只,空白对照组及中药组大鼠死亡前发现有鼻及口腔出血现象,死亡后经解剖发现肺中有残留液体,余脏器未见明显异常,推测其死因可能是由灌胃手法不当引起,模型组死亡大鼠经解剖发现胃肠高度胀气、肠梗阻,推测为急性酮症酸中毒所致。
1.5 标本取材与检测
1.5.1 血糖、血脂测定 分别于药物治疗前、治疗4 周后,禁食12 h,取各组大鼠尾静脉血,用血糖仪测定FPG。实验结束后,所有大鼠禁食12 h,腹腔注射20%乌拉坦(5 mL/kg)麻醉、处死,腹主动脉取血,离心机3000 r/min,离心10 min,离心半径8 cm,分离出血清,送至内蒙古医科大学分子生物学研究中心,-70℃冰箱保存。ELISA 法检测FPG、TC、TG、LDL-C。
1.5.2 胰腺组织病理学观察 实验结束后,切取胰腺组织,浸泡于10%的甲醛溶液中固定,后送至内蒙古医科大学分子病理学实验室。胰腺组织冲洗后,梯度乙醇脱水,二甲苯浸泡透明,浸蜡包埋,切片烘干,切片厚度4 μm,进行苏木精-伊红(HE)染色。经脱腊,水化,HE 染色,脱水,透明后封固,于光镜下观察胰腺组织细胞形态,显微摄影。
1.5.3 RT-PCR 检测 实验结束后,所有大鼠取右后肢大腿骨骼肌,保于液氮中冷却30 min,送至内蒙古医科大学分子生物学研究中心,-80℃冰箱保存,进行骨骼肌中AMPKα、PGC-1α、GLUT4 的mRNA 检测。所有大鼠各称取60 mg 骨骼肌,研磨、冷却后,加入Trizol溶液裂解,提取RNA,用紫外分光光度计测定RNA 浓度,光密度(OD)260 与OD280 比值在1.8~2.0 之间,以2 μg 的RNA 为基本模板量,应用PrimeScript RT试剂盒,将RNA 逆转录出cDNA,以GAPDH 为内参,加入AMPKα、PGC-1α、GLUT4 上下游引物,配置PCR扩增体系,反应条件为:94℃×2 min,94℃×2 s,50℃×2 s,72℃×2 s,共40 个循环,每个样本重复3 次,用2-ΔΔCt数值来分析AMPKα、PGC-1α、GLUT4 的mRNA 表达量。见表1。

表1 AMPKα、PGC-1α、GLUT4 引物序列表
1.5.4 Western blot 检测 测定骨骼肌中AMPKα、磷酸化的腺苷酸活化蛋白激酶α(P-AMPKα)、PGC-1α、GLUT4 蛋白表达量。所有大鼠各取称取50 mg 骨骼肌,RIPA 细胞裂解液裂解提取蛋白,用BCA 试剂盒测定蛋白含量后,每组各取50 μg,进行十二烷基硫酸钠-聚丙烯酞(SDS-PAGE)凝胶电泳,转移至硝酸纤维素(NC)膜,之后孵一抗Phospho-AMPKα 抗体(1 ∶1000)、AMPKα 抗体(1 ∶1000)、PCG-1α 抗体(1∶1000)、GLUT4 抗体(1∶1000)及内参GAPDH 抗体(1∶800),4℃反应过夜,TBS-T 漂洗后,相应二抗工作液(1∶800)37℃孵育,TBS-T 漂洗,使用ECL 发光显色液曝光,压片,显影并定影,扫描仪扫描图片,用Image J软件分析每个条带的荧光强度值,每组实验重复3次。
1.6 统计学方法
采用SPSS 20.0 统计学软件对数据进行分析,计量资料采用均数±标准差()表示,组内比较采用t检验,多组间比较采用方差分析,组间两两比较采用LSD-t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 各组治疗前后尾静脉FPG 比较
造模后,造模组FPG 显著高于空白对照组,差异有高度统计学意义(P <0.01);中药组、二甲双胍组治疗后FPG 较治疗前显著降低,差异有高度统计学意义(P <0.01)。见表2。
表2 各组治疗前后尾静脉FPG 的比较(mmol/L,)

表2 各组治疗前后尾静脉FPG 的比较(mmol/L,)
注:与空白对照组治疗前比较,#P <0.01。FPG:空腹血糖
2.2 各组治疗后FPG、TC、TG、LDL-C 比较
与空白对照组比较,模型组TC、TG、LDL-C 均显著升高,差异有高度统计学意义(P <0.01 或P <0.05)。与模型组比较,治疗后中药组及二甲双胍组FPG、TC、TG、LDL-C 均显著降低,差异有统计学意义(P <0.05 或P <0.01)。中药组与二甲双胍组FPG、TC、TG、LDL-C 比较,差异无统计学意义(P >0.05)。见表3。
表3 各组治疗后FPG、TC、TG、LDL-C 比较(mmol/L,)

表3 各组治疗后FPG、TC、TG、LDL-C 比较(mmol/L,)
注:与空白对照组比较,△P <0.05,△△P <0.01;与模型组比较,*P <0.05,**P <0.01。FPG:空腹血糖;TC:总胆固醇;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇
2.3 胰腺组织病理学观察
空白对照组:胰岛β 细胞数量多,呈团索状分布,结构完整,细胞边界清楚,胞浆丰富,细胞核清晰可见;模型组:胰岛β 细胞数量减少,外形较小,胞浆少,细胞核致密、溶解,出现透明样变,部分细胞出现空泡样变性。与模型组比较,中药组和二甲双胍组胰岛结构较完整,胰岛β 细胞数量有所增加,空泡细胞减少,细胞变性程度较轻,细胞核清晰可见。见图1。

图1 各组大鼠胰腺HE 染色表现(400×)
2.4 各组AMPKα、PGC-1α、GLUT4的mRNA表达比较
与空白对照组比较,模型组大鼠骨骼肌中AMPKα、GLUT4 及PGC-1α 的mRAN 表达量显著降低,差异有统计学意义(P <0.05 或P <0.01);与模型组比较,中药组PGC-1α、GLUT4 及AMPKα 的mRAN 表达量增高,差异有统计学意义(P <0.05 或P <0.01);二甲双胍组AMPKα、PGC-1α、GLUT4 的mRAN 表达量显著增高,差异有统计学意义(P <0.01);中药组与二甲双胍组AMPKα、PGC-1α、GLUT4 的mRAN 表达量比较,差异无统计学意义(P >0.05)。见表4。
2.5 各组P-AMPKα、AMPKα、PGC-1α、GLUT4、GAPDH蛋白表达水平比较
与空白对照组比较,模型组大鼠骨骼肌中PAMPKα、AMPKα、PGC-1α、GLUT4 蛋白表达量显著降低,差异有高度统计学意义(P <0.01);与模型组比较,中药组P-AMPKα、PGC-1α、GLUT4 及AMPKα 蛋白表达量显著增高(P <0.05 或P <0.01);二甲双胍组P-AMPKα、AMPKα、PGC-1α、GLUT4 蛋白表达量显著增高,差异有高度统计学意义(P <0.01)。中药组与二甲双胍组,AMPKα、PGC-1α、GLUT4 蛋白表达量比较,差异无统计学意义(P >0.05)。中药组、二甲双胍组P-AMPKα/ AMPKα 显著高于模型组(P <0.01),差异有统计学意义。见表5、图2。
表4 各组AMPKα、PGC-1α、GLUT4 的mRNA 表达比较()
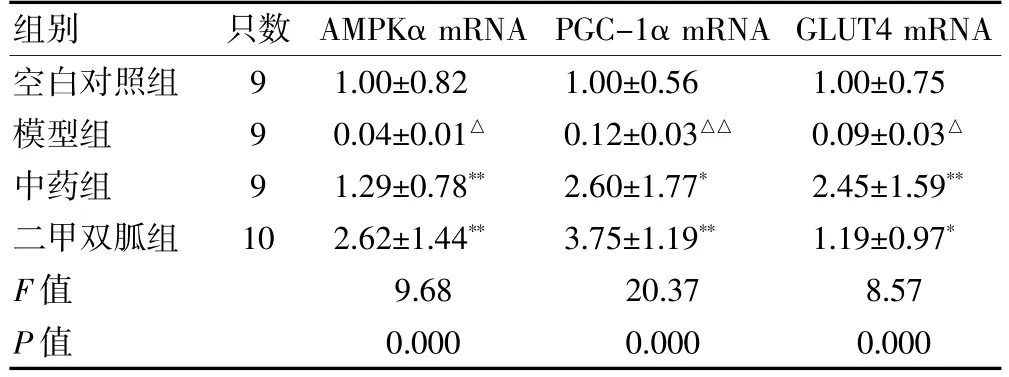
表4 各组AMPKα、PGC-1α、GLUT4 的mRNA 表达比较()
注:与空白对照组比较,△P <0.05,△△P <0.01;与模型组比较,*P <0.05,**P <0.01。AMPKα:腺苷酸活化蛋白激酶α;PGC-1α:过氧化物酶体增殖活化受体γ 共激活因子-1α;GLUT4:葡萄糖转运蛋白4
表5 各组P-AMPKα、AMPKα、PGC-1α、GLUT4 蛋白表达水平的比较()
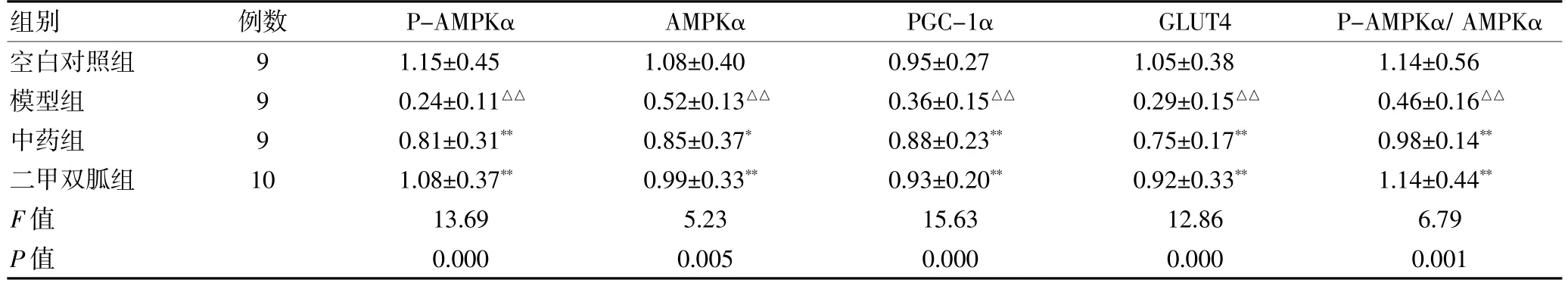
表5 各组P-AMPKα、AMPKα、PGC-1α、GLUT4 蛋白表达水平的比较()
注:与空白对照组比较,△△P <0.01;与模型组比较,*P <0.05,**P <0.01。P-AMPKα:磷酸化的腺苷酸活化蛋白激酶α;AMPKα:腺苷酸活化蛋白激酶α;PGC-1α:过氧化物酶体增殖活化受体γ 共激活因子-1α;GLUT4:葡萄糖转运蛋白4

图2 各组AMPKα、P-AMPKα、PGC-1α、GLUT4、GAPDH 蛋白表达水平
3 讨论
T2DM 的主要发病机制为胰岛素抵抗和胰岛素分泌障碍,在疾病的发生发展过程中,高血糖和脂代谢紊乱又进一步降低胰岛素敏感性,并损伤胰岛β 细胞功能,这是T2DM 发病机制中最重要的获得性因素。研究发现,糖脂代谢紊乱与体内多种代谢相关信号转导机制有密切关系,由于AMPK 信号通路对糖脂代谢起全方位的调控作用,能够增加骨骼肌细胞对葡萄糖的摄取和代谢,增加脂肪酸氧化及减少三酰甘油合成,增加胰岛素敏感性[11-12],因此,AMPK 一直是DM研究中的重要靶点。
AMPK 作为能量调节的关键因子,在细胞内AMP/ATP 比值升高、上游蛋白激酶等多因素的作用下被激活,使AMPK 具有活性,AMPK 被激活的标志是α 亚基第172 位苏氨酸(Thr172)的磷酸化,磷酸化的腺苷酸活化蛋白激酶(P-AMPK)通过磷酸化下游的一系列酶类底物,来调节糖脂代谢[13]。PGC-1α 是AMPK 下游的靶分子,AMPK 能够促进PGC-1α 磷酸化水平,增加它的表达量,来调控葡萄糖代谢、脂肪酸氧化及减少氧化应激等[14]。骨胳肌是摄取和消耗葡萄糖的主要外周组织,葡萄糖进入骨胳肌细胞需要细胞膜上的GLUT4 直接参与,激活的AMPK 使GLUT4 从囊泡转运至细胞膜,囊泡与细胞膜融合,才能使被插入细胞膜的GLUT4 用于转运葡萄糖,促进葡萄糖的摄取量快速增加,降低血糖,因此,P-AMPK 能够增加GLUT4 的转位,进而增强肌肉对胰岛素的反应[15]。同时,PGC-1α 又通过激活GLUT4 的上游调控子MEF2C,高效诱导GLUT4 的基因表达,使骨骼肌细胞转运葡萄糖的能力进一步提高[16]。二甲双胍作为治疗T2DM的一线用药,是AMPK 信号通路的激活剂。研究发现,二甲双胍通过抑制线粒体复合物I,降低ATP,升高AMP,来激活AMPK,抑制糖异生,降低血浆游离脂肪酸,增加胰岛素分泌;通过增加肌肉中GLUT4 的转位,促进葡萄糖的摄取;通过上调线粒体中PGC-1α 的基因表达,增加胰岛素敏感性,来降低血糖[17-20]。
DM 中医学称之为消渴,主要病机为气阴两虚、燥热内盛,由于热伤气阴,致使热毒浊邪聚生,瘀阻血络,火热邪气是DM 的基本致病因素和重要病理机制[21-23],因此,本研究确立了清热、化瘀、解毒的治法。大黄黄连泻心汤中大黄能够清热泻火、凉血解毒、逐瘀通经,黄连、黄芩能够清热燥湿、泻火解毒。本课题组在前期的临床中应用大黄黄连泻心汤治疗T2DM,发现患者口干多饮、多食、四肢麻木等症状减轻,血糖、血脂明显降低,具有较好的临床疗效[24]。本研究采用高糖高脂饲料联合小剂量STZ 法构建T2DM 大鼠模型,造模后所有大鼠的FPG 均显著高于空白对照组,说明造模成功,证明此方法制备T2DM 大鼠模型可行。模型组大鼠胰岛β 细胞数量减少,细胞透明样变,FPG、TC、TG、LDL-C 明显高于空白对照组,经大黄黄连泻心汤治疗后,大鼠胰岛β 细胞数量有所增加,细胞变性程度较轻,空泡细胞减少,检测FPG、TC、TG、LDL-C 显著降低,说明大黄黄连泻心汤能够降低血糖、血脂,对胰岛β 细胞具有修复和保护作用,与课题组前期的临床观察一致,证实了大黄黄连泻心汤对糖脂代谢的调节作用。中药组与二甲双胍组比较,FPG、TC、TG、LDL-C 无显著差异,说明大黄黄连泻心汤降糖、降脂疗效确切,为临床应用提供了实验依据。
本实验研究结果显示,发生DM 时,骨骼肌中AMPKα、PGC-1α、GLUT4 的mRNA 及蛋白表达量减少,P-AMPKα/AMPKα 比值降低,说明骨骼肌细胞中AMPK 磷酸化受到抑制,AMPKα 活性显著降低,抑制了GLUT4、PGC-1α 表达,使葡萄糖转运受阻,出现胰岛素调节障碍,血糖升高,这可能是外周组织出现胰岛素抵抗的原因之一。本实验应用大黄黄连泻心汤治疗后,骨骼肌中P-AMPKα、AMPKα、PGC-1α、GLUT4的mRNA 及蛋白表达量增加,P-AMPKα/AMPKα 比值增高,与二甲双胍组比较,结果一致,提示大黄黄连泻心汤对糖脂代谢的调节作用与二甲双胍一致,也与AMPK 信号通路相关,也是通过提高AMPK 磷酸化水平,激活AMPK,上调PGC-1α 和GLUT4 的表达,来降低血糖,这是其降糖、降脂作用机制的一个方面,AMPK 信号通路并不是大黄黄连泻心汤调节血糖代谢的唯一通路,发现其可能作用的其他信号通路并明确作用靶点,还有待于进一步研究。AMPKα 与GLUT4、PGC-1α 这两个因子并不是完全独立的,而是彼此联系。AMPKα 可诱导PGC-1α、GLUT4 基因表达,PGC-1α 又可以调控GLUT4 的表达量,三者协同作用,使骨骼肌细胞转运葡萄糖的能力提高。本实验中应用大黄黄连泻心汤治疗后,RT-PCR 和Western blot 的结果趋势一致,AMPKα、GLUT4、PGC-1α 表达量均增加,说明基因表达量的变化,经转录、翻译,引起了蛋白表达量相应的变化。
综上所述,大黄黄连泻心汤在T2DM 大鼠模型中应用,降糖、降脂效果明显,对胰岛β 细胞具有修复和保护作用,其降糖机制与AMPK 信号通路相关,通过激活AMPKα,增加PGC-1α、GLUT4 的表达,进而调节糖脂代谢。本实验为大黄黄连泻心汤的临床应用提供了理论依据,它可能作为AMPK 信号通路的激活剂,为T2DM 的预防和治疗提供新思路。

