手关节能量多普勒超声评分预测生物制剂治疗类风湿关节炎疗效的价值
李 媛, 戚务芳
(天津市第一中心医院 风湿免疫科, 天津, 300192)
类风湿关节炎(RA)是一种临床常见的慢性自身免疫疾病,可导致关节畸形[1-2]。目前,临床上针对RA度采用药物治疗,以达到缓解症状、延缓关节功能丧失、减轻疼痛、提高患者生活质量的目的。针对RA的治疗药物主要包括非甾类抗炎药(NSAIDs)、改善病情抗风湿药物(DMARDs)、激素以及生物制剂等。多数患者经常规DMARDs、NSAIDs治疗后病情可缓解,但仍有部分患者常规治疗无效,必须应用生物制剂。白细胞介素- 6(IL- 6)拮抗剂是RA治疗中较为常用的生物制剂,托珠单抗(TCZ)是这一类药物的代表。在中重度RA的治疗中, TCZ可单用,也可与DMARDs联用,特别是对于难治性RA及对其他生物制剂反应欠佳患者的适用性较高。目前,国际上通常将经药物治疗后达到美国风湿病学会(ACR)制定的ACR20标准作为RA患者临床收益的判定依据。依据关节能量多普勒超声(PDUS)检查结果的PD评分与RA的相关性越来越受到关注,但大多数关于PD评分的研究只局限于RA的诊断和疾病活动度评价。本研究采用前瞻性研究方法,分析手关节PD评分预测TCZ治疗RA的疗效,现报告如下。
1 资料与方法
1.1 一般资料
选取2017年4月—2018年4月在医院就诊、接受TCZ治疗的80例中重度RA患者,所有患者均签署知情同意书,并自愿参加本研究。纳入标准: 所有患者均符合ACR于1987年制定的RA诊断标准[3], 病情符合ACR和欧洲抗风湿病联盟(EULAR)2010年制定的RA评分诊断标准中的中重度活动标准[4], 即28个关节疾病活动度积分(DAS28)≥3.2, 病变至少累及1处掌指或近指关节; 既往未应用肿瘤坏死因子- α(TNF- α)拮抗剂或应用效果不佳; 年龄均大于18岁; 能够坚持治疗并完成长期随访。排除标准: 指掌发育畸形或既往有手术史的患者; 入组3个月内有手部关节内激素注射史的患者; 合并其他感染性病变的患者; 合并肝、肾、心、脑、肺等重要脏器器质性病变以及血液系统疾病或处于妊娠或哺乳期的患者; 既往接受过IL- 6拮抗剂治疗或具有过敏史、应用禁忌的患者。
1.2 治疗方案
所有纳入患者均给予TCZ(每4 mL 80 mg, 罗氏公司,进口药品注册证号S20130020, 批次号B1014B04)治疗,给药剂量为8 mg/kg, 用法为将药物溶于0.9%的氯化钠注射液100 mL中静脉滴注, 4周1次,治疗时间为24周,同时根据患者病情可酌情给予DMARDs治疗、激素治疗。所有患者的诊治决策均由同一位具有10年以上临床经验的风湿科医生负责。
1.3 观察指标
在入组时、TCZ治疗12周时、TCZ治疗24周时评价患者的相关指标。
1.3.1 血液指标检测: 采集患者的空腹外周静脉血样本,入组基础水平的采血时间为入组当日且接受TCZ治疗之前, TCZ治疗12周时、TCZ治疗24周时的采血时间均为当周最后1 d, 对患者的红细胞沉降率(ESR)、C反应蛋白(CRP)、白细胞计数(WBC)、类风湿因子(RF)、血小板计数(PLT)水平进行检测。
1.3.2 疾病活动度评价: 对患者的28个关节压痛关节数(TJC28)、28个关节肿胀关节数(SJC28)、视觉模拟量表(VAS)评分进行评价,并根据上述数据计算DAS28- ESR、DAS28- CRP。
1.3.3 手关节PD评分评价: 采用百盛超声诊断仪,应用PDUS对所有患者的手关节PD评分进行评价。检测方法为: 患者双手平放于检查台上,针对肿胀、压痛等症状较严重一侧的腕关节,第2、3掌指关节及第2、3近端指间关节等5个关节进行检测,设定线阵探头频率为12 MHz, 首先采用常规二维超声对手背侧和掌侧横切和纵切扫查,观察滑膜、关节腔、骨皮质及其血流特点,而后于最厚处测量滑膜厚度,测量3次取平均值作为最终测量值,并在PDUS条件下观察滑膜内血流,测量其血流参数。采用半定量评分对滑膜内血流情况进行评分,评分标准[5]为: 无PD信号记为0分: 有PD信号但独立PD信号≤3个记为1分; 独立PD信号>3个或汇合PD信号小于滑膜面积的一半,记为2分; 汇合PD信号达到或超过滑膜面积的一半,记为3分。PD评分总分为0~15分。所有超声检查及评估均接受2名具有3年以上超声检查经验的影像科医生独立进行,评价结果不一致时由第3位高年资医师进行最终判定,影像学医师对所有患者相关临床生化指标、DAS28评分以及前一次的超声检测结果均设盲。
1.3.4 TCZ疗效评价: 对纳入患者在TCZ治疗12周时、TCZ治疗24周时达到ACR20的比例进行评价, ACR20的具体标准为: 患者的28个关节肿胀及触痛的个数有20%的改善且VAS评分、健康评估问卷、病人的总体评估疾病活动、医师整体评估疾病活动、急性期反应物等5项参数中至少3项有20%的改善。
1.4 统计学方法

2 结 果
2.1 纳入患者的基本资料及随访情况
纳入患者中,男27例,女53例,年龄34~83岁,平均(59.82±12.76)岁; RA病程为15~39个月,平均(23.72±7.38)个月; 6例合并糖尿病, 5例合并高血压, 8例合并冠心病; 11例既往有接受TNF- α拮抗剂史,后因效果不佳而停用。本研究随访期截至2018年10月,所有患者均完成了治疗、随访过程,无失访或中途退出治疗病例。
2.2 纳入患者不同时点的血液指标的比较
随着TCZ治疗的开展,患者各时点的ESR、CRP、WBC、RF、PLT水平逐渐降低,各时点ESR、CRP、RF、PLT水平的总体差异有统计学意义(P<0.05), 且不同时点之间的差异均有统计学意义(P<0.05), 而各时点WBC的总体差异无统计学意义(P>0.05), 见表1。
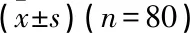
表1 纳入患者不同时点的血液指标的比较
ESR: 红细胞沉降率; CRP: C反应蛋白; WBC: 白细胞计数; RF: 类风湿因子; PLT: 血小板计数。
与入组时比较, *P<0.05; 与TCZ治疗12周时比较, #P<0.05。
2.3 纳入患者不同时点的疾病活动度指标、手关节滑膜厚度及PD评分的比较
随着TCZ治疗的开展,患者各时点的DAS28- CRP、DAS28- ESR、滑膜厚度、手关节PD评分水平逐渐降低,差异均有统计学意义(P<0.05), 且不同时点的差异均有统计学意义(P<0.05), 见表2。
2.4 患者手关节PD评分预测TCZ治疗远期疗效的价值分析
在TCZ治疗12周时、TCZ治疗24周时,分别有43例(42.00%)和54例(68.00%)达到ACR20标准。ROC曲线分析结果显示,患者入组时手关节PD评分预测TCZ治疗12周时达到ACR20标准的AUC无统计学意义(AUC=0.571, 95%置信区间为0.406~0.736,P=0.393)。患者入组时手关节PD评分预测TCZ治疗24周时达到ACR20标准的AUC无统计学意义(P>0.05), 而TCZ治疗12周时手关节PD评分预测TCZ治疗24周时达到ACR20标准的AUC有统计学意义(P<0.05), 在Cut- off值下,灵敏度为0.875, 特异度为0.529。见表3。
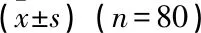
表2 纳入患者不同时点的疾病活动度指标、手关节滑膜厚度及PD评分比较
与入组时比较, *P<0.05; 与TCZ治疗12周时比较, #P<0.05。
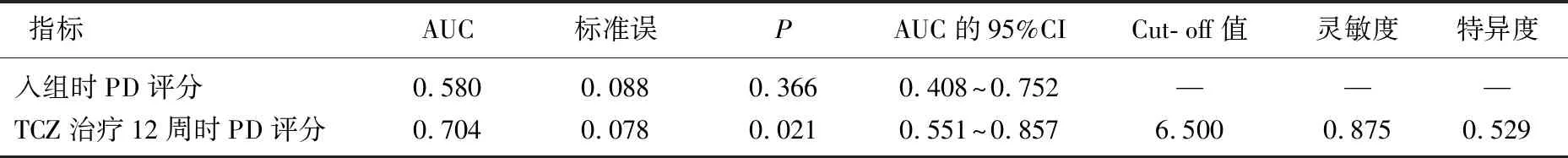
表3 手关节PD评分预测TCZ治疗24周时达到ACR20标准的价值分析
3 讨 论
本研究结果显示,随着TCZ治疗时间的增加,患者的急性炎症反应和疾病活动度均逐渐降低,手关节的PD评分和滑膜厚度也呈现出了相同的变化趋势,这反映了在常规的DMARDs、激素等药物治疗的同时联合应用TCZ治疗,能够较好地控制RA的病情,降低疾病活动度,缓解自身免疫反应导致的关节滑膜炎症损害,而手关节PD评分能够间接地反映这一变化趋势。目前国际上通常采用DAS28作为衡量RA疾病活动度的依据,临床上将DAS28高于3.2的RA患者称为中重度活动度患者,此类患者病情较重,需要进行积极的治疗以改善其预后。一般来说,如果在接受治疗后能够达到ACR20标准即认为治疗有效。促炎因子IL- 6的过表达在RA进展过程中扮演着重要的角色, IL- 6能够通过与细胞膜受体和体液中的可溶性受体相结合,诱导和加剧慢性炎性反应,从而推进RA患者的关节破坏进程。
托珠单抗是首个人源化IL- 6受体单克隆抗体,能够有效阻断IL- 6的生物信号通路,达到缓解RA临床症状、保护关节功能的效果,在日本、欧洲和美国托珠单抗已获准用于RA和幼年特发性关节炎等疾病的治疗[6]。研究者[7]报道了将托珠单抗与DMARDs联合用于中重度RA、难治性RA治疗的研究结果,均达到了缓解炎症反应、降低疾病活动度、改善贫血和维生素D缺乏症状、纠正纤溶- 凝血功能紊乱、改善患者症状的效果,有些研究结果中报道的中重度RA患者在TCZ治疗8、12周时达到ACR20者比例高达90%和95%, 达到ACR50者比例达80%和90%, 且不良反应较轻[8], 这显著高于本研究结果中报道的数据。
作者认为,这可能与选取研究对象的异质性有关。在实际临床工作中, TCZ等生物制剂辅助治疗一般很难在短期内达到理想的效果,而且有一部分患者即使经过长期治疗也很难获得临床受益,由于TCZ价值昂贵,这也大幅度增加了患者的经济负担。同时,基于国内外多项研究的循证医学研究[9]在肯定了生物制剂疗效的同时,也提出了对其应用安全性的质疑。研究者[10]明确指出,与安慰剂或DMARDs相比,采用白细胞介素类生物制剂治疗RA可能会增加不良事件发生率、感染发生率以及严重感染发生率,因此,针对临床实践中仍应谨慎应用TCZ等生物制剂治疗,特别是要对患者的个性化特征要进行全面评价,对于有应用指征的中重度RA患者,要通过TCZ治疗早期患者对药物的反应性和不良反应有效地预测可能达到的疗效,以正确指导临床决策、减轻患者的负担,这也成为了近年来研究的热点问题。
本研究结果显示,在中重度RA的治疗中, TCZ治疗12周时的手关节PD评分可作为预测TCZ治疗24周时疗效的指标,这提示了在TCZ治疗早期有效监测患者的手关节PD评分对于指导治疗方案的调整具有积极的意义。肌肉骨骼超声检查具有非侵入性、检查费用易于接受、可重复检测等优势。近年来,灰阶超声、PDUS、超声造影等多种超声检查手段被广泛地用于RA的诊断、疗效评价和预后预测[11]。PDUS具特异性和敏感性均较高的特点,能够明确地反映受累关节的滑膜增厚、关节腔积液等病理改变,还可检出炎性滑膜组织中新生血管产生的低速血流,能够有效辅助针对RA的诊断、疾病活动度监测、疗效评价和疾病复发预测[12]。研究[13]结果显示, RA患者手足部7关节的PD评分与RA的疾病活动度、滑膜炎症损害程度具有相关性; 同时, PD评分通过反映滑膜增生、滑膜炎、腱鞘炎等RA特征性改变,可用于评价中重度RA患者的药物疗效[14]。但是,针对PD评分是否能够预测TCZ疗效这一课题,国内鲜有报道,而国外的临床研究[15]证实, TCZ治疗12周后的手部PD评分可用于预测治疗24周时RA患者的疾病活动度改善幅度,但并未报道是否能够用于预测达到ACR20标准。本研究结果支持了手关节PD评分能够预测TCZ疗效的结论,作者认为,这可能是由于手关节PD评分能够准确地反映患者的炎症反应程度,进而间接反映了机体内IL- 6等促炎因子的表达状态。国外的针对应用DMARDs治疗RA患者的研究[16]结果显示,患者的血清IL- 6水平与DAS28、手部及腕部关节的PD评分呈均正相关关系,在矫正了DAS28后, IL- 6水平和手部10个关节的PD评分仍存在明确的正相关关系。IL- 6表达水平与RA患者对TCZ治疗的反应性直接相关[17-19]。因此,在TCZ治疗早期,可根据患者的手关节PD评分对患者是否能够通过TCZ治疗获得临床收益做出预测。
综上所述, TCZ治疗能够显著缓解中重度RA患者的炎症反应程度、降低疾病活动度和关节滑膜损害程度,患者在治疗12周时的手关节PD评分可用于预测治疗24周时的治疗效果。

