XN9000血液分析仪两模块的性能评价
赵妍 喻超 倪维
湖北省中医院检验科,湖北武汉 430074
全血细胞分类计数是血液学实验室最经常使用的测试方法,不断开发更新的技术使自动血液分析仪能够提供更准确的结果[1]。模块化的血液分析系统内部的智能有机配合,能够实现大批量标本的检测[2]。XN-9000是一款可扩展的模块化自动化血液分析系统,为了满足目前医学实验室认可的需求,保证实验室检测结果的准确性[3-5],现对实验室配置A1(XN20)和B4(XN10)分析模块的XN9000血液分析系统性能进行验证。
1 材料与方法
1.1 样本来源
本研究所选取新鲜抗凝全血标本均来自湖北省中医院光谷院区门诊和住院患者,研究起止时间为2017年7~9月。
1.2 仪器与试剂
XN-9000血液分析系统及原装试剂、染液、玻片、校准品和质控品(日本Sysmex 公司),LH750血液分析仪及原装试剂、校准品和质控物(美国BECKMANCOULTER 公司)、Olympus 显微镜(日本Olympus 公司)、瑞氏-吉姆萨和煌焦油兰染液(珠海BASO 公司)。
1.3 方法
按仪器操作规程操作,结果均按照《WS/T 406-2012临床血液学检验常规项目分析质量要求》[6]进行判定。
1.3.1 本底及空白计数
取稀释液当作样本上机检测,连测3次。分别记录两个模块测试结果。
1.3.2 携带污染率
每个项目各取1份高、低浓度样本,连续在两模块上测定3次,高浓度结果记为H1、H2、H3;低浓度检测结果为L1、L2、L3。按公式:携带污染率=(L1-L3)/(H3-L3)×100%计算每个模块各项目的携带污染率。
1.3.3 精密度
批内精密度:取1份各项目结果均在正常参考区间的标本,重复检测11次,计算后10次检测结果的均值、标准差和变异系数(CV)。批间精密度:以室内质控在控结果的CV 为评价指标,使用2个浓度(Level 2、Level 3)的质控品,检测当天进行1次室内质控,若出现失控数据,纠正后按批号计算所有在控数据的CV。
1.3.4 正确度
取10份各项目结果均在参考区间内的样本,在两个模块及LH750上依次检测。每个样本2次,计算2次结果的均值。以作为规范检测系统[6]的LH750所测均值为标准,计算两模块结果与标准间的偏倚。
1.3.5 线性
针对不同项目,选一份结果接近厂商线性范围上限的高值标本(H),分别按100%、50%、25%、12.5%、6.25%、3.125%、0%的比例进行稀释,每个稀释度连续测3次并计算均值。将每个稀释度均值和理论计算值做线性回归,计算回归方程a 值(斜率)及相关系数平方R2。
1.3.6 实验比较
1.3.6.1 白细胞五分类与人工计数比较 比对实验在精密度实验验证之后进行,每日保证仪器稳定质控在控,随机选择8份标本,连续5 d 共40份标本。在A1、B4模块分别用全血细胞计数(CBC)+白细胞分类计数(Diff)模式测试后,于SP-10推片机上制备标准血片并染色,按照《WS/T246-2005白细胞分类计数参考方法》[7]进行白细胞五分类计数,分别由2名中级以上职称资深细胞学检验人员重复分类计数2次并计算均值。
1.3.6.2 网织红细胞计数与人工计数比较 每日仪器状态稳定、质控在控的情况下,选取8份标本,连续5 d共40份标本,在A1模块进行检测,之后按照《全国临床检验操作规程》(第4版)[8]的要求进行染色制片。由2名资深细胞学检验人员重复2次计数并计算均值。
1.4 统计学方法
采用SPSS 24.0软件对数据进行统计分析,做一元线性回归分析和Pearson 双变量相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 本底及空白计数
本底计数两模块各次检测值均为0,符合白细胞≤0.5×109/L,红细胞≤0.05×1012/L,血红蛋白≤2.0 g/L,血小板≤10×109/L 的检测要求。
2.2 携带污染率
白细胞、红细胞、血红蛋白、血小板的携带污染率A1模块分别为-0.01%、0.13%、0.42%、0.00%,B4模块分别为0.07%、0.00%、0.41%、0.00%,未超出白细胞≤3%,红细胞≤2.0%,血红蛋白≤2.0%,PLT≤4.0%的携带污染率标准[6]上限。
2.3 两模块的批内精密度,批间精密度结果
两模块的批内精密度、批间精密度结果见表1~2,精密度验证结果符合标准[6]要求。
2.4 A1、B4模块的正确度验证结果
A1、B4模块的正确度验证结果见表3,均未超出正确度验证允许偏倚的最大范围[6]。
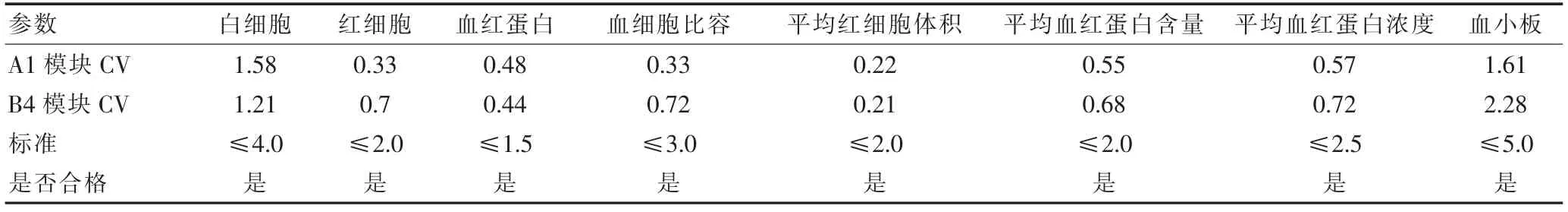
表1 批内精密度验证结果(%)
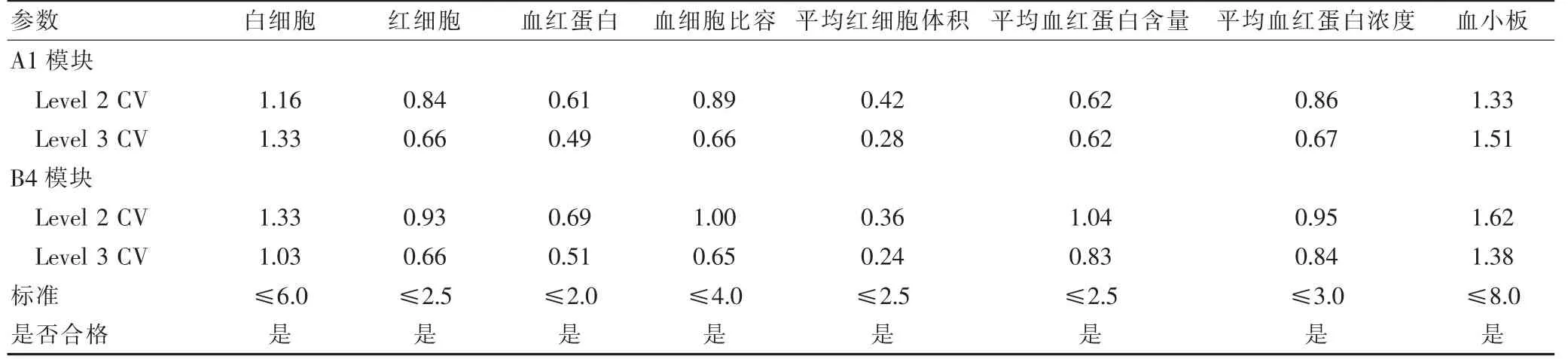
表2 批间精密度验证结果(%)
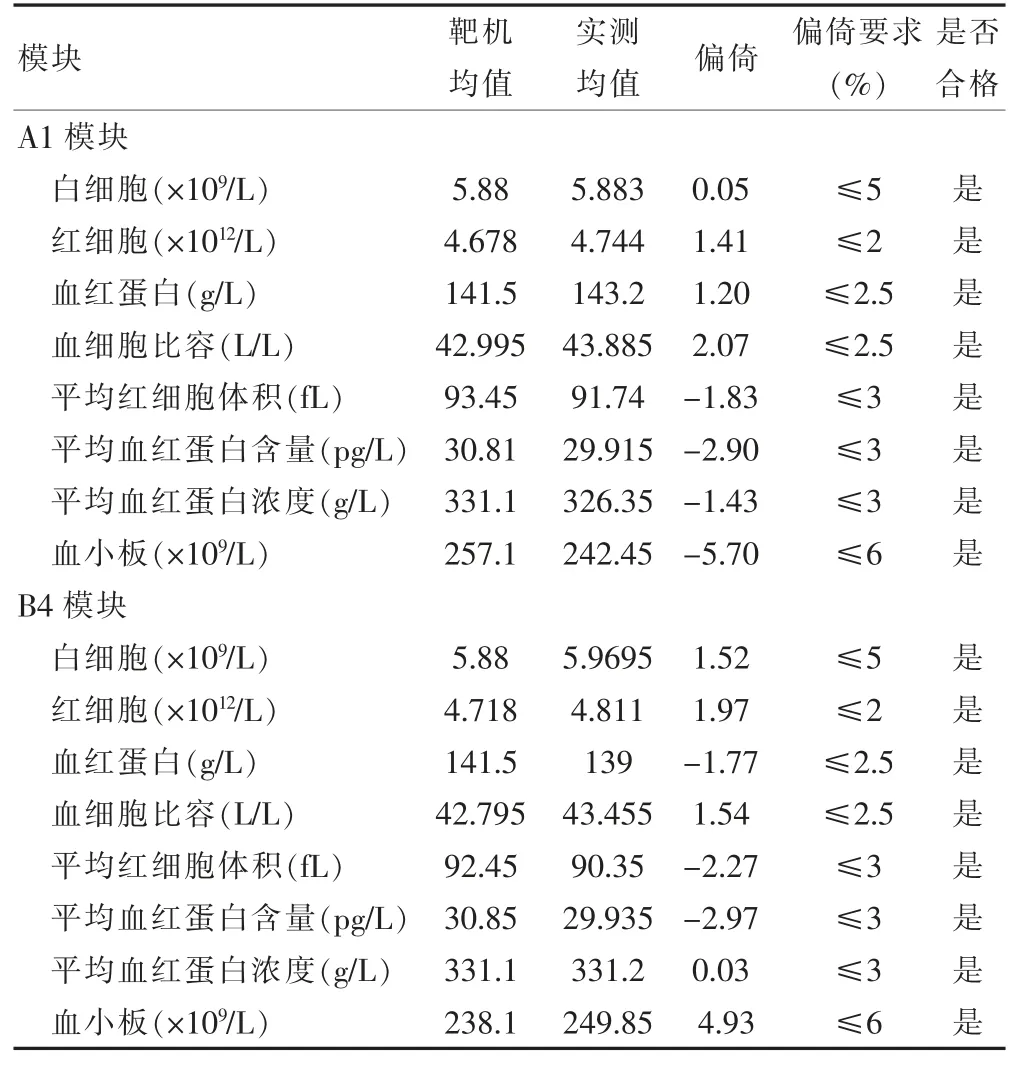
表3 A1、B4模块的正确度验证结果
2.5 A1、B4模块的线性验证结果
A1、B4模块的线性验证结果见表4,结果均未超出标准[6]要求。
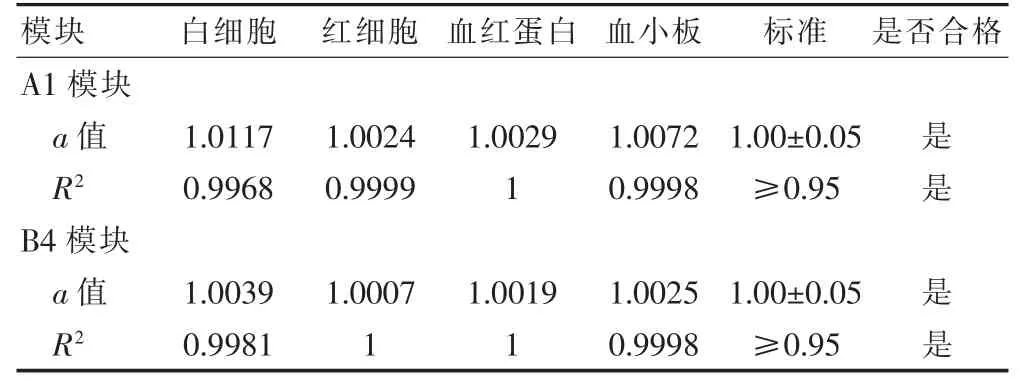
表4 A1、B4模块的线性验证结果
2.6 A1模块与手工计数检测相关性分析
两模块白细胞分类和网织红细胞检测结果与手工计数均具有相关性(P <0.01),A1、B4模块嗜碱性粒细胞相关系数分别为0.675、0.678,相比其他参数较小。见表5。
3 讨论
XN9000是旨在满足包含大量异常样品的高通量实验室的工作空间和效率要求而设计的模块化分析系统。该仪器使用阻抗、电导率和光学检测来确定全血细胞计数、白细胞分类和网织红细胞计数的参数。XN9000组件包括分类归档、自动推片和染色机、扩展信息处理单元和多达9个个性化分析器模块。具有对空间要求不高、灵活适应各种场地和检测需求的特点[9]。该仪器还引入了一些改进和新的测量通道包括白细胞成核(WNR)、白细胞分类(WDF)、白细胞前体细胞(WPC)和荧光血小板(PLT-F)通道[10]。仪器的性能验证是在安装和操作验证的基础上,检查仪器的重复性,评价仪器的稳定性、准确性、灵敏度等指标,是保证检验质量的必要过程[11]。本室严格按照目前所运行的ISO15189质量管理体系的程序文件和操作手册,对XN9000做性能验证,两模块的空白计数、携带污染率、正确度、精密度、线性结果均符合标准[6]。
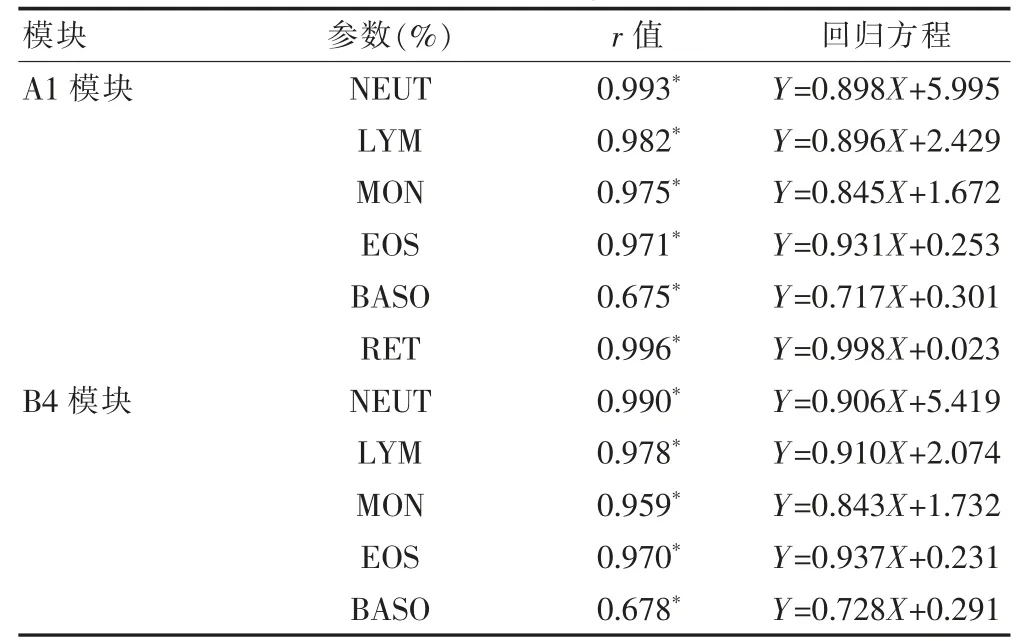
表5 A1模块与手工计数检测相关性分析
白细胞分类与手工分类结果显示显著的相关性,这与熊仲波等[12]研究结果一致。相比其他细胞嗜碱性粒细胞的相关性较弱,可能与手工分类白细胞,总共只计数200个,而与其中嗜碱性粒细胞的比例低有关[7,13]。且血细胞本身有着复杂的生物学外观,不一致的染色和光照变化,人工镜检本身受限于技术人员的技能和经验可能导致重复性差[14]。Ciepiela等[15]认为血涂片制备过程会导致嗜酸性粒细胞损伤的比例增加,因此与自动化方法比较,人工检查中嗜酸性粒细胞的数量较少是由于排除了破碎的细胞。任朝翔等[16]研究发现血液分析仪自动计数出现嗜碱性粒细胞结果不符,以异常淋巴细胞干扰最多见,此外还包括中毒性颗粒、未成熟粒细胞等的干扰。另有文献[17-18]报道仪器分类识别异常淋巴细胞以及未成熟粒细胞还存在一定缺陷。因此仪器的局限和异常标本本身的原因,都可能导致自动和手动计数嗜碱性粒细胞的差异。本研究标本来自随机日常门诊住院患者,并未对异常淋巴或粒细胞及幼稚细胞进行区分,且在实际分类过程中对有核红细胞和未成熟粒细胞进行剔除,不能排除此类不确定干扰,可能导致结果不符。有文献[19]报道自动血液分析仪计数单核细胞的结果不太准确,特别是在计数严重白细胞减少的样本时。本研究中两模块单核细胞百分比与手工分类相关性较高,可能与比对实验所选取的样本中白细胞减少样本所占比例较低有关。
网织红细胞(RET)计数反映了人体骨髓的红细胞生成活性[20],对于骨髓功能状态的监测、贫血的诊断评估等有重要临床意义。由于传统的人工显微镜检方法,受限于制片染色效果、镜检人员的经验等因素,存在变异较大且重复性较差的问题。随着自动化学和荧光染色网织红细胞RNA 技术的发展,目前,已经出现了各种使用不同试剂和技术来测量网织红细胞的分析仪。XN9000的RET 计数是运用Fluorocell RET染液,在稀释的血样中测定网织红细胞数、网织红细胞比率及血小板数。其中RET-He 是由Sysmex 开发的独特项目,它使用了网织红细胞散射光信号和Sysmex专有的运算法则。同时运用了新参数的自动化流式细胞分析技术,是网织红细胞计数的显著进步,并且提供了可接受的精确度和偏差[21-22]。研究显示使用荧光染料进行自动网织红细胞计数的分析仪之间有比较好的一致性[15,23]。本研究中A1模块的网织红细胞计数与人工计数结果的比较,表现出良好的相关性(r=0.996)。此外,有文献[24]报道某些血液成分、疾病状态或荧光药物会对仪器网织红细胞计数结果造成干扰,本研究病例样本局限,未对可能的干扰因素做进一步分类研究。实际工作中可以通过检查仪器状态、报警信息,查看历史记录、搜集病史信息等途径来排查是否存在干扰因素,并用人工镜检来校正。
综上所述,两模块XN9000血液分析系统的各项性能指标良好,符合相关标准和本实验室技术和质量要求。本研究中的白细胞分类与手工比对实验,并未针对细胞总数不同进行区分,特别是未对低值白细胞样本做仪器与人工的分类比对,因此存在一定局限。同时由于两模块的检测系统相对独立,后续使用中还应关注两模块间相互的结果比较和偏倚评估。

