腹腔镜胃癌根治术对胃癌患者免疫功能及微转移的影响
李煜庆 梁 明 刘晓晨
胃癌在我国各种恶性肿瘤中居首位,好发年龄在50岁以上,具有显著的地域性差别[1-2]。随着医学技术的发展,腹腔镜技术在胃癌手术中的应用进一步得到认可[3]。特别是完全腹腔镜全胃切除能取得较好的近期疗效,且能达到与开腹手术相同的根治效果[4-5]。当前“微转移(micrometastasis)”在肿瘤研究中受到广泛重视,淋巴结微转移一般指常规检测手段不能发现的肿瘤转移灶[6]。本文具体探讨了腹腔镜胃癌根治术对胃癌患者免疫功能及微转移的影响,现报告如下。
1 资料与方法
1.1 资料
采用回顾性研究方法,选择2014年1月到2017年9月在我院进行诊治的早期胃癌患者122例作为研究对象,纳入标准:术前诊断为胃癌,且得到术后病理证实;淋巴结转移灶无融合并包绕重要血管;无显著手术禁忌者;医院伦理委员会批准了此次研究;临床资料完整;患者心肺功能良好,无合并其他疾病者,在自愿条件下签署了知情同意书。排除标准:术中被迫中转开腹的患者;行联合脏器切除术者;临床资料缺乏者。根据手术方法的不同分为研究组61例与对照组61例,两组患者的肿瘤直径、体重指数、组织学类型、肿瘤部位、性别、年龄等对比差异无统计学意义(P>0.05)。见表1。

表1 两组一般资料对比
1.2 方法
两组手术均由同一组医师施行,对照组给予根治性全胃切除术31例,根治性远端胃切除术30例。研究组给予腹腔镜根治性全胃切除术32例,腹腔镜根治性远端胃切除术29例。
在腹腔镜手术中,严格按照腹腔镜及胃癌手术的治疗规范实施,严格遵循无瘤原则。采用气管插管全身麻醉,弧形五孔法腹壁戳孔入路,建立CO2气腹,气腹压力为12 mmHg左右。探查腹腔,离断胃与十二指肠,切除病灶,从切口拖出,胃部行结肠前胃空肠侧侧吻合,丝线间断缝合,逐层缝合切口。
在开腹手术中,采用气管插管全身麻醉,取上腹正中15~20 cm切口,逐层入腹后放置切口保护圈,充分暴露术野。以电刀游离大网膜,沿横结肠上缘向左向右分离,剥离横结肠系膜前叶,后续处理同观察组。
1.3 观察指标
①记录两组的术中出血量、术后排气时间、手术时间、术后住院时间、术后留置导尿时间等。②记录两组术后14 d的腹腔出血、吻合口瘘、肺部感染、腹腔感染、切口感染等并发症发生情况。③所有患者在术后1 d与术后14 d抽取外周静脉血4~6 ml,应用流式细胞仪对外周血CD3+、CD4+、CD8+等T淋巴细胞水平进行测定,严格遵守操作说明书进行。④在术后6个月与12个月检测患者微转移发生情况。
1.4 统计学方法
应用SPSS 18.00软件分析,计量数据与计数数据以均数±标准差、率等表示,对比为t检验与卡方χ2分析,检验水准α=0.05。
2 结果
2.1 围手术指标对比
两组手术患者均获得成功,无中转开腹情况,研究组的术中出血量、术后排气时间、术后住院时间、术后留置导尿时间显著少于对照组(P<0.05),见表2。
2.2 术后并发症对比
研究组术后14 d的腹腔出血、吻合口瘘、肺部感染、腹腔感染、切口感染等并发症发生率为3.3%,显著低于对照组的19.7%(P<0.05),见表3。

表2 两组围手术指标对比
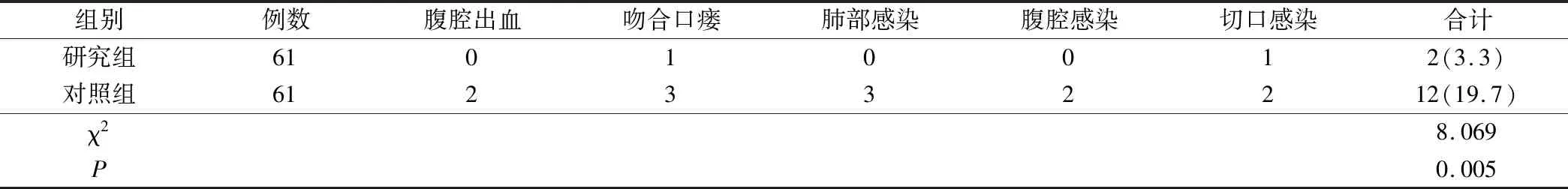
表3 两组术后并发症发生情况对比/例
2.3 免疫功能变化对比
研究组术后14 d的CD3+、CD4+值高于术后1 d,研究组高于对照组,对比差异都有统计学意义(P<0.05),两组CD8+值在组内与组间对比差异都无统计学意义(P>0.05),见表4。
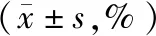
表4 两组术后不同时间点的T淋巴细胞水平变化比较
2.4 微转移情况对比
研究组术后6个月与12个月的微转移发生率分别为0和3.3%,显著低于对照组的9.8%和16.4%(P<0.05),见表5。
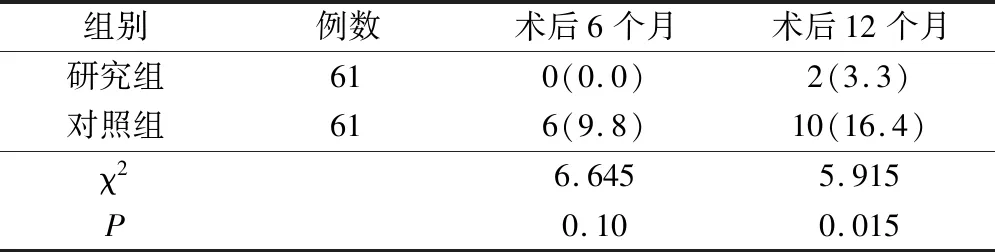
表5 两组术后微转移情况对比(例,%)
3 讨论
胃癌是1种全球性的疾病,当前我国每年新发胃癌人数将近50万,列我国第二位恶性肿瘤相关致死原因[7]。现代研究表明胃癌是人类常见的恶性肿瘤之一,其发生是1个多因素、多步骤、进行性发展的过程[8]。在胃癌人群中,大约10%表现为家族聚集倾向。目前胃癌的治疗原则依然外科手术治疗,但是传统开腹手术对患者的创伤比较大,术后恢复比较慢,也容易出现术后并发症[9]。
随着腹腔镜手术技术的提高,使腹腔镜治疗胃癌的适应症也逐渐扩大。不过如何能在保证患者生存率的情况下,通过腹腔镜技术,使患者减轻创伤、保障手术安全、改善患者生存质量,是当前研究的热点[10-11]。本研究显示两组手术患者均获得成功,无中转开腹情况,研究组的术中出血量、术后排气时间、术后住院时间、术后留置导尿时间显著少于对照组(P<0.05);研究组术后14 d的腹腔出血、吻合口瘘、肺部感染、腹腔感染、切口感染等并发症发生率为3.3%,显著低于对照组的19.7%(P<0.05)。当前也有研究显示,Ⅲ期以内的胃癌患者都可以选择腹腔镜下完成根治手术,对局部有浸润的则可行联合脏器切除,从而促进患者康复[12]。从机制上分析,腹腔镜下操作轻柔,对脏器干扰较小,更有助于肠功能的恢复,有利于患者的早期活动和恢复,减少了术后并发症的发生[13]。
在胃癌手术治疗中,手术、疾病与麻醉都存在一定的应激作用,可影响患者的免疫功能[14]。本研究显示研究组术后14 d的CD3+、CD4+值高于术后1 d,研究组高于对照组,对比差异都有统计学意义(P<0.05),两组CD8+值在组内与组间对比差异都无统计学意义(P>0.05),表明腹腔镜的应用有利于机体免疫功能的恢复[15]。不过要手术中要注意以下事项:手术者熟悉胃周腹腔镜下解剖特点,行淋巴结清扫时力求整块切除原则,一定要在正常的解剖平面进行手术操作,从而彻底清扫各组相关淋巴结,减少对患者免疫功能的影响[16]。
胃癌的转移是包括肿瘤细胞与宿主间质和宿主细胞间的一系列复杂步骤组成的结果,涉及到新生血管形成、肿瘤细胞的黏附改变、细胞增殖改变、肿瘤细胞的迁移、细胞外基质降解增加等[17-18]。微转移是指肿瘤在发展过程中肿瘤细胞播散至机体其他任何组织器官非血液系统的恶性肿瘤,在胃癌术后中的发病率比较高[19]。有研究表明胃癌患者多伴随有淋巴结微转移。但从微转移发展到临床转移是1个涉及肿瘤本身的生物学特性、机体的免疫状态等相当复杂的过程[20]。本研究显示研究组术后6个月与12月的微转移发生率分别为0.0%和3.3%,显著低于对照组的9.8%和16.4%(P<0.05),表明腹腔镜的应用能减少胃癌患者的术后为转移率。不过本研究也有一定的不足,研究的样本数量有待提高,且收集样本有一定的偏倚性,将在下一步进行深入分析。
综上所述,相对于开腹手术,腹腔镜胃癌根治术在胃癌患者中的应用能改善免疫功能,促进患者的康复,减少术后并发症的发生,降低微转移发生率。

