补骨生髓方对去势骨质疏松大鼠Smad/ERK信号通路的影响
孙凯 魏戌* 谢雁鸣 张平 王源 章轶立 唐彬 陈琳
1.中国中医科学院望京医院,北京 100102 2.中国中医科学院中医临床基础医学研究所,北京 100700 3.北京中医药大学,北京 100029
骨质疏松症(osteoporosis,OP)是一种全身骨代谢性疾病,其主要特征是骨量减少及骨微结构发生改变,伴随骨强度下降、骨脆性增加及骨折危险性增加等特点[1]。随着人口老龄化社会的到来,OP已成为各国常见的严重危害人们健康的慢性疾病之一[2-4],尤其是骨质疏松导致的椎体骨折严重影响患者的生活质量,并增加了死亡率[5-6]。近年来,以MAPK/ERK、Smad为代表的信号通路及靶点是研究OP发生机制与效应机制的热点。
Smad4、ERK 等蛋白在成骨细胞的调节中发挥重要作用,能够参与成骨细胞的分化、增殖和凋亡等,尤为重要的是,ERK蛋白磷酸化能通过影响Smad蛋白的表达从而影响Smad信号转导通路的效应和成骨细胞的分化,其可能是治疗OP的关键作用靶点[7-10]。本研究的补骨生髓方临床疗效确切,临床显效率和总有效率分别为46%和82%[11];前期基础实验表明其可以显著提高去势大鼠OP(低转换型)模型的骨密度,具有雌激素、雄激素样作用及促性腺激素样作用等[12],但其对成骨细胞作用的关键信号通路和效应靶点机制却尚未阐明。因此,本研究在前期研究的基础上,拟建立去势OP动物模型并探讨补骨生髓方对去势骨质疏松大鼠Smad/ERK信号通路的影响,以期为今后的研究提供一定的实验依据。
1 材料和方法
1.1 材料
1.1.1实验动物:清洁级雄性大鼠,每只体重为250 g左右,10个月龄,共30只,购自北京维通利华实验动物中心技术有限公司(许可证号:SCXK(京) 2016-0006),由获得资格认可的人员标准饲养于中国科学院自动化研究所动物房。实验室为SPF级,湿度48%左右,温度25 ℃左右,大鼠自由进食、进水,定时更换灭菌垫料。
1.1.2药物及试剂:(1)补骨生髓方的药物组成:狗脊10 g,三七3 g,人参6 g等,药材来源于康美药业股份有限公司,经鉴定均为合格产品。(2)相关试剂:乙醇(北京市化工厂,规格:500 mL,批号:20120507);EDTA(北京市化工厂,规格:250 g,批号:20120418);二抗(德国DAKO公司,规格:15 mL,批号:10063211);DAB(德国DAKO公司,规格:5 mL,批号:00080066);一抗(ERK1/2北京市博士德生物技术有限公司,规格:0.2 mL,批号:BM4326);一抗(p-ERK1/2北京市博奥森生物技术有限公司,规格:0.2 mL,批号:Bs-3016R);一抗Smad4(北京博奥森生物技术有限公司,规格:0.1 mL,批号:bs-0585R)等。
1.1.3主要实验仪器:BX51显微镜(日本OLYMPUS公司);Ti-U(TE2000-S)型倒置显微镜(日本Nikon株式会社);EG1150H包埋机(德国LEICA公司);RM2235切片机(德国LEICA公司);H I1 210 摊片机(德国LEICA公司)等。
1.2 方法
1.2.1分组与造模:按照随机数字表的方法将大鼠分成2组:正常对照组6只,造模组24只。大鼠适应性喂养1周后开始造模,造模组采取去性腺法(摘除睾丸法)建立OP实验模型。摘除睾丸法(ORX)方法:在麻醉下(0.3%的戊巴比妥钠)施行无菌手术,取仰卧位固定,腹部去毛暴露术野,以75%的酒精及碘酊消毒,腹部正中切口进入腹腔,完整摘除双侧睾丸后逐层缝合。切口缝合后,外部敷以消炎粉。大鼠造模过程顺利,未出现意外死亡。摘除双侧睾丸术后2个月再将造模组大鼠随机分为4组:模型组、补骨生髓方高剂量组、补骨生髓方中剂量组、补骨生髓方低剂量组,每组6只。
1.2.2给药方案:补骨生髓方煎药方法:将中药饮片放入容器内,加入适量纯净水,浸泡水面没过药材3 cm,充分浸泡1 h,通过液体真空浓缩煎药机进行煎煮,40 min后沥出药汁至清洁容器;再次加入适量纯净水煎煮40 min后倒渣取汁,将两次煎煮药汁混合,80 ℃水浴箱浓缩后,保存于4 ℃冰箱备用。造模成功后补骨生髓方高、中、低剂量组分别以生药13.46 g/(kg·d)、6.73 g/(kg·d)、3.36 g/(kg·d)灌胃给药,每只每日给药一次,连续给药2个月。正常对照组和模型组去势大鼠按照同样的方法灌服等量体积的蒸馏水。
1.2.3取材及染色:灌胃给药结束后,根据大鼠的体重用戊巴比妥钠进行腹腔注射麻醉。然后迅速处死各组大鼠,取大鼠腰椎(L1-L4)及右侧股骨,采用双能X线骨密度测量仪检测骨密度;取右侧胫骨,制作石蜡切片,用于免疫组织化学染色。染色步骤:将切片脱蜡放入蒸馏水中,用PBS洗2~3次各5 min后进行抗原修复,PBS洗2~3次,每次各5 min,3%的H2O2孵育10 min,PBS再冲洗2~3次,每次5 min,加入一抗(1∶100稀释),在一抗作用下37 ℃ 2 h取出,PBS洗3次,每次各5 min,滴加二抗,在二抗作用下37 ℃ 1 h取出,PBS洗3次,每次各5 min,DAB显色5 min,PBS冲洗,运用哈瑞苏木素复染色,分色,返蓝,脱水,最后封片,镜检。
1.3 统计学处理
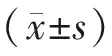
2 结果
2.1 骨密度测定
与正常对照组相比,补骨生髓方低剂量组及模型组的大鼠腰椎骨密度、右侧股骨骨密度差异具有统计学意义(P<0.05);与模型组相比,补骨生髓方高剂量组、中剂量组的腰椎骨密度、右侧股骨骨密度差异具有统计学意义(P<0.05),而低剂量组腰椎骨密度、右侧股骨骨密度差异无统计学意义(P>0.05)。见表1。
表1各组大鼠骨密度比较
Table1Comparison of bone mineral density of rats in each group
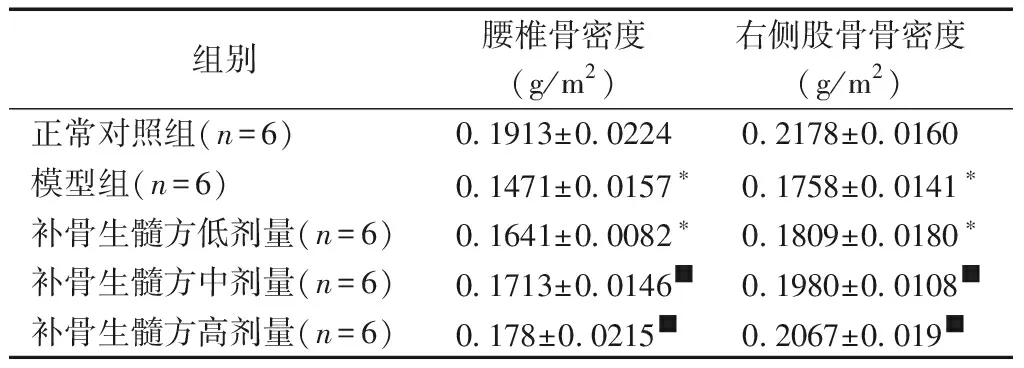
组别腰椎骨密度(g/m2)右侧股骨骨密度(g/m2)正常对照组(n=6)0.1913±0.02240.2178±0.0160模型组(n=6)0.1471±0.0157∗0.1758±0.0141∗补骨生髓方低剂量(n=6)0.1641±0.0082∗0.1809±0.0180∗补骨生髓方中剂量(n=6)0.1713±0.0146■0.1980±0.0108■补骨生髓方高剂量(n=6)0.178±0.0215■0.2067±0.019■
注:与正常对照组相比,*P<0.05;与模型组相比,■P<0.05。
2.2 HE染色
从HE染色发现,各组大鼠骨结构均有不同程度的变化,正常对照组大鼠骨小梁排列紧密,间距较小,分布相对均匀,且互相连接成致密的网状结构。而模型组去势大鼠的骨小梁结构排列较稀疏,间距增大且分布不匀称,网状结构连接不紧密。补骨生髓方各中药干预组的骨小梁结构均存在不同程度的变化,以高剂量组最为明显。见图1。
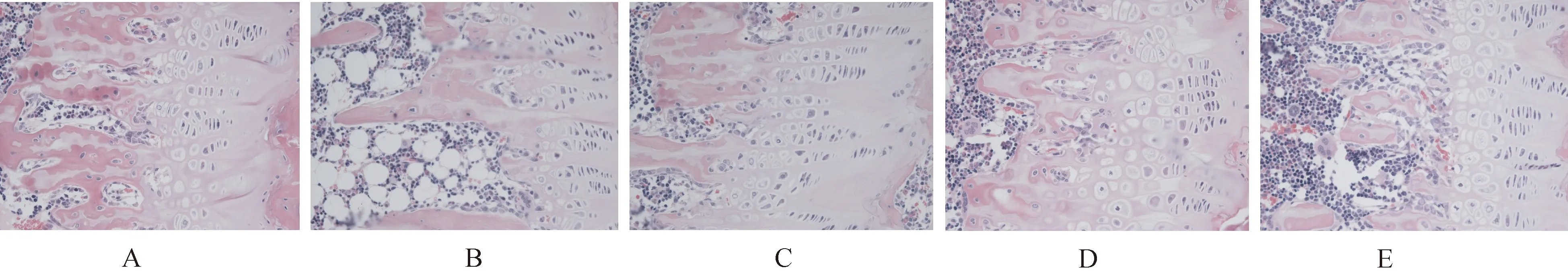
图1 各组大鼠HE染色(×400倍)A:正常对照组;B:模型组;C:补骨生髓方高剂量组;D:补骨生髓方中剂量组;E:补骨生髓方低剂量组。Fig.1 HE staining (×400). A: Normal control group; B: Model group; C: High-dose group of Bu Gu Sheng Sui decoction; D: Middle-dose group of Bu Gu Sheng Sui decoction; E: Low-dose group of Bu Gu Sheng Sui decoction.
2.3 免疫组织化学染色
2.3.1补骨生髓方对OP大鼠ERK蛋白表达的影响:与正常对照组相比,模型组大鼠ERK蛋白的表达差异有明显的统计学意义(P<0.05);与模型组进行对比,补骨生髓方高剂量组与中剂量组表达差异有显著的统计学意义(P<0.05),而低剂量组与模型组差异无统计学意义(P>0.05)。见表2、图2。
表2补骨生髓方对OP大鼠ERK蛋白表达的影响
Table2Effect of Bu Gu Sheng Sui decoction on ERK protein expression in OP rats
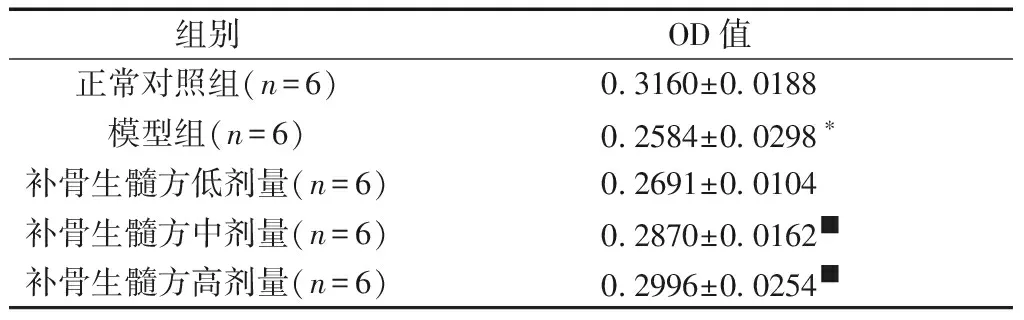
组别OD值正常对照组(n=6)0.3160±0.0188模型组(n=6)0.2584±0.0298∗补骨生髓方低剂量(n=6)0.2691±0.0104补骨生髓方中剂量(n=6)0.2870±0.0162■补骨生髓方高剂量(n=6)0.2996±0.0254■
注:与正常对照组相比,*P<0.05;与模型组相比,■P<0.05。
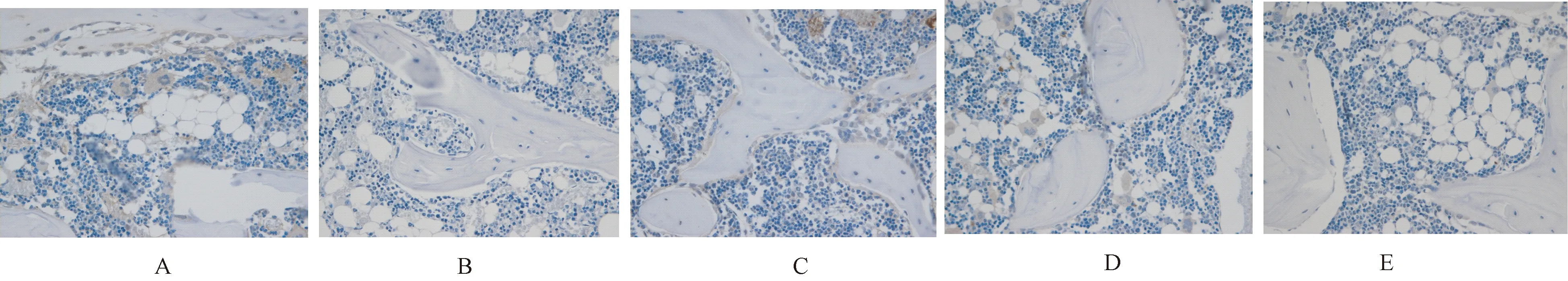
图2 补骨生髓方对OP大鼠ERK蛋白表达的影响 A:正常对照组;B:模型组;C:补骨生髓方高剂量组;D:补骨生髓方中剂量组;E:补骨生髓方低剂量组。Fig.2 Effect of Bu Gu Sheng Sui decoction on ERK protein expression in OP rats. A: Normal control group; B: Model group; C: High-dose group of Bu Gu Sheng Sui decoction; D: Middle-dose group of Bu Gu Sheng Sui decoction; E: Low-dose group of Bu Gu Sheng Sui decoction.
2.3.2补骨生髓方对OP大鼠p-ERK蛋白表达的影响:与正常对照组相比,模型组大鼠p-ERK蛋白的表达降低,差异有明显的统计学意义(P<0.05);与模型组进行比较,补骨生髓方高剂量组表达差异有显著的统计学意义(P<0.05),中剂量组也具有统计学意义(P<0.05),而低剂量组与模型组差异无统计学意义(P>0.05)。见表3、图3。
表3补骨生髓方对OP大鼠p-ERK蛋白表达的影响
Table3Effect of Bu Gu Sheng Sui decoction on p-ERK protein expression in OP rats
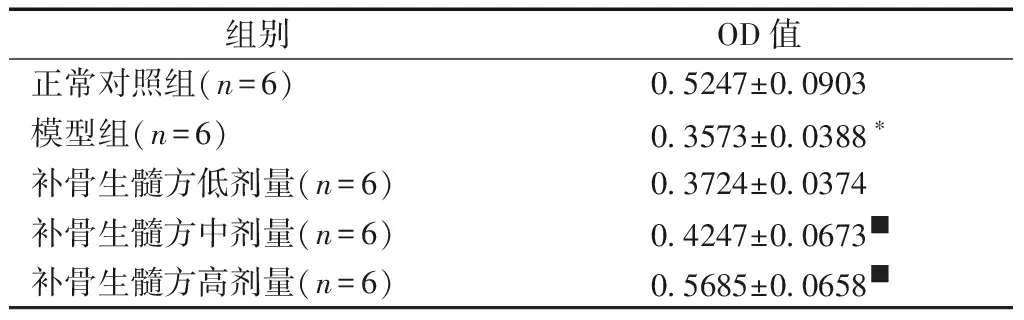
组别OD值正常对照组(n=6)0.5247±0.0903模型组(n=6)0.3573±0.0388∗补骨生髓方低剂量(n=6)0.3724±0.0374补骨生髓方中剂量(n=6)0.4247±0.0673■补骨生髓方高剂量(n=6)0.5685±0.0658■
注:与正常对照组相比,*P<0.05;与模型组相比,■P<0.05。
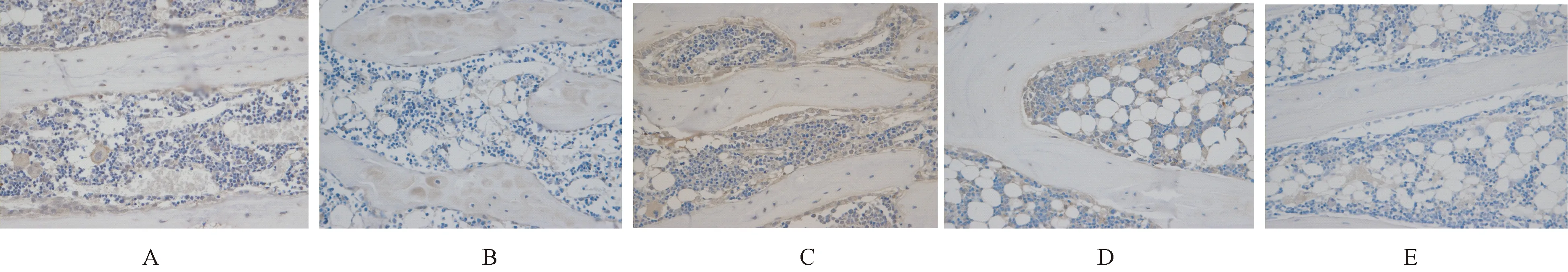
图3 补骨生髓方对OP大鼠p-ERK蛋白表达的影响 A:正常对照组;B:模型组;C:补骨生髓方高剂量组;D:补骨生髓方中剂量组;E:补骨生髓方低剂量组。Fig.3 Effect of Bu Gu Sheng Sui decoction on p-ERK protein expression in OP rats. A: Normal control group; B: Model group; C: High-dose group of Bu Gu Sheng Sui decoction; D: Middle-dose group of Bu Gu Sheng Sui decoction; E: Low-dose group of Bu Gu Sheng Sui decoction.
2.3.3补骨生髓方对OP大鼠Samd4蛋白表达的影响:与正常对照组相比,模型组大鼠Samd4蛋白的表达较低,差异有明显的统计学意义(P<0.05);与模型组进行比较,补骨生髓方高剂量组和中剂量组表达差异有显著的统计学意义(P<0.05),而低剂量组与模型组比较差异无统计学意义(P>0.05)。见表4、图4。
表4补骨生髓方对OP大鼠Samd4蛋白表达的影响
Table4Effect of Bu Gu Sheng Sui decoction on Samd4 protein expression in OP rats
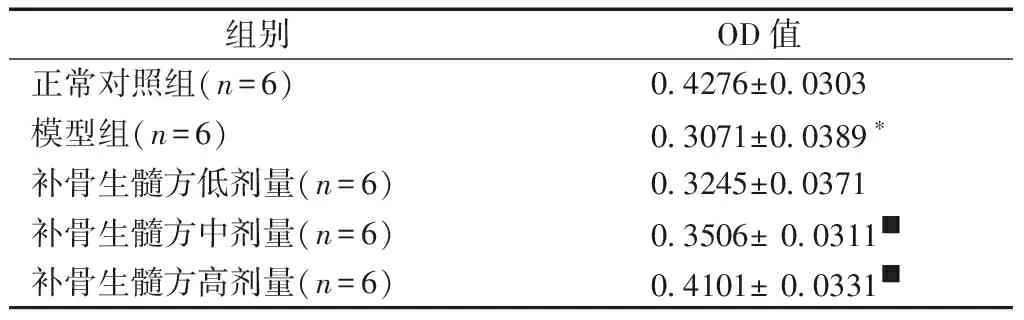
组别OD值正常对照组(n=6)0.4276±0.0303模型组(n=6)0.3071±0.0389∗补骨生髓方低剂量(n=6)0.3245±0.0371补骨生髓方中剂量(n=6)0.3506± 0.0311■补骨生髓方高剂量(n=6)0.4101± 0.0331■
注:与正常对照组相比,*P<0.05;与模型组相比,■P<0.05。
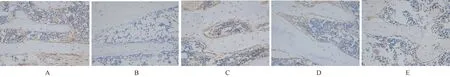
图4 补骨生髓方对OP大鼠Samd4蛋白表达的影响 A:正常对照组;B:模型组;C:补骨生髓方高剂量组;D:补骨生髓方中剂量组;E:补骨生髓方低剂量组。Fig.4 Effect of Bu Gu Sheng Sui decoction on Samd4 protein expression in OP rats. A: Normal control group; B: Model group; C: High-dose group of Bu Gu Sheng Sui decoction; D: Middle-dose group of Bu Gu Sheng Sui decoction; E: Low-dose group of Bu Gu Sheng Sui decoction.
3 讨论
OP是一种发病相对隐匿、并发症严重、致死率较高的疾病,世界卫生组织已经将其列为中老年三大疾病之一,在常见病中居第7位[1,13]。目前,OP目前仍然缺乏有效的治疗手段,中医药在其防治方面具有一定的优势,中医认为其发生发展是多脏腑共同作用导致的,与肾、脾、肝等脏腑密切相关,其中肾亏为主要病因,肝虚乃关键因素,脾虚是重要病因[14-15]。补骨生髓方的组方思路来源于《黄帝内经》,中医理论认为肾主骨生髓,肝主筋,脾主肌肉,本方补中有行,以补益为主,兼顾活血止痛。长期临床实践表明补骨生髓方治疗OP患者疗效确切,但其治疗的相关作用机制却尚未明确,因而其临床应用与推广受到限制。因此,在前期研究的基础上,成功建立了去势大鼠OP动物模型并初步探讨补骨生髓方对其关键蛋白表达的影响。
研究表明,促分裂原活化蛋白激酶(mitogen-activated protein kinase kinases,MAPK)信号通路在OP发病机制中发挥出重要的调节作用[16],而细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路是MAPK的主要信号通路之一,ERK信号通路是目前国内外骨质疏松领域的研究热点,该信号通路是多数生长因子、细胞因子调控细胞增殖、分化的重要途径,在成骨分化以及骨骼的形成中都起到至关重要的作用[17-18]。Kim等[19]研究表明胶原蛋白水解物可以刺激ERK1/2的磷酸化,最终导致成骨细胞(osteoblast,OB)分化和增殖,口服胶原蛋白水解物后,去势大鼠腰椎骨密度明显增加;Konosuke Nakayama等[9]发现ERK信号通路通过干扰Smad1的转移活性抑制BMP信号的传导,ERK可能是通过磷酸化反应调节转录因子的活性调控成骨细胞的分化;激活后的ERK信号通路可以转导蛋白,从而对细胞的多种生理功能发挥调节作用,如进入核内促进血清反应因子磷酸化,增强转录活性[20]。ERK蛋白的表达水平能够在某种程度上反映其信号通路的功能状态。本研究通过免疫组织化学染色发现补骨生髓方高剂量组与中剂量组可以有效上调去势大鼠ERK、p-ERK蛋白的表达,与模型组的表达差异显著,表明ERK可能是补骨生髓方药物作用的关键靶点。但ERK信号通路存在正反馈调控和负反馈调控两种反馈调控机制,有研究认为正反馈的调节主要是通过磷酸化双特异性磷酸酶6(DUSP6)的Ser159和Ser197,使蛋白酶降解DUSP6,从而延长ERK信号的持续时间[20-22]。本研究的结果可能是发挥正反馈调控作用,但具体作用机制仍有待进一步深入研究。
Smad 4蛋白是共同通路型Smad(Co-Smad)中的一员,是转化生长因子-β家族中各种信号传导过程共同的作用介质,其可以在骨髓板的全区广泛表达,Smad的表达与骨密度、骨形成及成骨细胞的数量密切相关。Smad信号通路转导的抑制和缺陷都能有效地下调成骨细胞特异性的转录因子Runx2与Osterix的表达,信号通路的功能障碍通常会引起骨量和骨形成减少,导致OP的发生发展[23-25]。本实验研究表明补骨生髓方高剂量组和中剂量组与模型组相比,可以明显提高去势大鼠Smad4蛋白的表达,但低剂量组却无明显效果,可能与给药的剂量等因素有关。赵小丹[26]研究表明卵巢去势大鼠模型组Smad2/4的表达分布的范围无明显改变,但其表达强度却明显减弱,而中药组则能增强其表达程度。武密山等[8]研究表明补肾方药能使靶器官骨组织上调Smad4的表达从而有效改善骨密度,其认为Smad4在mRNA层面的表达及蛋白水平的下调可能是OP发生的作用机制之一。本研究表明补骨生髓方可以有效上调Smad4的表达,且Smad与ERK信号通路密切相关,两者共同参与由ERK蛋白磷酸化介导的Smad/ERK信号通路,这可能是其防治OP的重要原因之一。
OP的发病机制十分复杂,骨重塑的动态和静态的平衡受到诸多因素的干扰,多个信号传导通路相互交织,通过抑制或激活一些关键环节的靶点来发挥调控作用。本研究仅初步表明补骨生髓方能够影响ERK、p-ERK、Smad4蛋白的表达,其可能是通过调控ERK蛋白磷酸化介导的Smad/ERK信号通路来发挥作用的,今后可以进一步从基因层面来深入探讨其作用靶点及效应机制。

