TNF-α和IL-6在高原地区翼状胬肉组织中的表达研究
王赟,毕春潮,樊苗苗,赵晓霞
论著
TNF-α和IL-6在高原地区翼状胬肉组织中的表达研究
王赟,毕春潮,樊苗苗,赵晓霞
探讨高原地区与平原地区翼状胬肉组织中TNF-α 和 IL-6 的表达情况。
免疫组织化学法和 Western blot 法检测 29 例平原地区和 29 例高原地区翼状胬肉患者切除的翼状胬肉组织中的 TNF-α及 IL-6 的表达。
免疫组织化学法结果显示,TNF-α 位于结膜上皮细胞基底膜和胞浆,IL-6 位于结膜上皮细胞、增生的纤维组织内及血管旁炎症细胞胞浆中。TNF-α 在高原组的阳性表达率(86.21%)显著高于在平原组中的阳性表达率(58.62%),差异具有统计学意义(< 0.05);IL-6 在高原组的阳性表达率(82.76%)显著高于在平原组中的阳性表达率(55.12%),差异具有统计学意义(< 0.05)。Western blot 检测显示 TNF-α 及 IL-6 在高原及平原翼状胬肉组织均有表达,在高原翼状胬肉组织中表达增强。
TNF-α 和 IL-6在高原地区翼状胬肉组织中的表达增强,可能与高原特殊环境有关。
翼状胬肉; 肿瘤坏死因子α; 白细胞介素6; 高原地区
翼状胬肉是一种常见的眼科疾病,不仅影响外观,随着疾病的进展,还可遮挡视物,并可通过对角膜的牵拉压迫作用、局部泪膜的透镜作用、角膜组织的瘢痕作用等引起角膜散光[1]。其发病机制及病因目前仍未完全清楚,但流行病学研究认为,翼状胬肉的形成与环境因素相关,眼部长期遭到阳光照射与风沙、花粉、粉尘等长期、慢性刺激是主要诱因,各种因素导致的慢性炎症刺激被认为是胬肉生长的必要条件[2]。从组织病理学分析,多种细胞因子联合作用引起上皮间充质细胞移行,并刺激成纤维细胞新生血管化而导致翼状胬肉的发生[3]。细胞因子是多种细胞所分泌的能调节细胞生长分化、调节免疫功能、参与炎症发生和创伤愈合等小分子多肽的统称[4-5]。近年来大量研究表明细胞因子在翼状胬肉发病中发挥着重要的作用,它们在正常细胞中也有不同程度的表达,但在翼状胬肉组织中表达出现异常[6-7]。
青海省平均海拔 3000 m 以上,日照时间长,紫外线辐射强,为了研究 TNF-α 和 IL-6在高原地区翼状胬肉组织中的表达情况,本研究选取 29 例平原地区和 29 例高原地区翼状胬肉患者切除的翼状胬肉组织,采用免疫组织化学法和 Western blot,检测 TNF-α 及 IL-6 表达情况,探讨 TNF-α 及 IL-6 在高原地区翼状胬肉中的作用。
1 材料和方法
1.1 材料
1.1.1 临床资料 高原组:采集 2017 年 6 月~ 2018 年 10 月期间西宁市第一人民医院就诊的翼状胬肉患者行胬肉切除术 29 例,其中男 12 例,女 17 例,年龄 30 ~ 55 岁,平均年龄(44 ± 3.45)岁。平原组:采集 2017 年 6月~ 2018 年 11 月期间西安市第四医院就诊的翼状胬肉患者行胬肉切除术 29 例,其中男 16 例,女 13 例,年龄30 ~ 55 岁,平均年龄(50 ± 5.24)岁。术中沿翼状胬肉头部外约 1 mm 透明角膜处开始浅层剖切,尽量不破坏翼状胬肉头、颈、体部表面的上皮组织。切除后迅速用 10% 甲醛固定,另外部分液氮速冻待用。
1.1.2 试剂与仪器 兔抗人 TNF-α、IL-6 多克隆抗体购自英国 Abcam 公司;sp-9002免疫组化试剂盒(包括封闭用山羊血清、生物素、标记二抗和辣根酶标记链霉卵白素)购自北京中杉生物技术有限公司;BCA 试剂盒、ECL 发光液、PVDF 膜、SDS 凝胶配制试剂盒、RIPA 裂解液均购自福州迈新生物技术公司;石蜡切片机购自德国 Leica 公司。
1.2 方法
1.2.1 免疫组织化学染色法 手术取出翼状胬肉组织甲醛溶液固定,脱水,石蜡包埋及连续切片,厚度 4 μm,切片 65 ℃固定 6 h,取出自然冷却后依次用二甲苯和乙醇脱蜡和水化,PBS 冲洗干净后,3% 过氧化氢溶液孵育 20 min,蒸馏水清洗 5 min,PBS 润洗 5 min,浸于柠檬酸钠缓冲液置入高压水浴锅内热修复,PBS 洗 3 次,每次 5 min。滴加一抗,37 ℃孵育 30 min 后,切片 4 ℃过夜。复温、洗片后滴加二抗及辣根素标记辣根酶标记链霉卵白素孵育后滴加显色液,冲洗、苏木素复染、脱水,最后用中性树胶盖片。
1.2.2 Western blot 检测 TNF-α 和 IL-6 表达 从液氮中取出各组织,用 RIPA 裂解液在冰上裂解组织,然后收集于离心管中继续裂解 30 min,13 000 ×离心 10 min,收集上清,测定蛋白浓度,加入 4 × 上样缓冲液,煮沸 5 min,充分变性,–20 ℃保存备用。制胶:10% 分离胶 + 5% 浓缩胶,按蛋白浓度确定上样量,然后经过电泳、转膜、封闭。一抗孵育过夜,PBS 洗涤,二抗室温孵育 1.5 h,PBS 洗涤,ECL 发光液显色、显影、拍照,用 Image pro plus 软件对灰度值进行分析。
1.2.3 结果判读及统计分析 免疫组化结果以染色强度和阳性细胞数进行综合分析,TNF-α 位于细胞膜和细胞质,IL-6 位于细胞质中。TNF-α 及 IL-6 阳性表达呈黄色、棕黄色、褐色颗粒。按染色强度记分:未着色记 0 分,淡黄记 1 分,棕黄记 2分,棕褐记 3分。按着色细胞数占同类细胞总数记分:阳性细胞数≤ 5% 记 0 分,6% ~ 25% 记 1 分,26% ~ 50% 记 2 分,≥ 51% 记 3 分。根据两项积分之和判定其结果,< 3 分为阴性(–),≥ 3 分为阳性(+),≥ 4 分为弱阳性(++),≥ 6 分为强阳性(+++)。
1.3 统计学处理
用 Image-Pro Plus 6.0 软件检测吸光度值。统计学方法数据分析在 SPSS21.0 中处理,< 0.05 表示差异具有统计学意义。
2 结果
2.1 TNF-α 和 IL-6 在高原地区翼状胬肉组织中表达增强
HE 染色显示,高原地区患者翼状胬肉病变内胶原纤维排列密集,成纤维细胞增殖活跃,新生血管丰富,大量的淋巴细胞和浆细胞的浸润以及肥大细胞反应。平原地区患者翼状胬肉病变内多无定形物质的聚集。免疫化学染色法结果显示 TNF-α 表达部位见于结膜上皮细胞基底膜和胞浆,IL-6 表达部位见于结膜上皮细胞、增生的纤维组织内及血管旁炎症细胞胞浆中(图 1)。平均光密度值测定显示,IL-6 蛋白在高原组的表达(0.583 ± 0.022),显著高于平原组中的表达(0.350 ± 0.035),差异具有统计学意义(< 0.05),TNF-α 蛋白在高原组中的表达(0.553 ± 0.018),显著高于平原组中的表达(0.273 ± 0.016),差异具有统计学意义(< 0.05)。
免疫化学染色法统计分析显示,TNF-α 在平原组的阳性表达率为 58.62%,高原组阳性率为 86.21%,高原组阳性表达率显著高于平原组,差异具有统计学意义(< 0.05)。IL-6 在平原组阳性表达率为 55.12%,在高原组中的阳性表达率82.76%,高原组阳性率显著高于平原组,差异具有统计学意义(< 0.05)(表 1)。
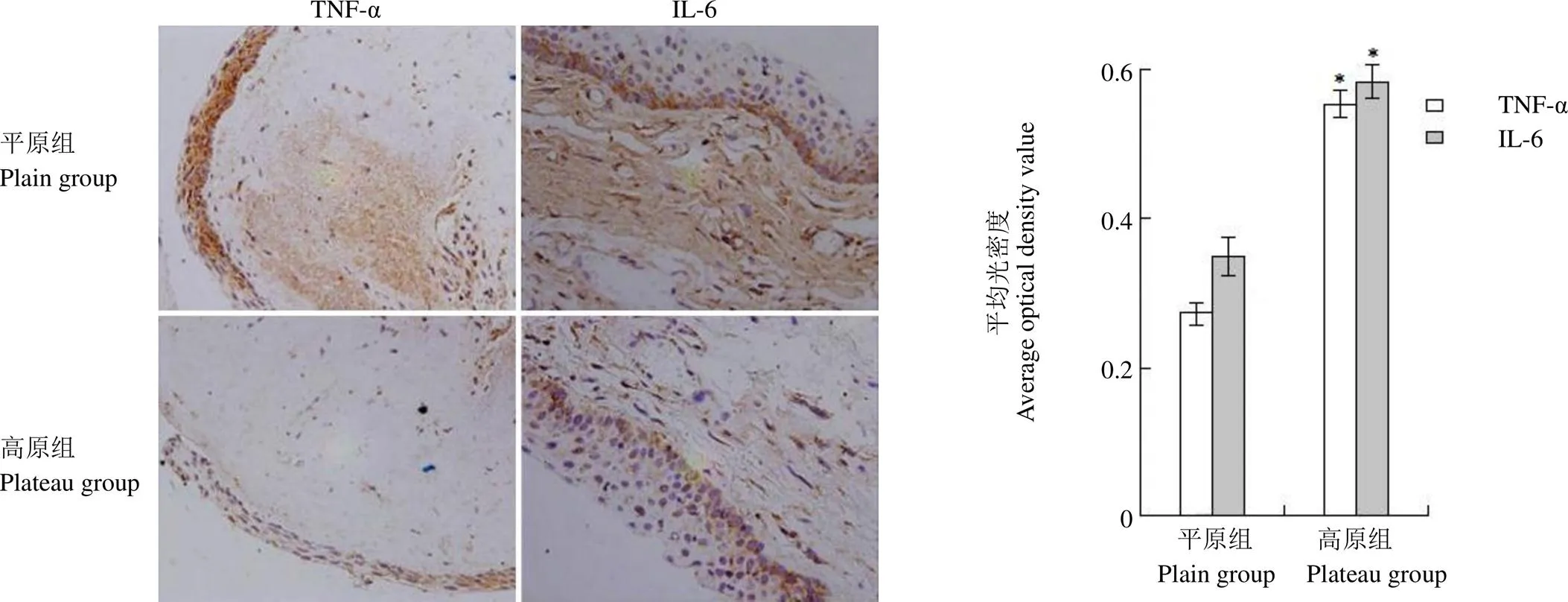
图 1 DBA 染色显示TNF-α 和 IL-6 在翼状胬肉组织中的表达(× 400,*P < 0.05)
Figure 1 Expression of TNF-α and IL-6 in pterygium tissues by DBA staining (× 400,*< 0.05)

表 1 翼状胬肉组织中TNF-α 和 IL-6 表达的统计学结果

图 2 Western blot 检测TNF-α 和 IL-6 在翼状胬肉组织中的表达(*P < 0.05)
Figure 2 Expression of TNF-α and IL-6 in pterygium tissues by Western blot
2.2 Western blot 检测 TNF-α 和 IL-6 表达
灰度值分析显示,TNF-α 和 IL-6 在平原组和高原组翼状胬肉组织均有明显的表达,且在高原组中的表达显著高于平原组,差异均具有统计学意义(< 0.05)(图 2)。
3 讨论
翼状胬肉是眼科常见的慢性炎症性病变,是一种增生性、变性疾病。最近的研究表明,翼状胬肉主要表现为纤维血管组织的大量增生,且侵袭力较强,破坏了角膜缘的结构,并侵入角膜内呈进行性生长[7]。该病在国内不同地区报道的发病率差异较大,高原地区发病率更高。高原地区紫外线明显强于平原地区,大量研究表明,紫外线的辐射在翼状胬肉发病过程中发挥着重要作用[8-9]。紫外线辐射可通过氧化应激损伤和直接的光毒性两种机制诱导各种炎症因子的表达,如 TNF-α 和 IL-6[2]。高原地区除了紫外线辐射强外,低氧也是引起翼状胬肉发生非常重要的因子,据报道,高原小鼠模型在低氧环境下,TNF-α、IL-6 升高显著[10]。可见紫外线和低氧等因子均影响着细胞 TNF-α 和 IL-6 的表达。IL-6 作为重要的炎症因子,具有促进纤维母细胞的增殖和新生血管形成的功能,而纤维母细胞的增生又能促进 IL-6 的分泌表达,形成恶性循环,促进翼状胬肉的发展,也是造成翼状胬肉复发的主要原因[11]。TNF-α 可以促进纤维细胞的大量增殖,促进纤维细胞形成胶原,参与血管的发生,也可刺激单核巨噬细胞合成 IL-1、IL-6、IL-8,从而加重炎症,在翼状胬肉的形成过程中发挥着不可忽视的作用[12]。
本研究选取了生活在海拔 3000 米以上高原地区患者翼状胬肉组织及生活在海拔 500 米地区患者翼状胬肉组织。在病理表现上,HE 染色显示高原地区患者翼状胬肉组织上皮层增厚,上皮细胞排列紊乱,细胞体积有增大趋势,上皮基底部呈不规则样改变,组织间质中新生血管数量增加,而平原地区患者翼状胬肉组织中该病理表现较高原地区不明显;其次,在炎症因子表达方面,高原地区翼状胬肉组织中 TNF-α 和 IL-6 mRNA、蛋白水平均显著高于平原地区翼状胬肉组织。这也说明,高原地区各种因子(日照、紫外线、低氧等)具有促进 TNF-α 和 IL-6 增强表达的作用,在翼状胬肉的形成中起着很重要的作用,这与前人对紫外线、低氧对 TNF-α 和 IL-6 的表达研究结果一致[2, 10, 13]。研究表明,长期受到太阳光照射环境的人群发病率较高,可能与环境中较多的致炎因子有很大关系[14]。这也可能是造成高原地区翼状胬肉组织 TNF-α 和IL-6 表达增高的原因。本实验进一步验证了 TNF-α 和 IL-6 作为重要的炎症因子在翼状胬肉发病中起着非常重要的作用。
综上所述,翼状胬肉的形成是一种多因素、多阶段的发展过程,其病理机制还未完全阐明,高原地区紫外线、低氧等因素具有促进 TNF-α 和 IL-6 表达增强的作用,在翼状胬肉的形成中起着很重要的作用,此研究为翼状胬肉的发病机制研究和临床检测及预防提供一定的理论基础。
[1] Zhang YB, Zhang XJ. Present situation and progress of pterygium treatment. Med Recapitulate, 2017, 23(6):1183-1186. (in Chinese)
张雅冰, 张晓俊. 翼状胬肉治疗的现状与进展. 医学综述, 2017, 23(6):1183-1186.
[2] Jin HY, Wang JF. Progress of research on pterygial pathogenesis. International Eye Science, 2016, 16(6):1080-1083. (in Chinese)
靳怀运, 王剑锋. 翼状胬肉发病机制研究进展. 国际眼科杂志, 2016, 16(6):1080-1083.
[3] Girolamo ND, Chui J, Coroneo MT, et al. Pathogenesis of pterygia: role of cytokines, growth factors, and matrix metalloproteinases. Prog Retin Eye Res, 2004, 23(2):195-228.
[4] Zhou WP, Zhu YF, Zhang B, et al. The role of ultraviolet radiation in the pathogenesis of pterygia (Review). Mol Med Rep, 2016, 14(1): 3-15.
[5] Liu TY, Chen YH, Zhao Q. Advances in interleukin-6 in molecular biology and livestock diseases. Heilongjiang Anim Sci Vet Med, 2018, (1):90-93. (in Chinese)
刘天宇, 陈艳红, 赵权. 白细胞介素6在分子生物学和畜禽疾病中的研究进展. 黑龙江畜牧兽医(上半月), 2018, (1):90-93.
[6] Zheng J, Zhao T, Yang QG, et al. The expression of cytokines in the pathogenesis of pterygium and their effects have been studied. ChinJ Clinicians (Electronic Ed), 2012, 6(18):5608-5611. (in Chinese)
郑姣, 赵婷, 杨庆国, 等. 细胞因子在翼状胬肉发病机制中的表达及其作用研究新进展. 中华临床医师杂志(电子版), 2012, 6(18): 5608-5611.
[7] Sun N, Zhang H. Pyroptosis in pterygium pathogenesis. Biosci Rep, 2018, 38(3):BSR20180282.
[8] Modenese A, Gobba F. Occupational exposure to solar radiation at different latitudes and pterygium: a systematic review of the last 10 years of scientific literature. Int J Environ Res Public Health, 2017, 15(1):E37.
[9] Garźon-Chavez DR, Quentin E, Harrison SL, et al. The geospatial relationship of pterygium and senile cataract with ambient solar ultraviolet in tropical Ecuador. Photochem Photobiol Sci, 2018, 17(8): 1075-1083.
[10] Pu XY, Hu FJ, Li JD, et al. Effect of hypobaric hypoxia on killing functions and secreting IL-6, TNF-α of peritoneal macrophages in mice. Chin J Immunol, 2018, 34(3):344-348. (in Chinese)
蒲小燕, 胡方杰, 李积东, 等. 高原低氧环境对小鼠巨噬细胞杀伤活性及分泌IL-6、TNF-α的影响. 中国免疫学杂志, 2018, 34(3): 344-348.
[11] Pan MM, Lü T, Zhang JC, et al. IL-1β promotes the secretion of angiogenic and inflammatory factors in human dermal fibroblast. Geriatr Health Care, 2017, 23(4):286-289. (in Chinese)
潘毛毛, 吕婷, 张洁尘, 等. 白细胞介素-1β促进人真皮成纤维细胞分祕促血管生成及炎症因子. 老年医学与保健, 2017, 23(4):286-289.
[12] Maxia C, Perra MT, Demurtas P, et al. Expression of survivin protein in pterygium and relationship with oxidative DNA damage. J Cell Mol Mede, 2008, 12(6a):2372-2380.
[13] Balci M, Sahin S, Mutlu FM, et al. Investigation of oxidative stress in pterygium tissue. Mol Vis, 2011, 17:443-447.
[14] Mauro J, Foster CS. Pterygia: pathogenesis and the role of subconjunctival bevacizumab in treatment. Semin Ophthalmol, 2009, 24(3):130-134.
Expression of TNF-α and IL-6 in pterygium tissues of plateau area
WANG Yun, BI Chun-chao, FAN Miao-miao, ZHAO Xiao-xia
To investigate the expression of TNF-α and IL-6 in pterygium of plateau area and plain area.
Immunohistochemistry and Western blot were used to detect the expression of TNF-α and IL-6 in the excised pterygium tissues of 29 patients with pterygium in plain area and 29 patients with pterygium in plateau area.
Immunohistochemical results showed that TNF-α was located in the basement membrane and cytoplasm of conjunctival epithelial cells, while IL-6 was located in the cytoplasm of conjunctival epithelial cells, proliferated fibrous tissues and perivascular inflammatory cells. The positive expression rate of TNF-α in plateau group (86.21%) was significantly higher than that in plain group (58.62%). The difference was statistically significant (< 0.05). The positive expression rate of IL-6 in plateau group (82.76%) was significantly higher than that in plain group (55.12%). The difference was statistically significant (< 0.05). The results from Western blot analysis showed that TNF-α and IL-6 were expressed in plateau and plain pterygium tissues, but increased in plateau pterygium tissues.
The expression of TNF-α and IL-6 is increased in pterygium tissues of plateau area, which may be related to the special environment of the plateau.
Pterygium; Tumor necrosis factor-alpha; Interleukin-6; Plateau area
WANG Yun, Email: wangyun2888@163.com
Author Affiliations: Ophthalmology, Xining First People's Hospital, Qinhai 810012, China (WANG Yun, FAN Miao-miao, ZHAO Xiao-xia); Ophthalmology, The Fourth Hospital of Xi'an, Shaanxi 710004, China (BI Chun-chao)
10.3969/j.issn.1673-713X.2019.06.008
西宁市科技计划项目(2017-k-08)
810012 青海,西宁市第一人民医院眼科(王赟、樊苗苗、赵晓霞);710004 陕西,西安第四医院眼科(毕春潮)
王赟,Email:wangyun2888@163.com
2019-05-07

