六味地黄丸通过调控NF-κB及TGF-β∕Smad 双信号通路减轻糖尿病肾病炎症及纤维化
陶鹏宇,张悦
(上海中医药大学基础医学院,上海 201203)
糖尿病肾病(DN)是糖尿病进展到后期出现的一种严重并发症,也是导致终末期肾病的重要原因[1]。葡萄糖代谢异常引起的肾小球毛细血管和肾小管结构功能的改变在糖尿病肾病中起重要作用[2]。糖尿病肾病以肾脏纤维化为主要形态学特征。肾小球细胞外基质生成增多并沉淀在基底膜上导致基底膜增厚、肾小球硬化和肾小管间质纤维化,会进一步加重糖尿病肾病[3]。炎症在DN中的作用受到广泛重视,核因子κB(NF-κB)炎症通路的激活可使多种促炎症因子的表达增加从而介导炎症活动,同时也引起转化生长因子(TGF)-β∕Smad通路激活促进肾脏纤维化发生,这提示炎症和纤维化在DN中相互作用,可进一步恶化病情[4]。本课题组前期研究发现,六味地黄丸可以延缓大鼠糖尿病肾病进展,保护肾脏功能,其机制可能与抑制TGF-β1-Smad信号通路相关[5]。基于此,本研究拟从NF-κB与TGF-β∕Smad双信号通路角度进一步探讨六味地黄丸在糖尿病肾病中的抗炎抗纤维化作用,现将研究结果报道如下。
1 材料与方法
1.1 动物 健康SPF级雄性SD大鼠30只,由上海斯莱克实验动物有限公司提供,动物许可证号:SCXK(沪)2017-0005。饲养于上海中医药大学实验动物中心,室内温度为25℃,自由进食普通标准饲料和饮用纯净水。
1.2 药物与试剂 六味地黄丸浓缩丸(购于北京同仁堂科技发展股份有限公司制药厂,批号:807063)。链脲佐菌素(streptozocin,STZ,购于美国Sigma公司,批号:119K1591);BCA蛋白定量试剂盒(购于碧云天生物技术有限公司);NF-κB、单核细胞趋化蛋白1(MCP-1)、alpha平滑肌抗体(α-SMA)、TGF-β、Smad2、Smad3、Smad7、甘油醛-3-磷酸脱氢酶(GAPDH)等抗体(购于美国CST公司);辣根过氧化物酶(HRP)标记的山羊抗兔Ⅱ抗,HRP标记的山羊抗小鼠Ⅱ抗(购于晶美生物工程有限公司);PVDF膜(购于美国Millipore公司)。
1.3 仪器 强生稳步型血糖测试仪(强生中国有限公司);PowerWave XS2酶标仪(美国BioTek公司);电泳装置(美国BioRad公司);Axio Lab A1型正置显微镜(德国Zeiss公司);Fluorochem M型自动成像分析系统(美国ProteinSimple公司)。
1.4 分组、造模与给药 动物适应性喂养7 d后,随机分成正常组、模型组、中药组,每组10只。于造模前1 d禁食24 h,将STZ溶于pH 4.5的0.1 mol∕L柠檬酸盐缓冲液,避光保存,给造模大鼠(20只)按60 mg∕kg一次性腹腔注射STZ,正常组(10只)则注射等量柠檬酸盐缓冲液。造模1周后,尾静脉取血测量大鼠空腹血糖(FBG),FBG>16.7 mmol∕L为糖尿病大鼠[6]。将六味地黄丸按人与大鼠体表面积比折算成等效剂量(6.75 g·kg-1·d-1)[5]灌胃,正常组及模型组给予等量生理盐水灌胃,连续12周。
1.5 标本收集 取材前1 d撤掉饲料只保留饮用水,代谢笼收集24 h尿液并记录尿量,以100 g∕L水合氯醛腹腔注射麻醉,腹主动脉取血,离心取血清,-80℃保存;取双侧肾脏,用滤纸吸干肾表面血液后称质量,取肾脏的一部分组织浸泡于福尔马林中用于石蜡切片,取体积大小适中的肾组织包裹于锡纸中并置于液氮中,继而放入-80℃冰箱保存,用于组织匀浆以作其他生化实验用途。
1.6 观察指标及方法
1.6.1 一般情况观察 观察大鼠精神活动状态、毛发颜色和密度、食物消耗程度。
1.6.2 肾系数的测定 将大鼠麻醉后处死,迅速剖腹取两侧肾脏,用滤纸吸干肾表面血液后称质量。肾系数(w∕%)=双侧肾质量(m∕g)∕体质量(m∕kg)×100%。
1.6.3 生化指标检测 采用全自动生化仪检测各组大鼠24 h尿蛋白总量(24h-Pro)、血清肌酐(SCr)、血尿素氮(BUN)、FBG。
1.6.4 肾脏病理形态学观察 ①苏木素—伊红(HE)染色:取肾皮质,体积分数10%中性福尔马林固定,乙醇脱水,二甲苯透明,石蜡包埋,制成3 μm石蜡切片,HE染色后光镜观察。②Masson染色:脱蜡至水,bouin液60℃恒温箱固定1 h,冲洗后苏木素染色10 min,Masson复合液染色20 min,冲洗后加5%磷钼酸分化6 min;倒掉磷钼酸加入2%苯胺蓝复染7 min,2%冰醋酸分化2 min,乙醇脱水,二甲苯透明,树脂固定,然后镜下观察。
1.6.5 Western blot法检测肾组织NF-κB、MCP-1、α-SMA、TGF-β、Smad2、Smad3、Smad7蛋白的表达 取适量肾脏组织,放入含有预冷RIPA裂解缓冲液的试管中,于冰上用超声破碎仪匀浆,离心取上清,即为组织蛋白液。按照BCA蛋白定量试剂盒说明书进行定量,将各组蛋白浓度调至一致,加入loading buffer煮沸蛋白变性,结束后保存于-80℃冰箱。取出变性好的组织样品于冰上溶解、震荡、离心后上样,每孔加10 μL蛋白样品电泳,积层胶电压80 V,分离胶电压110 V,经过电泳、转膜、封闭、TBST洗涤、一抗[分别为 NF-κB、MCP-1、α-SMA、TGF-β、Smad2、Smad3、Smad7(稀释比均为1∶1 000),GAPDH(稀释比均为1∶5 000)]孵育、TBST洗涤、二抗孵育、TBST洗涤、添加显影液、机器下曝光条带等步骤。以Image J测定目的条带∕内参的灰度值比值(p)来反应蛋白表达变化。
1.7 统计方法 采用SPSS 15.0统计软件进行数据分析,数据以均数±标准差()表示,多组比较采用单因素方差分析,组间两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况观察 正常组大鼠毛色光亮,无脱发,活动自如;模型组大鼠明显瘦小,毛较粗糙,色泽黯淡,食物及水消耗较正常的多,喜静少动;经六味地黄丸治疗后,上述症状有所改善。
表1结果显示:与正常组比较,模型组体质量减少,食量、饮水量、尿量及肾系数增加(均P<0.05);与模型组比较,中药组体质量增加,食量、饮水量、尿量及肾系数减少(均P<0.05)。
2.2 各组大鼠血糖及肾功能比较 表2结果显示:与正常组比较,模型组大鼠FBG、SCr、BUN及24h-Pro显著提高(P<0.01);经六味地黄丸干预治疗后,上述指标均有所改善(P<0.05)。
表1 各组大鼠体质量、食量、饮水量、尿量及肾系数变化Table 1 Comparison of the changes of body mass,consumption of food and water,output of urine and rend coefficient in various groups ()

表1 各组大鼠体质量、食量、饮水量、尿量及肾系数变化Table 1 Comparison of the changes of body mass,consumption of food and water,output of urine and rend coefficient in various groups ()
①P<0.05,与正常组比较;②P<0.05,与模型组比较
分组正常组模型组中药组肾系数(w∕%)5.60±1.23 15.67±3.31①12.88± 2.71①②N 10 10 10体质量(m∕g)478.34±11.81 325.61±10.32①366.47± 12.33①②24 h食物(m∕g)28.06±8.23 75.66±11.89①53.24± 9.07①②24 h饮水(V∕mL)45.12±15.03 216.75±36.89①150.35± 20.01①②24 h尿量(V∕mL)15±6.01 57±25.34①32± 20.01①②
表2 各组大鼠血糖及肾功能比较Table 2 Comparison of the changes of FBG and renal function in various groups ()

表2 各组大鼠血糖及肾功能比较Table 2 Comparison of the changes of FBG and renal function in various groups ()
①P<0.01,与正常组比较;②P<0.05,与模型组比较
分组正常组模型组中药组24h-Pro[ρ∕(mg·L-1)]5.6±3.5 80.7±20.3①63.2± 13.4①②N 10 10 10 FBG[c∕(mmol·L-1)]4.5±0.68 26.8±7.55①18.7± 5.66①②SCr[c∕(μmol·L-1)]16.2±1.43 28.9±7.92①21.4± 5.78①②BUN[c∕(mmol·L-1)]4.8±0.71 16.3±4.26①8.3± 2.40①②
2.3 各组大鼠肾脏病理形态学改变 HE染色结果显示:正常组肾组织形态正常,小球形态规则,无炎症细胞浸润,肾小管上皮细胞形态正常;模型组大鼠肾小球体积增大、结节样硬化,系膜基质增生;中药组大鼠肾小球形态基本正常,系膜基质轻度增生,病变明显轻于模型组。Msson染色结果显示:正常组无明显改变,各部分排列整齐;模型组肾小球部分体积变大兼纤维组织生成增多,间质增宽,球囊粘连;经六味地黄丸治疗后,纤维化程度较模型组减轻,炎症细胞浸润减少。
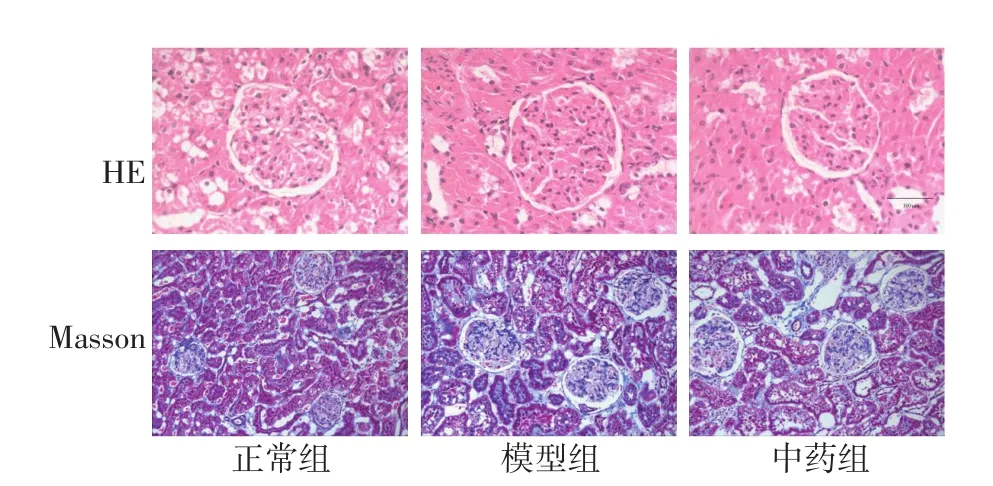
图1 各组肾脏组织病理形态学改变(HE,×400;Masson,×200)Figure 1 Comparison of the pathomorphologic changes of renal tissues in various groups(by HE staining,×400;by Masson staining,×200)
2.4 六味地黄丸对NF-κB、MCP-1蛋白表达的影响 图2、表3结果显示:与正常组比较,模型组中NF-κB、MCP-1表达水平均升高(P <0.01);经六味地黄丸治疗后,NF-κB、MCP-1表达水平均有所下降(P<0.05)。
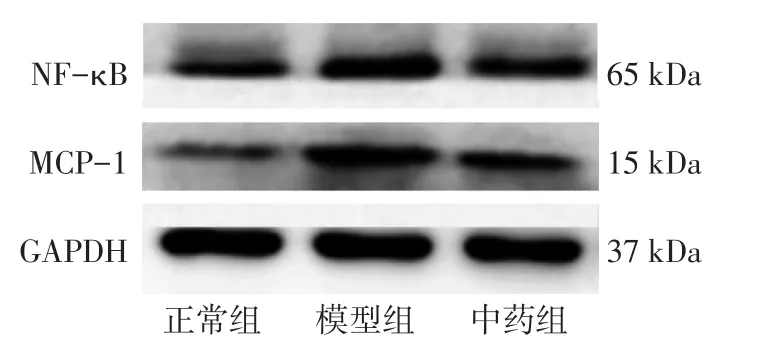
图2 NF-κB、MCP-1蛋白电泳条带Figure 2 Electrophoresis strips of NF-κB and MCP-1 proteins
表3 各组肾组织NF-κB、MCP-1蛋白表达比较Table 3 Comparison of the expression levels of NF-κB and MCP-1 proteins in renal tissues of various groups (,p)

表3 各组肾组织NF-κB、MCP-1蛋白表达比较Table 3 Comparison of the expression levels of NF-κB and MCP-1 proteins in renal tissues of various groups (,p)
①P<0.01,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组中药组MCP-1∕GAPDH 0.17±0.02 0.76±0.08①0.47± 0.02①②N 10 10 10 NF-κB∕GAPDH 0.21±0.04 0.88±0.10①0.54± 0.30①②
2.5 六味地黄丸对TGF-β、α-SMA、Smad2、Smad3、Smad7蛋白表达的影响 图3、表4结果显示:与正常组比较,模型组中的TGF-β、α-SMA、Smad2、Smad3表达升高,而Smad7表达下降(均P<0.01);经六味地黄丸治疗后,TGF-β、α-SMA、Smad2、Smad3表达下降,而Smad7表达上升(均P < 0.05)。
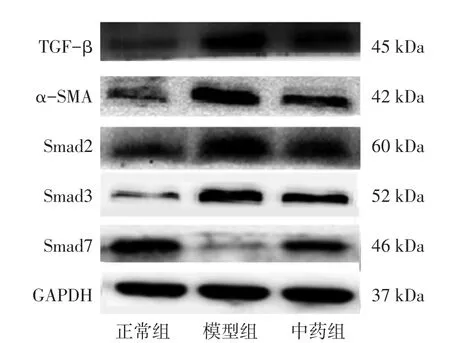
图3TGF-β、α-SMA、Smad2、Smad3、Smad7蛋白电泳条带Figure 3 Electrophoresis strips of TGF-β,α-SMA,Smad2,Smad3 and Smad7 proteins in various groups
表4 各组TGF-β、α-SMA、Smad2、Smad3、Smad7蛋白表达比较Table 4 Comparison of the expression levels of TGF-β,α-SMA,Smad2,Smad3 and Smad7 proteins in renal tissues of various groups (,p)

表4 各组TGF-β、α-SMA、Smad2、Smad3、Smad7蛋白表达比较Table 4 Comparison of the expression levels of TGF-β,α-SMA,Smad2,Smad3 and Smad7 proteins in renal tissues of various groups (,p)
①P<0.01,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组中药组Smad7∕GAPDH 0.78±0.29 0.17± 0.17①②0.49± 0.34①②N 10 10 10 TGF-β∕GAPDH 0.17±0.11 0.89±0.67①0.51± 0.44①②α-SMA∕GAPDH 0.18±0.21 0.91±0.75①0.62± 0.56①②Smad2∕GAPDH 0.26±0.22 0.90±0.57①0.54± 0.34①②Smad3∕GAPDH 0.14±0.12 0.85± 0.45①②0.56± 0.23①②
3 讨论
糖尿病肾病(DN)是1型或2型糖尿病患者的主要并发症,也是终末期肾功能衰竭的主要原因之一[1]。DN临床病理特征是微量白蛋白尿、细胞外基质(ECM)蛋白过度积聚、基底膜增厚,最终导致肾功能衰竭[2]。
纤维化是在机体受到损伤时为维持原组织结构和功能的完整性而对伤口进行修复和愈合的一个过程,α-SMA是成肌纤维细胞的标记物[7]。有研究表明,炎症在糖尿病肾病纤维化中起着重要作用,炎症细胞如中性粒细胞、巨噬细胞及淋巴细胞等对肾小球和肾小管间质浸润[8]。NF-κB信号通路是介导DN发展过程中肾脏炎症的重要组成部分。通过激活NF-κB信号通路,导致一系列促炎症因子如肿瘤坏死因子α(TNF-α),白细胞介素(interleukin,IL)-1、IL-6、IL-8活化进入到肾脏部位刺激诱导肾小管上皮细胞表型转变为间充质细胞产生大量ECM蛋白,积聚并沉积在肾间质促进肾纤维化形成[9]。单核细胞趋化蛋白-1(MCP-1)是趋化性细胞因子家族中的重要成员之一,肾间质损伤时肾小管上皮细胞会产生大量的MCP-1,其在肾小球硬化、肾间质炎症损伤、肾间质纤维化中起关键作用[10]。Vielhauer等[11]在UUO鼠中发现MCP-1在肾小管上皮细胞及间质细胞大量表达,MCP-1可通过对单核∕巨噬细胞的趋化引发间质炎症。因此,通过抑制炎症反应具有抑制进行性肾纤维化潜在治疗靶点的作用。
TGF-β在临床肾脏纤维化疾病及实验动物模型中均存在着高表达,提示TGF-β在肾脏纤维化的发病机制中起着重要的调控作用[2,3]。TGF-β刺激ECM生成的同时又抑制其降解,促肾纤维化形成。此外,TGF-β1亦可通过上皮—间质转化(EMT)这一机制诱导肾小管上皮细胞转化成肌成纤维细胞来介导肾纤维化[12]。TGF-β是DN肾纤维化的重要介质,研究报道提示TGF-β可能通过Smad信号通路发挥其作用[13]。在糖尿病条件下,某些细胞因子通过激活TGF-β∕Smad信号通路,刺激胶原蛋白基质沉积并促进肾小管间质和肾小球纤维化[14]。而有研究报道,使用TGF-β受体抑制剂虽然可以抑制TGF-β的活性并在一些糖尿病肾病动物模型中可以改善肾小球硬化,但是仅仅抑制TGF-β可能会带来一些负面效应,如刺激肾脏炎症反应[15]。因此,有必要寻求一种抑制TGF-β兼控制炎症损伤的方法。
中医药在我国有着广泛用于糖尿病治疗的历史,并被公认为传统医学的有效补充。糖尿病属于中医的“消渴”范畴,其发病机制为虚火上炎,灼伤阴液,下损肾水,导致肾阴亏虚[16]。六味地黄丸出自《小儿药证直诀》,具有滋阴补肾功效,对临床治疗糖尿病具有辅助效果[17]。本研究以STZ诱导的DN大鼠模型为研究对象,观察六味地黄丸的治疗效果,结果发现六味地黄丸可降低DN大鼠血糖,减少尿白蛋白排泄,改善体质量,减少多饮多食症状,降低SCr并缓解肾小球系膜基质扩张和肾小球基底增厚。表明六味地黄丸具有显著的肾保护作用。
本研究结果亦显示,模型组中TGF-β、α-SMA、Smad2、Smad3表达明显上调,而Smad7受到抑制,而中药组TGF-β、α-SMA、Smad2、Smad3表达受到抑制,Smad7的表达增加,表明六味地黄丸可能通过抑制TGF-β∕Smad通路从而抑制肾纤维化的进程。另外,前面所述抑制TGF-β介导的纤维化同时也会刺激炎症反应,本研究结果显示,模型组NF-κB、MCP-1表达明显上调,而六味地黄丸治疗可有效地降低NF-κB、MCP-1表达,提示六味地黄丸可以降低相关炎症因子表达,抑制NF-κB信号通路,减轻肾脏炎症。那么,推测六味地黄丸的抗炎作用或许是缓解肾脏纤维化的另一个重要机制。
综上所述,六味地黄丸可抑制糖尿病肾病的肾纤维化、减轻肾脏炎症损伤,其机制可能与抑制NF-κB和TGF-β∕Smad双信号通路有关。

