水质中大肠杆菌荧光定量PCR检测方法的建立及应用
楼秋雯 陈为为 黄志广 安紫珲 朱振洪
摘 要:[目的]建立迅速、特异的水质中大肠杆菌群荧光定量PCR检测方法。[方法]根据Genbank中大肠杆菌保守的uida基因序列,设计特异性引物,扩增并构建重组质粒作为标准品。同时设计荧光定量PCR引物,优化荧光定量PCR定量反应体系,建立水质中大肠杆菌的绝对定量方法。[结果]成功地构建了含uida基因的重组质粒,利用标准质粒为参照,分别对不同来源的水质进行检测,成功检出每微升水质中大肠杆菌的基因拷贝数,且方法具有特异性好、重复性高的特点。[结论]初步建立水质中大肠杆菌的荧光定量PCR检测方法,可为饮用水中大肠杆菌迅速检测,包括污染源头诊断的标准方法的确立提供依据。
关键词:水质;大肠杆菌;荧光定量PCR;检测方法
中图分类号:TV697.3 文献标志码:A 文章编号:2095-2945(2019)35-0118-04
Abstract: Objective: To establish a rapid and specific fluorescence quantitative PCR method for the detection of Escherichia coli in water quality. Methods: According to the conserved uida gene sequence of Escherichia coli in Genbank, specific primers were designed to amplify and construct the recombinant plasmid as the standard. At the same time, the fluorescence quantitative PCR primers were designed, the fluorescence quantitative PCR quantitative reaction system was optimized, and the absolute quantitative method of Escherichia coli in water quality was established. Results: The recombinant plasmid containing uida gene was successfully constructed. Using the standard plasmid as a reference, the water quality from different sources was detected, and the gene copy number of Escherichia coli in each microliter of water quality was successfully detected. And the method has the characteristics of good specificity and high repeatability. Conclusion: The preliminary establishment of a fluorescence quantitative PCR method for the detection of Escherichia coli in drinking water can provide a basis for the rapid detection of Escherichia coli in drinking water, including the establishment of a standard method for the diagnosis of pollution sources.
Keywords: water quality; Escherichia coli; fluorescence quantitative PCR; method
大腸埃希氏菌(Escherichia coli)通常称大肠杆菌,在一定条件下可以引起人和多种动物发生胃肠道感染或尿道等多种局部组织器官感染,是人体内较为常见的食源性致病菌。近年来,因大肠杆菌污染水或食物造成人类食物中毒的例子日益增多,该污染物给饮用水水质带来了极大的安全隐患[1]。中华人民共和国国家标准《生活饮用水水质卫生规范》规定,总大肠菌群及粪大肠菌群每100mL水样中不得检出。因此,实现水质大肠杆菌的快速检测显得尤为重要。
目前,检测大肠杆菌的技术有很多,如多管发酵技术、膜过滤技术、酶联免疫分析法[2]、基因芯片技术、高效液相色谱法等,其中基因芯片技术和色谱测定能够灵敏、迅速、准确的检测,然而局限性太大且费用昂贵。随着分子生物学技术的发展,荧光定量PCR检测方法以其快速和可批量检测等优点[3],成为了基因检测的常用方法。基于目前广泛研究的基础,荧光定量PCR在大肠杆菌的快速大规模筛查中具有明显的应用优势。本研究以大肠杆菌菌群相对保守的uida基因[4]为检测靶基因,设计荧光定量PCR引物,建立实时荧光定量PCR反应体系,来检测不同水域中单位体积大肠杆菌中uida基因拷贝数,并评价荧光定量PCR方法较在水质检测中的灵敏度、特异性、重复性,为后续水质大肠杆菌的高效、便捷的检测应用打下良好的基础。
1 材料与方法
1.1 材料
1.1.1 实验材料
大肠杆菌E. coli BL21、E. coli TG1均由本实验室保存并提供。
1.1.2 试剂
pTA2载体购自上海捷瑞生物公司,基因组提取试剂盒、割胶回收试剂盒、质粒DNA小量提取试剂盒等均为上海庄盟生物科技有限公司的产品。NaCl为无锡市东昌化学试剂有限公司产品,琼脂粉、琼脂糖、蛋白胨、酵母提取物等化学试剂均购于上海泽衡生物技术有限公司。10×PCR buffer,MgSO4(50mmol/L),dNTPS(2.0mmol/L),Taq酶,50% DMSO,2×SYBR premix Ex-Taq等均购于TOYOBO公司。uida基因片段相关引物均由上海生工生物技术有限公司合成。
1.1.3 仪器
台式高速冷冻离心机(德国西格玛有限公司,Sigma 3K-15);水平电泳系统(北京市六一仪器厂,DYCP-31D);恒温培养箱(太仓精宏仪器设备有限公司,JINGHONG);恒温摇床(上海博迅实业有限公司,DSHZ-300A);电泳成像系统(上海天能科技有限公司,Tanon-2500);超净台(苏州净化设备有限公司,SW-CJ-IF);水浴锅(太仓精宏儀器有限公司,JINGHONG);荧光定量PCR仪(德国耶拿分析仪器股份公司,MiniOpticon);紫外-可见分光光度计(上海沪粤明科学仪器有限公司,TU-1900);图像分析系统(Tanon,Image master VDS)。
1.2 方法
1.2.1 大肠杆菌E.coli BL21菌基因组提取
BL21菌液培养至测到菌液吸光值为OD=0.2-0.6时,根据上海庄盟生物科技有限公司基因组提取试剂盒说明书对BL21菌进行总DNA的提取。质粒DNA提取方法参考小量质粒抽提试剂盒内说明书。提取后的质粒DNA用紫外分光光度计测定其OD260/OD280的数值。
1.2.2 PCR扩增大肠杆菌uida保守基因片段
通过GenBank查找uida基因序列,通过BLAST比对筛选出更为保守的基因片段约为800bp,设计两对PCR引物(如表1所示),采用表1中的uida-F/uida-R引物,以大肠杆菌基因组为模板,对大肠杆菌uida保守基因片段进行常规PCR反应。反应体系共计50L,ddH2O 37.5L,基因组模板1L,10×PCR buffer 5L,2mM dNTP 4L,Taq酶(5U/L) 0.5L,上下游引物各1L。扩增反应程序如下:94℃预变性3min,94℃ 1min,56℃ 30s,72℃ 1min,30个循环进行延伸;4℃保温10min。反应结束后,取5LPCR产物进行1%琼脂糖凝胶电泳,再由割胶回收试剂盒割胶回收,-20℃保存。
1.2.3 标准品重组质粒构建
将上述克隆的uida基因片段通过TA克隆方法与pTA2载体连接[5],反应体系如下:目的基因7L,pTA2载体1L,T4连接酶1L,T4连接酶buffer 1L。16℃水浴连接16h后,将uida重组质粒转化至TG1菌感受态细胞[6]中,均匀涂布到含氨苄的LB平板中,37℃培养12-16h。挑取单菌落培养过液后进行测序。抽提质粒进行1%琼脂糖凝胶电泳鉴定,所获得的重组质粒命名为pTA2-uida。
1.2.4 荧光定量PCR条件优化
荧光定量PCR引物采用表1中的quida-F1/quida-R1的引物,通过优化荧光定量PCR反应体中退火温度,退火温度选择在55~65℃范围内,以1℃作为梯度进行优化。最佳条件根据扩增曲线的Ct值和熔解曲线来判断。
1.2.5 标准曲线的建立
紫外分光光度计检测得质粒浓度为123ng/L,根据公式DNA(copies/L)=6.02×1023×DNA总量/(660×DNA长度)[7]得本次标准质粒的浓度为3×1010copies/L。用超纯水稀释30倍后再以10倍等浓度稀释,选取稀释度为10-3、10-4、10-5、10-6、10-7copies/L标准品质粒,利用优化的荧光定量PCR反应条件,同时设置阴性对照孔(以无菌水为模板)进行检测,绘制扩增曲线与熔解曲线。最后,以X轴为Ct值,Y轴为拷贝数的对数建立标准曲线。
1.2.6 灵敏度试验
以uida基因克隆转化得到的质粒DNA为模板,进行系列梯度稀释,选取5个梯度,各取3L稀释度模板来进行荧光定量PCR,确定检出下限。
1.2.7 重复性试验
3次重复性测定107copies/L、105copies/L、103copies/L高中低三个梯度质粒模板Ct值,分析梯度内的Ct值和变异系数,以此评价方法的精确度[8]。
2 结果与分析
2.1 常规PCR扩增uida保守基因电泳图鉴定
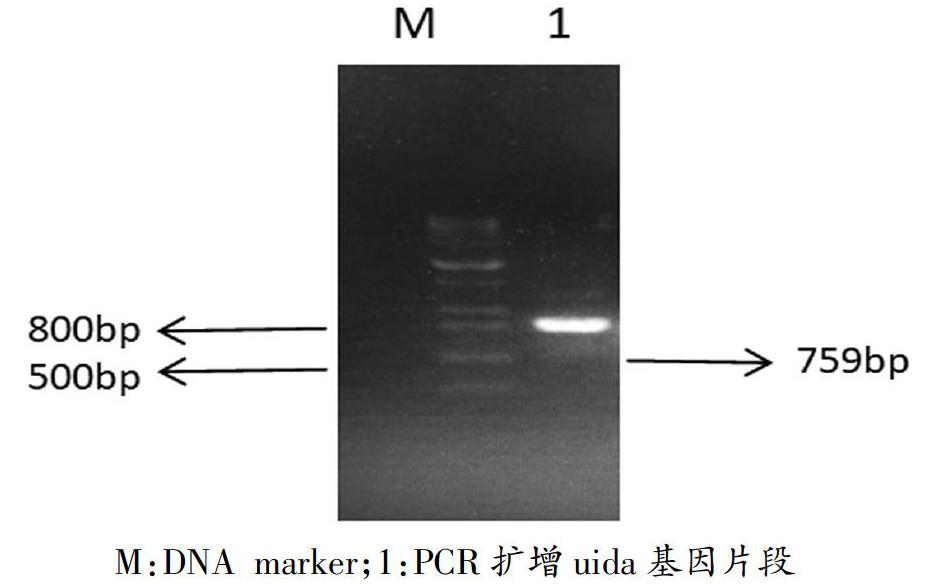
大肠杆菌uida保守基因扩增产物大小为759bp,电泳图显示目的条带与预期的大小一致(如图1所示)。
2.2 荧光定量PCR优化体系构建
系列梯度优化后的荧光定量PCR的反应体系(20L)如下,ddH2O7L,引物10.5L,引物20.5L,2×SYBR mix 10L,水样模板1L。荧光定量PCR反应程序:95℃ 2min,然后95℃ 11s,61℃ 30s,72℃ 20s,共40个循环。
2.3 标准曲线的建立
2.3.1 扩增曲线与标准曲线
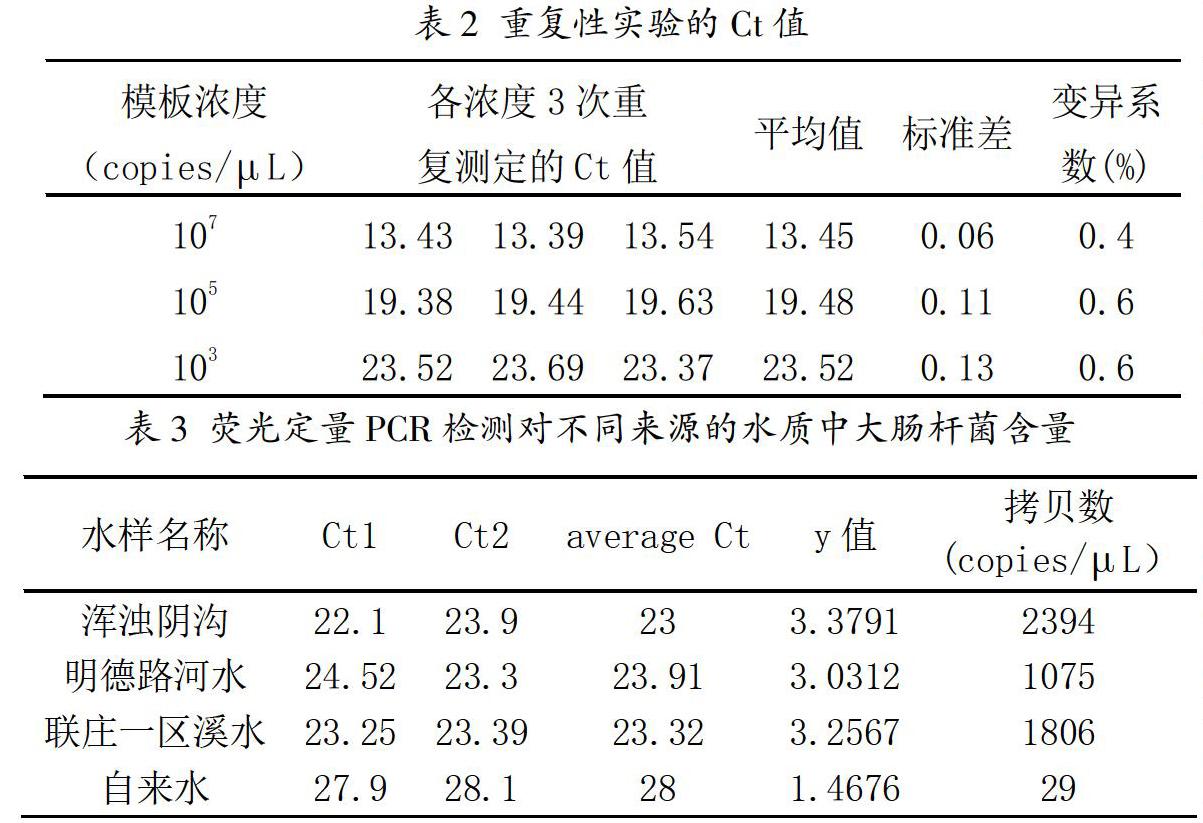
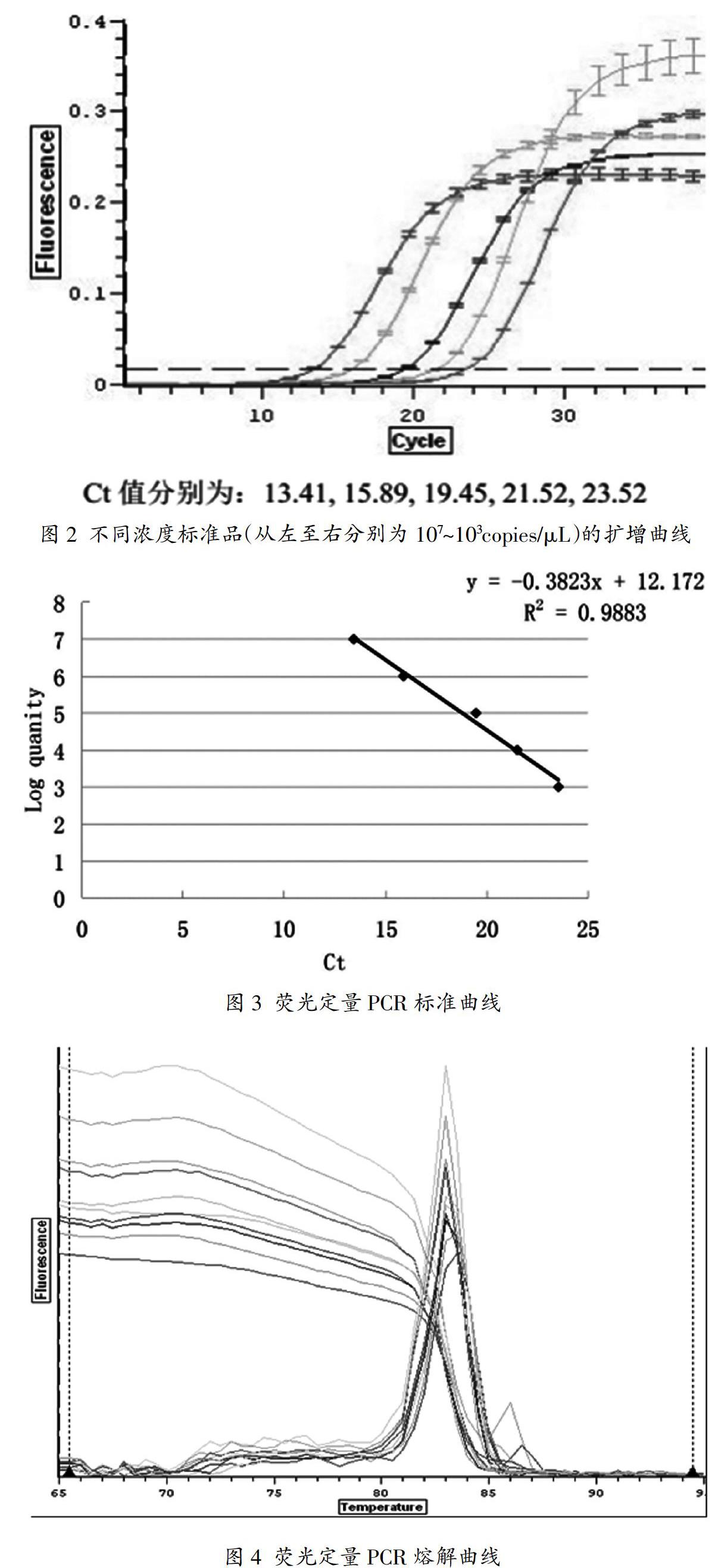
选取5个梯度(103~107copies/L)的标准重组质粒,进行荧光定量PCR检测,如图2所示,曲线呈现S型,表明Ct值与浓度存在良好的线性关系。由此,以模板浓度对数值为纵坐标,Ct值为横坐标建立荧光定量PCR检测E.coli的标准曲线(如图3所示)。曲线回归的标准方程为:Y=-0.3823X+12.172(直线斜率A=-0.3823,截距B=12.172,X=模板浓度,单位为copies/L),且曲线的相关系数R2>0.98,说明可信度较高。
2.3.2 熔解曲线
选取5个浓度的标准重组质粒荧光定量PCR检测后进一步进行熔解度曲线分析,不同浓度标准品的熔解温度均为83℃,呈单一峰,说明扩增条带特异性较高。
2.4 灵敏度试验
分析扩增曲线(如图3)可知,模板浓度低至103copies/L时,仍可观察到扩增曲线。荧光定量PCR最低可检出每微升中,103copies/L的大肠杆菌DNA。此方法的灵敏度满足对不同水样的检测要求。
2.5 重复性试验
重复性测定107copies/L、105copies/L、103copies/L高中低三个梯度质粒模板Ct值,计算平均值和变异系数(如表2所示)。可知,随浓度降低,扩增曲线的标准差逐渐增大,变异系数则始终小于1%,则说明在合理的误差范围内,建立的水质荧光定量PCR方法重复性好。
2.6 水质检测结果
以建立的荧光定量PCR方法检测水质中大肠杆菌群,将测得的Ct值带代入标准曲线,计算不同来源水质的拷贝数。结果表明,浑浊阴沟的大肠杆菌含量最高,自来水中大肠杆菌含量相对较少。
3 讨论
大肠杆菌作为粪源性污染卫生细菌学指标,在环境水质监测中起着非常重要的指示作用。若水体中检测出大肠杆菌则意味着水质已被污染[9]。分布在自然界的大肠杆菌大多数是不致病的,主要附生在人或动物的肠道里,为正常菌群,但少数的大肠杆菌具有毒性,侵入人体时,可引起感染,如腹膜炎、胆囊炎、膀胱炎及腹泻等[10]。对老人及小孩的感染可能是致命性的。因此,我国在饮用水方面的卫生标准限定100ml水样中不得检测出大肠杆菌,该标准要求必须达到检出单个细菌的水平。
目前,大肠杆菌群的固有检测方法有多管发酵技术、膜过滤技术、酶联免疫分析法等。传统的多管发酵法费时费力;膜过滤技术检测出来的误差较大;酶联免疫分析法则不具备广泛性。因此,寻求建立快速、敏感的水质大肠菌群检测方法迫在眉睫。
本研究以uida为靶基因,设计特异性引物,优化荧光定量PCR定量反应条件,建立了大肠杆菌群的荧光定量检测体系,此方法具有敏锐、迅速、特异、重复性好等优点,对不同水样的测试结果也表明此法具有较高的检测能力和效率,大大减少了时间和人工成本,检测灵敏高且精准,在饮用水工业中具有广泛的应用前景。下一步将对荧光定量PCR定量检测和传统检测方法进行比较研究,对两者相关性进行探索,为水质的快速检测提供依据。
参考文献:
[1]林庭庭,周广红.食品中大肠杆菌生物检测方法探讨[J].食品安全导刊,2019(12):84.
[2]Shih C M, Chang C L, Hsu M Y, et al. Paper-based ELISA to rapidly detect Escherichia coli [J]. Talanta, 2015,145:2-5.
[3]杨斌,邹杰,羊扬,等.产志贺毒素大肠杆菌检测技术研究进展[J].中国预防兽医学报,2019,41(02):209-213.
[4]陈樑,等.水环境中大肠杆菌PCR快速检测体系的研究[J].环境科技,2010,23(2):52-54.
[5]贺添艳,刘亚娟,徐文选,等.T4DNA连接酶性质及其平端连接功能[J].河南科学,2016,34(7):1058-1062.
[6]陈思,黄昆仑,等.LacZ基因导入细胞的研究[J].农业技术生物学报,2013,26(1):201-202.
[7]趙爱兰,孟琼,白向宁,等.双重实时荧光定量PCR检测产志贺毒素大肠埃希菌stx_1和stx_2基因[J].临床检验杂志,2013,31(04):241-244.
[8]贺欣薇,胡安东,潘吉脉,等.鸭IL-1β基因实时荧光定量PCR方法的建立及初步应用[J].黑龙江畜牧兽医,2019(17):24-28.
[9]刘祥臣,张吉忠.水质的国标检测方法与快速检测方法的优缺点分析[J].黑龙江科技信息,2016(24):123.
[10]黄丽,李玲,杨攀,等.PCR法检测水牛乳中致病性大肠杆菌O157:H7的研究[J].中国乳品工业,2016,44(04):46-47+51.

