外源甜菜碱对NaCl 胁迫下紫花苜蓿种子萌发及幼苗抗性的影响
马婷燕,李彦忠,
(1. 兰州大学草地农业生态系统国家重点实验室 / 兰州大学草地农业科技学院,甘肃 兰州 730070;2. 中国农业科学院草原研究所,内蒙古 呼和浩特 010010)
有“牧草之王”美称的紫花苜蓿(Medicago sativa)是推动牧草产业发展过程中的重要牧草[1]。紫花苜蓿属于中等耐盐作物[2],盐胁迫仍会威胁苜蓿生长造成无法估量的产量损失。盐碱地土壤是世界上干旱和半干旱地区最普遍的土地资源。截至目前,全世界共有15 亿hm2耕地,约7 700 万hm2(约5%)的可耕地面积均受到不同程度土壤盐碱化的影响。在中国,盐化土壤的面积约为3 400 万hm2,约占总耕地面积的1/3[3]。土壤中适宜含量的盐分对维持植物正常生理功能方面发挥着重要作用,而过量盐分导致土壤盐渍化,使得植物根部吸水困难,植物体内与水分相关的渗透调节受到阻碍,从而导致植株组织结构出现异常,影响生长发育,进而有可能使得栽培地局部小气候失调,最终影响产量和经济效益[4]。
甜菜碱(glycine betaine, GB)是一种水溶性生物碱,无毒无害且广泛存在于动植物中,可以调节细胞渗透压以维持生物膜及蛋白质结构和功能的完整[5]。当遭受非生物胁迫例如盐碱、旱涝、高低温等逆境时,许多植物体内都会积累甜菜碱[6],但往往因为积累量不够多而发挥效用微弱。研究发现,添加适量的外源诱导剂如甜菜碱、水杨酸、2,4-表油菜素内酯等可以提高植物的抗逆性,在减少胁迫伤害促生保收方面表现良好[7-9]。幼苗期根试适宜浓度的甜菜碱可以有效缓解盐胁迫对小麦(Triticum aestivum)幼苗叶片造成的伤害,增加渗透调节物质的含量,并维持相关抗氧化酶活性,提高小麦的抗盐性[10]。此外,学者们通过施加外源甜菜碱增强棉花(Gossypiumspp.)[11]、玉米(Zea mays)[12]、大麦(Hordeum vulgare)[13]、水稻(Oryza sativa)[14]、番茄(Lycopersicon esculentum)[15]和黑果枸杞(Lyicumruthenicum)[16]等作物的耐性抗性方面取得了一些进展,主要体现在对离子吸收平衡的影响、渗透物质及生物膜透性调节、抗氧化酶活性以及光合功能的改善等。利用外源甜菜碱提高紫花苜蓿耐盐性研究方面,国内相关报道较少;同时,甜菜碱的合成工艺已非常纯熟且具有理化性质稳定,易于被植物吸收的特点[17]。为此,本研究选取在西北干旱、半干旱地区广泛栽培的‘甘农3 号’紫花苜蓿(Medicago sativa‘Gannong No. 3’)为研究材料,分析两种施用方式、6 个浓度的甜菜碱对NaCl 胁迫时紫花苜蓿种子萌发及幼苗生长的影响,旨在为利用外源甜菜碱提高紫花苜蓿抗盐性提供数据支撑。
1 材料和方法
1.1 试验材料
本研究于2019 年1 月-2 月在兰州大学草地农业科技学院开展。参试材料为‘甘农3 号’紫花苜蓿由兰州大学草地农业科技学院提供;外源甜菜碱购自Sigma 公司。
1.2 试验设计
1.2.1 处理液配置
150 mmol·L-1NaCl 溶液模拟中度盐胁迫和外源甜 菜 碱 溶 液0、10、20、30、40、50 mmol·L-1共6 个浓度,对照CK 为蒸馏水替代处理液。
1.2.2 发芽试验
采用纸上发芽法[18],在铺有两层滤纸的培养皿(直径90 mm)中同时加入4 mL 处理液[处理液为胁迫液∶缓解液(1∶1)的混合液],将选取的苜蓿种子室温下用蒸馏水浸泡40 min,消毒处理经乙醇(75%)浸泡30 s,NaClO(20%)浸泡15 min,灭菌水冲洗5~6 次,最后用滤纸将水吸干,并将种子均匀置于发芽床上,一皿50 粒,共6 个处理,每处理4 次重复,置于恒温培养箱(温度25 ℃,光照/黑暗时间为12 h/12 h,光照强度2 000 lx),每天采用称重法加补散失的水分。
1.2.3 盆栽试验
选择颗粒饱满的干净种子,播入营养土∶蛭石为2∶1 的育苗钵内(直径为 20 cm, 高度为20 cm),期间用营养液(改良版Hoagland)和蒸馏水交替浇灌。每钵留长势一致的幼苗定苗10 株,30 d 后测量株高,采用叶施和根注的方式添加外源甜菜碱,共12 个处理,每处理4 次重复,并设置清水对照CK;叶施时,先用25 mL NaCl 溶液根部灌注,再用25 mL 甜菜碱溶液保证喷施到所有叶片为准;根注时,将NaCl 溶液和甜菜碱溶液各25 mL混合均匀后用注射器注于苜蓿幼苗根部周围。于试验处理后的1、3、5 d 时喷施或浇灌相应的处理液,7 d 时采集叶片测定其生理生化指标。
1.3 测定指标及方法
1.3.1 发芽指标测定
发芽试验期间逐日统计发芽数(发芽以胚根突破种皮为准),14 d 时停止发芽依据以下公式计算发芽相关指标,测胚芽、胚根的长度及组织含水量。发芽势 = 4 d 发芽种子数/参试种子数 × 100%;发芽率 = 发芽结束时的发芽总数/参试种子数 ×100%;
相对发芽势 = (处理组发芽势/对照组发芽势) ×100%;
相对发芽率 = (处理组发芽率/对照组发芽率) ×100%; ∑
发芽指数 = Gt/Dt;
活力指数 = GI × S;相对发芽指数 = (处理组发芽指数/对照组发芽指数) × 100%;
相对活力指数 = (处理组活力指数/对照组活力指数) × 100%。
式中:Gt为在时间t 日的发芽数,Dt为萌芽日数,GI 为发芽指数, S 为14 d 时的幼苗长度。
1.3.2 盆栽试验中的株高测定
用直尺测量苜蓿幼苗茎基部到顶叶的距离作为株高,测量时确保顶叶舒展,植株直立。植株增长 = 试验结束时株高-试验开始时株高;组织含水量的测定:随机取10 株处理7 d 后的植株,将根部冲洗干净,置于滤纸上干燥,用剪刀将根、茎、叶切分,电子天平称量各组织鲜重(Wf),放于80 ℃烘箱烘干至恒重,称量各组织干重(Wd)。组织含水量 = [(Wf-Wd)/Wf] × 100%。
1.3.3 抗逆生理指标测定
采用乙醇提取法测定叶绿素含量[19],采用蒽酮比色法测定可溶性糖(soluble sugar, SS)含量[19],采用酸性茚三酮法测定游离脯氨酸(proline, Pro)含量[19],采用硫代巴比妥酸显色法测定丙二醛(malonaldehyde, MDA)含量[19]。
1.3.4 抗氧化酶活性测定
采用氮蓝四唑显色法测定超氧化物歧化酶(superoxide dismutase, SOD)[19],紫外比色法测定过氧化氢酶(catalase, CAT)活性[19],愈创木酚法测定过氧化物酶(peroxidase, POD)活性[19]。
1.4 数据分析
采用Microsoft Excel 2010 整理数据并进行图表绘制;采用SPSS 19.0 进行数据分析。对不同处理的数据选用单因素ANOVA 分析处理,Duncan’s新复极差法进行多重比较(P<0.05)。以平均值 ±标准差表示。
2 结果与分析
2.1 NaCl 胁迫下外源甜菜碱对紫花苜蓿种子萌发的影响
2.1.1 NaCl 胁迫下外源甜菜碱对苜蓿种子发芽率和发芽势的影响
NaCl 胁迫下,随外源甜菜碱浓度的增加,发芽势和发芽率呈现先升后降的趋势,其中30 mmol·L-1的甜菜碱处理下发芽势和发芽率最高,分别为86.50%和96.50%,分别是仅有NaCl 胁迫处理的2.01 倍和1.82 倍(表1)。结果表明,施加适宜浓度的甜菜碱可有效缓解NaCl 对苜蓿种子萌发的抑制作用,低于或高于此浓度,缓解作用都会降低。
2.1.2 NaCl 胁迫下外源甜菜碱对苜蓿种子发芽指数和活力指数的影响
NaCl 胁迫时,发芽指数和活力指数随外源甜菜碱浓度的增加呈先升后降的趋势。当外源甜菜碱在30 mmol·L-1时发芽指数最高,在40 mmol·L-1处理时活力指数最高,分别18.02%和96.26%,是仅有NaCl 胁迫处理的1.73 倍和3.27 倍(表2)。
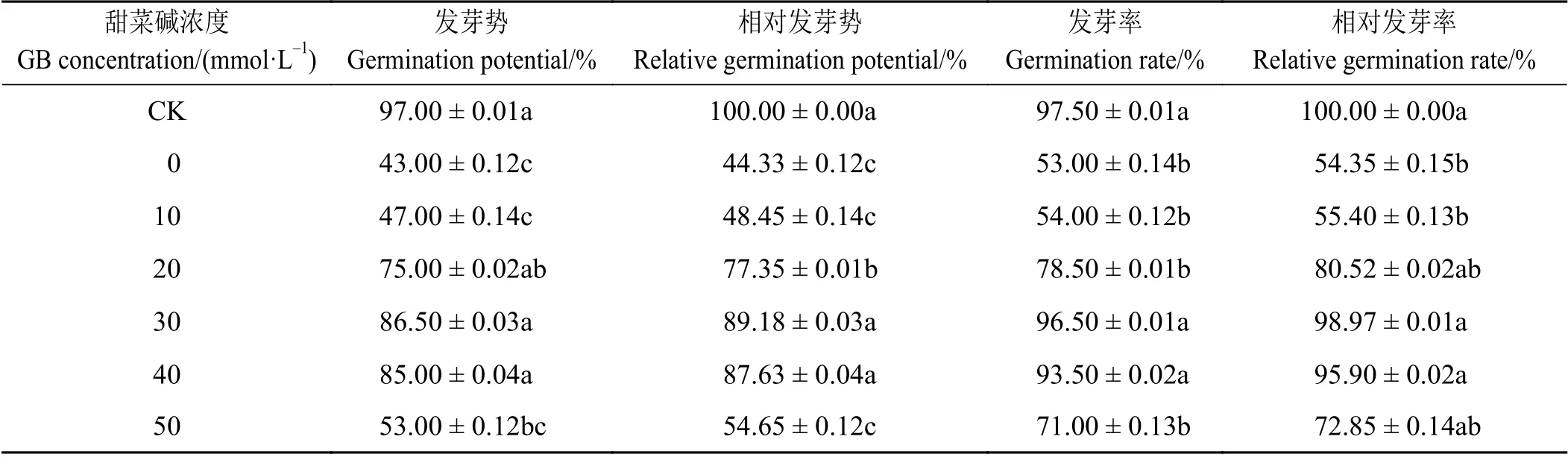
表 1 NaCl 胁迫下施加外源甜菜碱对苜蓿种子发芽势和发芽率的影响Table 1 Effects of exogenous glycine betaine on germination potential and germination percentage of alfalfa seeds under NaCl stress
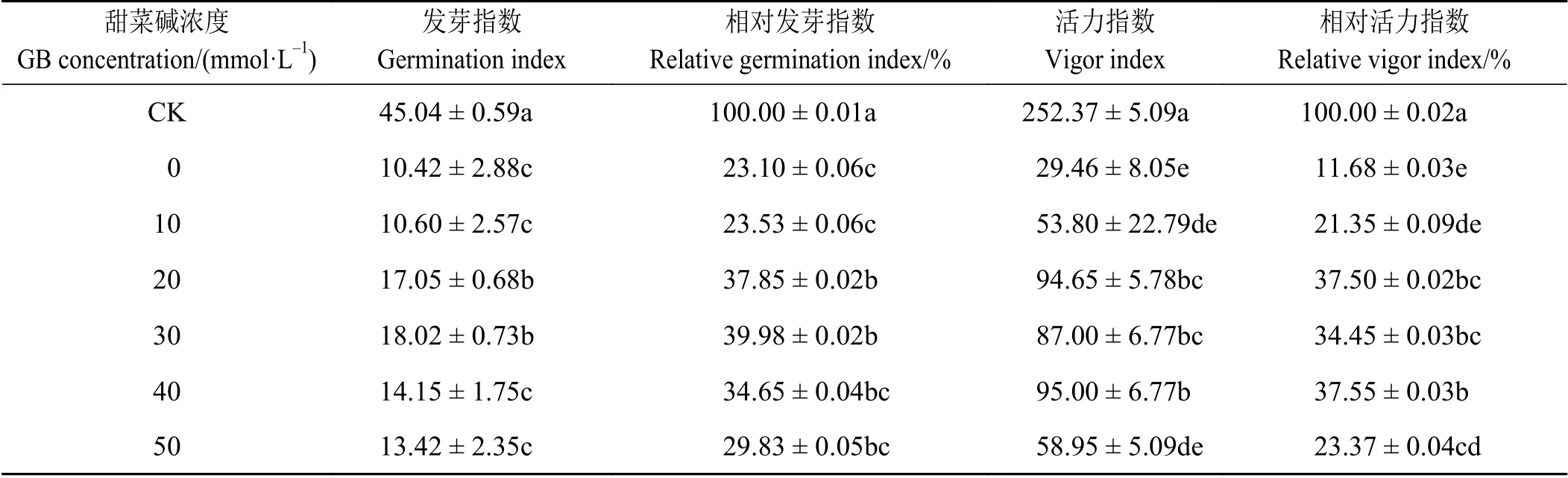
表 2 NaCl 胁迫下外源甜菜碱对苜蓿种子发芽指数、活力指数的影响Table 2 Effects of exogenous glycine betaine on germination index and vigor index of alfalfa seeds under NaCl stress
2.1.3 NaCl 胁迫下外源甜菜碱对苜蓿种子胚根与胚芽生长的影响
在NaCl 胁迫下,当外源甜菜碱施加50 mmol·L-1时苗长最大,施加40 mmol·L-1时根长最大,分别为1.40 和5.51 cm,是仅有NaCl 胁迫处理的1.73 倍和3.04 倍(表3)。
2.2 NaCl 胁迫下外源甜菜碱对盆栽苜蓿幼苗生长的影响
与CK 相比,当NaCl 胁迫时苜蓿幼苗的株高显著降低,外源甜菜碱在20~40 mmol·L-1范围内株高明显增大,当叶面喷施30 mmol·L-1的甜菜碱时株高最大;当根部灌注40 mmol·L-1的甜菜碱时株高最大,二者株高均大于CK (P<0.05),且叶施效果要优于根注效果(图1)。这在一定程度上可以说明,施加外源甜菜碱不仅可以缓解NaCl 的胁迫作用,浓度适宜时还可以促进苜蓿幼苗的生长。
与CK 相比,盆栽苜蓿幼苗经NaCl 胁迫组织含水量显著下降( P<0.05),施加甜菜碱后幼苗含水量开始升高。叶施和根注甜菜碱都在30 mmol·L-1时含水量达最大,但仍小于CK (P<0.05)。这说明在NaCl 胁迫时,添加甜菜碱可以改善紫花苜蓿幼苗代谢,增强组织储水能力。
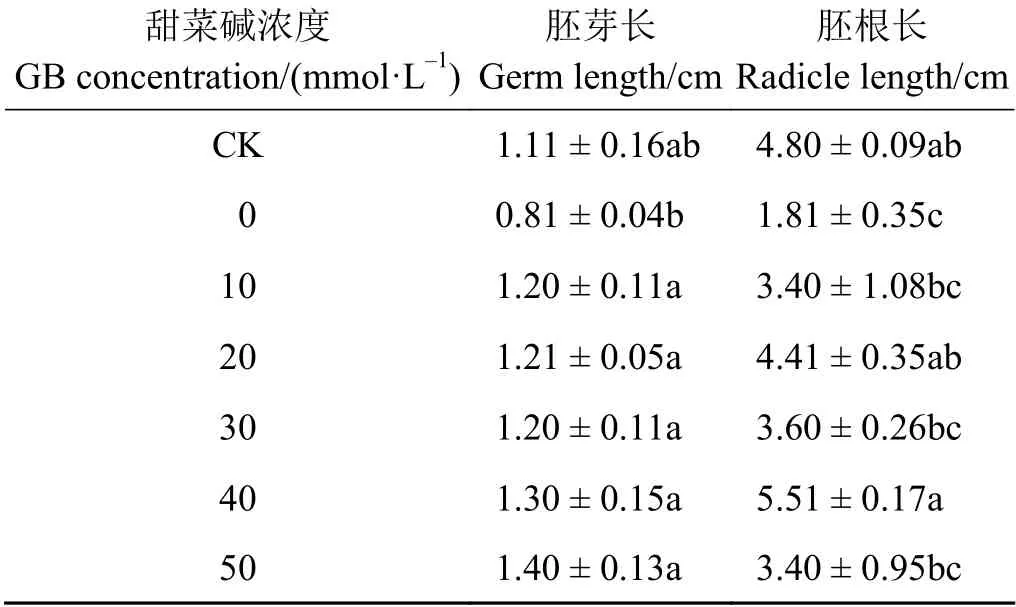
表 3 NaCl 胁迫下施加外源甜菜碱对苜蓿种子胚根与胚芽生长的影响Table 3 Effects of exogenous glycine betaine on the growth of root and germ of alfalfa seeds under NaCl stress
与CK 相比,在NaCl 胁迫下幼苗的叶绿素量开始下降,当施加甜菜碱后叶绿素含量有所回升。当叶施甜菜碱30 mmol·L-1和根注甜菜碱40 mmol·L-1都使叶绿素含量达到最大。这表明,施用一定浓度的甜菜碱能显著增加叶绿素含量以改善苜蓿幼苗受到NaCl 胁迫时的光合作用条件,提高光合效率,增强植株对高盐度环境的适应。
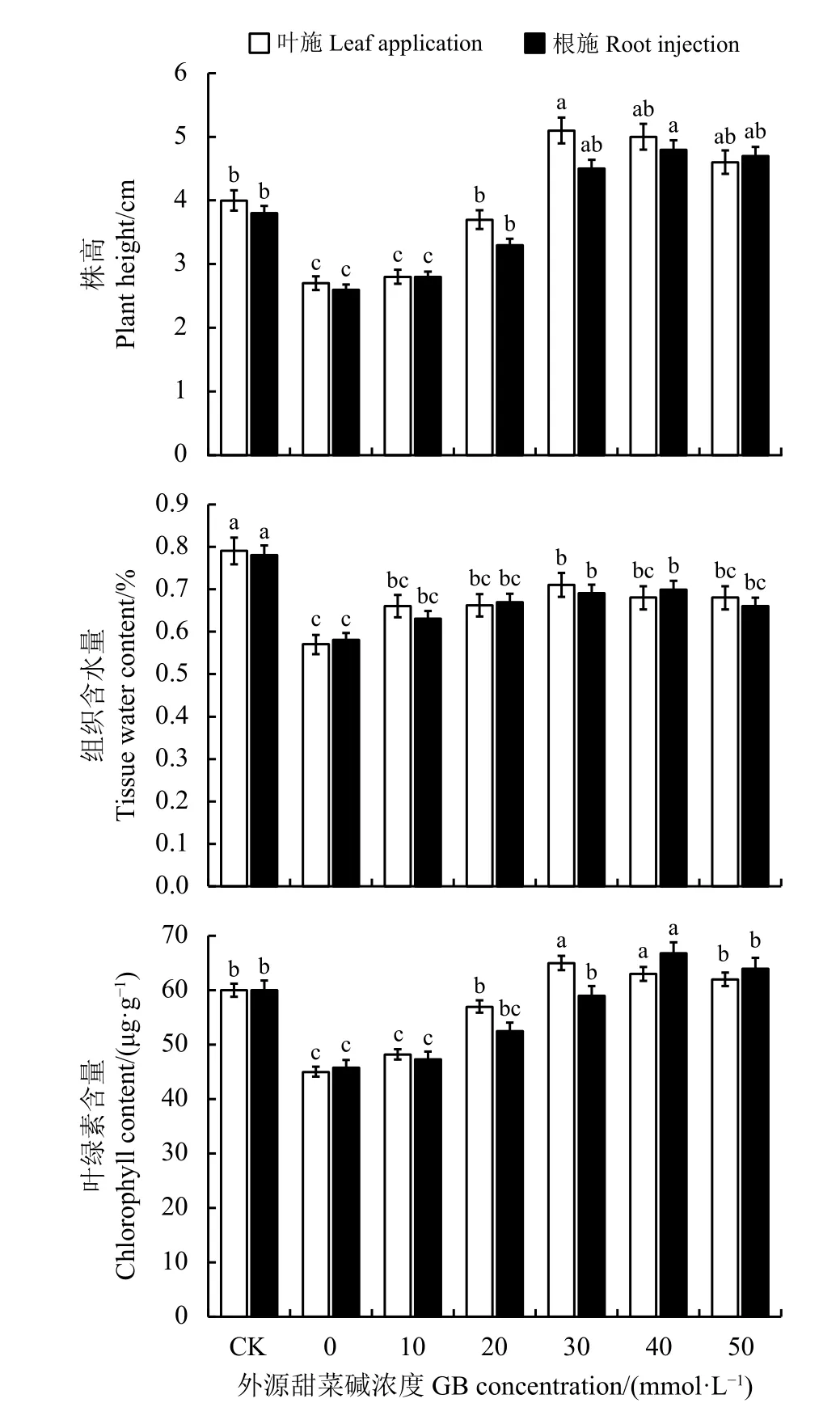
图 1 外源甜菜碱对NaCl 胁迫下苜蓿幼苗株高、组织含水量、叶绿素含量的影响Figure 1 Effects of exogenous glycine betaine on plant height,tissue water content, and chlorophyll content of alfalfa seedlings under NaCl stress
2.3 NaCl 胁迫下外源甜菜碱对苜蓿幼苗渗透调节物质及丙二醛含量的影响
在逆境条件下,可溶性糖(SS)会积累增加来调节细胞的渗透性从而维持植物的生长发育。CK 处理下,SS 含量处于正常水平,而幼苗受到NaCl 胁迫时,SS 含量明显增加,可降低植物细胞渗透势,使植株尽可能维持正常的生长代谢水平,平安度过胁迫期。随着外源甜菜碱浓度的施加,幼苗的SS 含量逐渐上升,当叶施和根注浓度分别在30、40 mmol·L-1时,显著高于CK (P<0.05)(图2)。
游离脯氨酸(Pro)作为一类高效的有机渗透调节物质,在逆境条件下会在植物体内大量累积而维持植物的生长发育水平。与CK 相比,当幼苗受到NaCl 胁迫时Pro 含量开始增大,随着甜菜碱浓度的增加,Pro 含量也呈增大的趋势,其中当叶施和 根 施 甜 菜 碱 分 别 在30 和40 mmol·L-1时,Pro 含量最大,且与其他处理差异显著(P<0.05) (图2)。
逆境胁迫条件下膜脂过氧化作用产生对细胞膜有害的MDA,其含量的多少与植物细胞膜受伤害程度正相关。与CK 相比,当植株受到NaCl 胁迫时,MDA 含量大幅度增大,随着甜菜碱的施用,MDA 含量略有下降,当叶施和根施分别在30 和40 mmol·L-1时,MDA含量下降到最低(图2)。说明适宜浓度的甜菜碱有效降低苜蓿幼苗细胞膜的受损程度。
2.4 NaCl 胁迫下外源甜菜碱对苜蓿幼苗抗氧化酶活性的影响
与CK 相比,当植株受到NaCl 胁迫时,植物细胞内自由基的平衡遭到破坏,不断加剧细胞膜的过氧化最终导致植物受到损伤。苜蓿叶片的3 种抗氧化酶的活性都大幅度提升,而两种方式施加不同浓度的甜菜碱使SOD、POD、CAT 的活性均维持在较高水平,且都随甜菜碱浓度增加呈现出先上升后下降趋势,当叶施为30 mmol·L-1时与根注为40 mmol·L-1时,活性均达到最大,与CK 相比差异显著(P<0.05) (图3)。这说明,苜蓿幼苗在受到盐胁迫时,抗氧化酶系统受到刺激活性增加,而施加适宜浓度的甜菜碱可以维持正常的抗氧化酶活性水平,维持植株的抗逆能力。
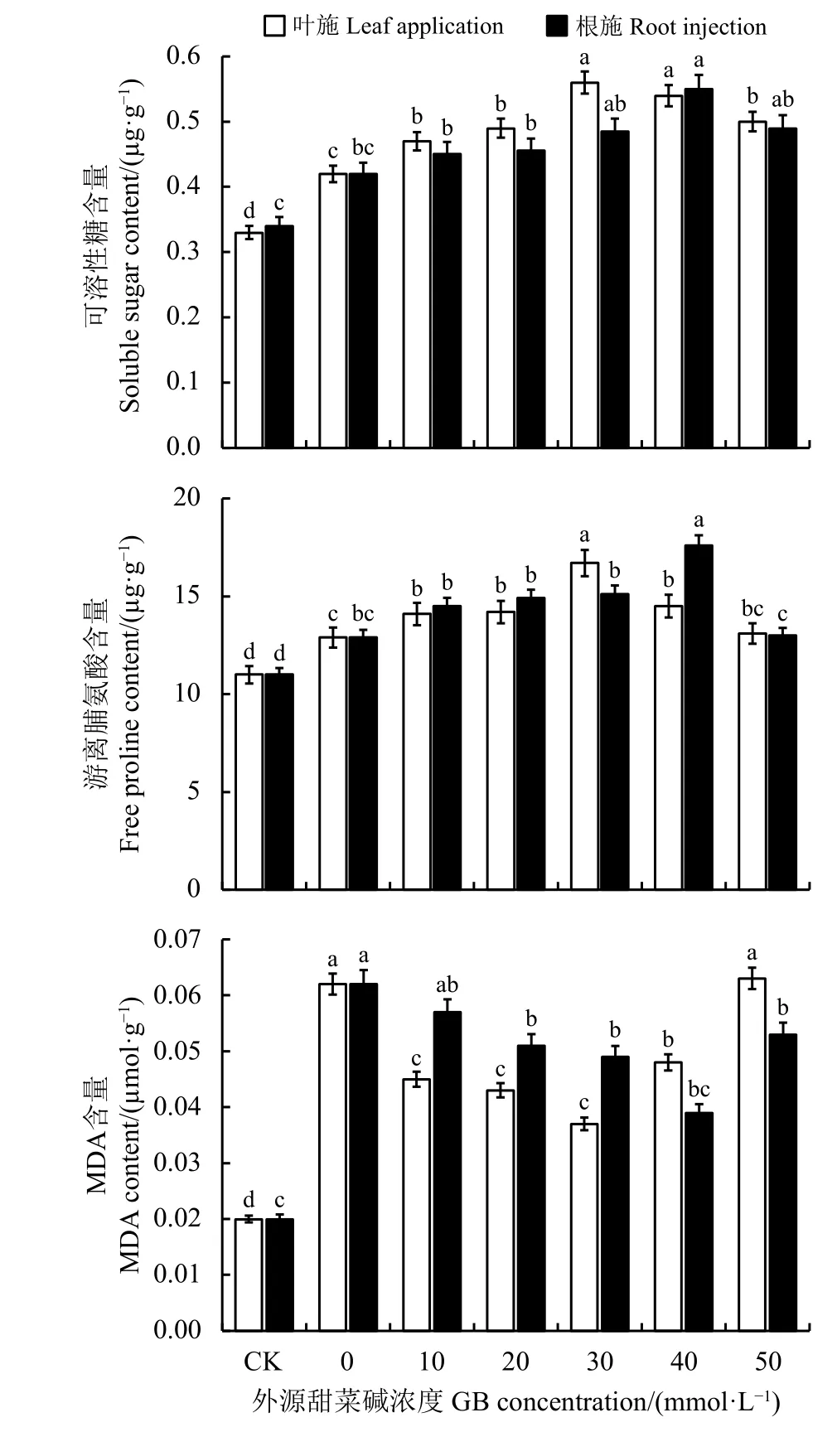
图 2 外源甜菜碱对NaCl 胁迫下苜蓿幼苗SS、Pro 及MDA 含量的影响Figure 2 Effects of exogenous glycine betaine on SS, Pro, and MDA contents of alfalfa seedlings under NaCl stress
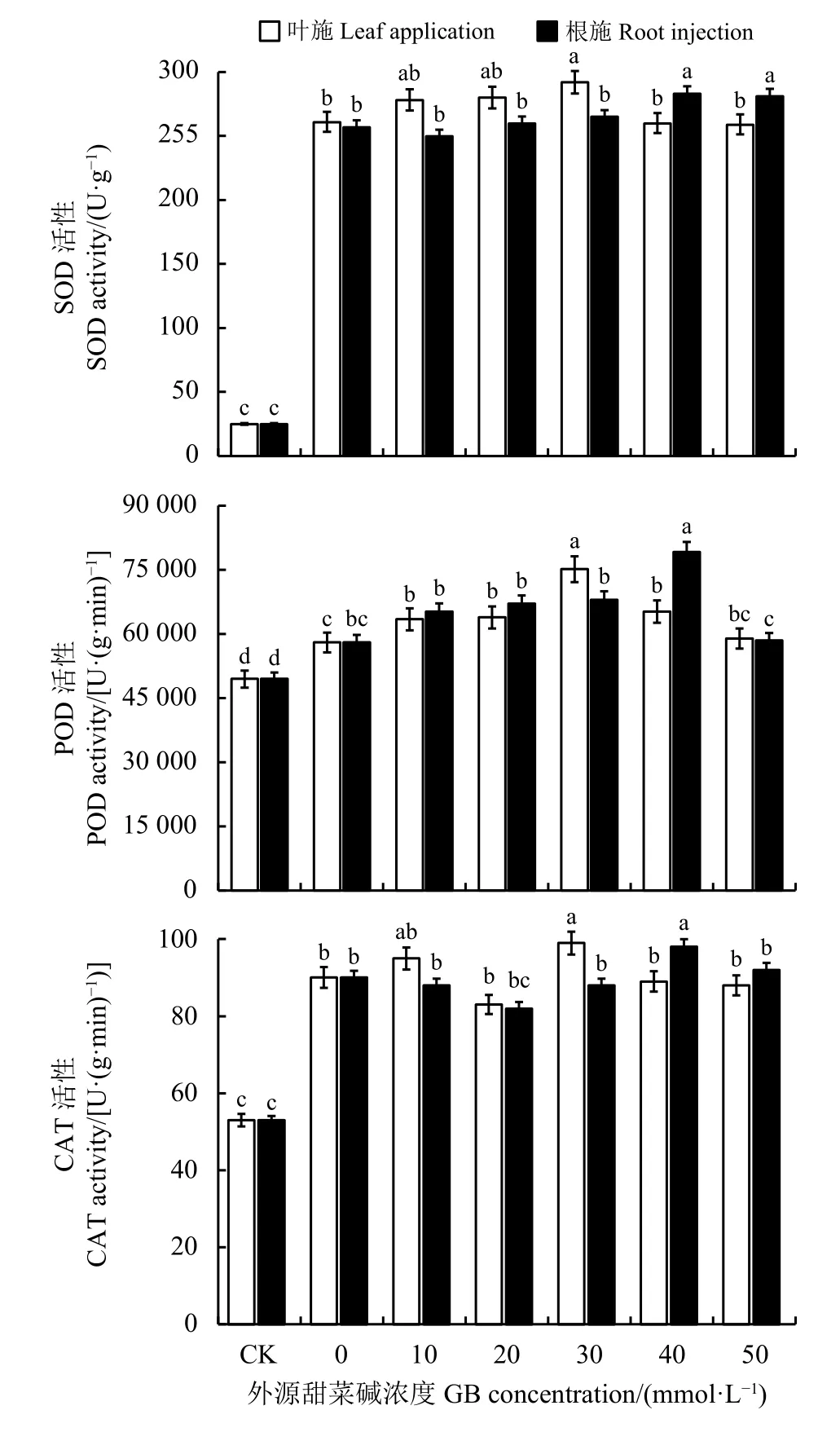
图 3 外源甜菜碱对NaCl 胁迫下苜蓿幼苗抗氧化酶活性的影响Figure 3 Effects of exogenous glycine betaine on antioxidant enzyme activity of alfalfa seedlings under NaCl stress
3 讨论与结论
西北地区土壤普遍盐碱化,而盐分胁迫主要通过渗透胁迫损害植物细胞膜,造成氧化胁迫以及蛋白质合成受阻等抑制植物的萌发及生长发育。孟繁昊等[20]表明,植物耐盐性主要依赖于渗透调节保护膜完整性与稳定性、改变光合效率及完成活性氧清除。本研究中,NaCl 胁迫明显抑制了苜蓿的种子萌发和幼苗生长,相比对照组,盐胁迫下发芽势和发芽率、发芽指数和活力指数都显著下降,幼苗则表现为组织含水量、叶绿素含量、可溶性糖含量、游离脯氨酸含量均有显著降低,MDA 急剧升高,SOD、POD 及CAT 的活性明显增强来响应盐胁迫环境。
关于对甜菜碱提高植物抵抗环境胁迫的研究已有 许 多[5,7,21-22]。起 初,学 者 们[5,22-23]发 现 植 物 体 内产生的甜菜碱对于调控植物抗盐抗旱等不良环境方面发挥着关键作用。然而在生产实践中,并非所有种类的植物在受到环境胁迫时都能产生并积累足够量的甜菜碱[24-26]。后来研究者们针对添加外源甜菜碱和甜菜碱合成基因工程在提高植株抗逆能力方面进行了长期且深入的研究[22,27-28]。一些研究表明[29-32],盐、低温、干旱等非生物胁迫可诱导内源甜菜碱的合成与积累量增加以增强抗逆水平;董文科等[29]研究表明,通过叶施或根施外源甜菜碱也可诱导植物增加内源甜菜碱的合成量,对于植物抵御低温等非生物胁迫也有帮助。梁超[33]通过转基因方式将BADH 基因导入小麦(Triticum aestivum),在小麦中表达而使叶片中甜菜碱过量积累,提高叶片相对含水量,维持叶片的水分状况,并增加叶绿素含量,光合效率得以提高从而增强了小麦的耐盐能力。孙文越等[34]研究了外源甜菜碱对干旱胁迫下小麦生理变化影响,发现外源甜菜碱可以使小麦叶片含水量降低,相对电导率增大,MDA 含量上升,游离脯氨酸大量积累,抗氧化酶活性先降后增,得出外施甜菜碱会加深对小麦幼苗受伤害程度的结论。这与许多学者的研究结果相悖,推测可能是因为外源甜菜碱被小麦的吸收太少得出此结果。这些研究可以说明,甜菜碱吸收及积累量的增加有助于增强植物在抵御逆境胁迫的能力,抵御机制同抗逆机理类似中[35]。
植物生长发育的最基础环节是种子萌发,因此种子的耐盐能力显得非常关键。本研究中,与对照相比,当外源甜菜碱施加范围在20~40 mmol·L-1时苜蓿种子在萌发过程中的盐抑制作用得到不同程度的缓解,并且在30 mmol·L-1外源甜菜碱的水平下,发芽情况达到盐胁迫下的最好状态。许高平等[36]研究发现,用甜菜碱浸种能够显著提升干旱与盐胁迫下玉米(Zea mays)种子的发芽势发芽率。已有很多类似研究表明,在盐胁迫下添加外源甜菜碱明显会改善烟草(Nicotiana tabacum)、枸杞(Lycium barbarum)、番茄(Solanum lycopersicum)和白三叶(Trifolium repens)等种子的萌发情况[24,37-39],与本研究结果一致。叶绿素是植物光合作用中的关键部分,其含量的多少在一定程度上可以反映植物的光能吸收、转化和传递能力,其含量与叶片光合速率、外界环境条件等紧密相关,因此叶绿素含量一定程度能表征植物生长状况[40-41]。本研究中,与对照相比,外源甜菜碱能增加NaCl 胁迫下苜蓿幼苗的株高、组织含水量、叶绿素含量,当叶施30 mmol·L-1和根注40 mmol·L-1的水平时,各指标值显著大于对照处理,说明适宜浓度的甜菜碱能够维持叶片的水分状况,同时增加光合效率,从而抵御盐胁迫并且促进苜蓿幼苗的生长发育。梁超[33]研究表明,甜菜碱保护逆境条件下叶绿体体积不受盐胁迫,促进叶绿素合成,改善光合效率以增加生物量积累来增强植株抗盐性,这与本研究的结果符合。
可溶性糖和游离脯氨酸可通过调节原生质水溶液的渗透压来保护植物细胞膜[42-44]。本研究表明,幼苗叶片在NaCl 胁迫时,SS 和 Pro 含量提高,降低了盐胁迫对植物细胞造成的伤害,而外源甜菜碱无论叶施还是根注都可以继续增加这两种物质的含量,分别在30 mmol·L-1和40 mmol·L-1达到最大,进一步表明外源甜菜碱可有效提高苜蓿的抗盐性。孟祥浩[45]在小麦抗盐试验中发现,小麦叶片脯氨酸含量随盐浓度增大及胁迫时间延长而有不同程度的增加,耐盐品种的脯氨酸含量积累明显较多,说明游离脯氨酸含量的积累增多可有效提高小麦的耐盐性。丙二醛能与膜结构上的蛋白质或酶结合、交联而使其失去活性,膜结构被破坏,因此MDA 含量可以有效反映生物膜系统受损程度和膜脂过氧化程度[46-48]。本研究中,NaCl对幼苗造成胁迫时,MDA 含量较CK 处理急剧增加,说明盐逆境加剧了膜脂过氧化程度,生物膜系统受损。随着甜菜碱溶液浓度的增加,幼苗叶片中的MDA 含量相应有所降低,叶施和根注外源甜 菜 碱 分 别 在30、40 mmol·L-1时 叶 片MDA 含 量降到盐胁迫下最低水平。原因可能是甜菜碱可以保护酶蛋白结构和功能的完整性,阻碍了MDA 对膜的损伤,维持植物细胞的正常工作,从而提高了苜蓿抗盐性。李芸瑛等[30]利用外源甜菜碱处理黄瓜(Cucumis sativas)幼苗,结果也表明外源甜菜碱可以有效保护低温胁迫对幼苗的伤害而抑制MDA合成,以防止膜脂过氧化加剧,维持了生物膜系统的平衡。
盐胁迫会使植物产生大量活性氧自由基,造成植物细胞膜损伤。因此,提高抗氧化酶活性来清除活性氧自由基对植物在盐逆境下的存活至关重要。SOD、POD 和CAT 是3 类与植物抗逆机制相关的抗氧化关键酶,抗氧化关键酶活性的提高能一定程度上减缓植物细胞受到的氧化损伤[49-52]。本研究中,盐胁迫时幼苗叶片的这3 种酶活性较CK 相 比 略 有 提 高,而 叶 施30 mmol·L-1和 根 注40 mmol·L-1外 源 甜 菜 碱 时 这3 种 酶 活 性 显 著 提高,说明外源甜菜碱可以激发抗氧化酶活性,以清除过多活性氧自由基。研究发现,甜菜碱可以与酶蛋白结合,维持酶蛋白构象的稳定性,使酶蛋白处于激活状态,同时维护呼吸酶及能量的代谢过程,增加保护酶活性以清除体内的活性氧自由基,保护细胞、蛋白质和酶不受来自不良土壤环境与极端天气等外界因素的影响,最终提高了植物抵御逆境胁迫的能力[17,53-54]。梁超[33]通过基因工程证明,过量积累甜菜碱可以保护植株在盐胁迫下各种抗氧化酶活性,减少活性氧的积累,降低MDA 水平,维持生物膜的有序性。这与本研究结果一致。
本研究中,叶片喷洒在30 mmol·L-1时,根部灌注在40 mmol·L-1时,各项生理指标显示苜蓿幼苗的生长状态与抗逆状态达最佳效果。这可能是因为用于培育幼苗的土壤介质中本身存在一类化合物(醛类和有机酸等)[55],能够和甜菜碱中的元素或衍生物产生特异性反应结合,降低甜菜碱的浓度和吸收量,也可能因为外源甜菜碱从根部向叶片吸收运输的过程中有损耗,使得植株叶片得以积累利用的甜菜碱量较少,从而降低了抗盐效果,因此根注所需甜菜碱浓度要大于叶施所需浓度。这说明外源甜菜碱对植物抗逆性的影响与其施加方式和浓度有一定的关系。
综上可以得知外源甜菜碱一定程度下有助于增强紫花苜蓿萌发生长发育在盐逆境下的抗逆能力。在NaCl 胁迫时,0~50 mmol·L-1的外源甜菜碱处理提高了紫花苜蓿种子萌发指标,增加了幼苗的叶绿素、可溶性糖和游离脯氨酸的含量,降低了丙二醛的积累,显著提高抗氧化酶的活性,使苜蓿种子萌发期与幼苗期的抗盐能力得到不同程度的提升。在叶面喷施浓度为30 mmol·L-1外源甜菜碱,根部灌注浓度为 40 mmol·L-1的处理下效果最佳。

