一体化18F-FDG PET/MR评估缺血性脑血管病
缺血性脑血管病具有高患病率、高致残率、高死亡率及高复发率的特点[1-2]。颈内动脉(internal carotid artery, ICA)和/或大脑中动脉(middle cerebral artery, MCA)粥样硬化性狭窄、闭塞是引起缺血性脑血管病的最主要原因[3-4]。一体化PET/MR具有同步扫描的独特优势,一次扫描可同时获得PET和MR图像,兼具MR空间分辨率高、软组织对比度佳和PET检查获取分子生物学信息的优势,通过自动图像精确配准融合可实现脑结构、功能、代谢在时间和空间的最佳配准。本研究探讨一体化18F-FDG PET/MR在缺血性脑血管病中的应用价值。
1 资料与方法
1.1 一般资料 选取2018年5月—2018年11月17例就诊于首都医科大学宣武医院的慢性缺血性脑血管病患者,男15例,女2例;年龄35~71岁,平均(53.0±9.1)岁,均经血管造影诊断为单侧ICA或MCA闭塞,且病程超过1个月;排除MR检查禁忌证及由于头部移动等原因严重影响图像质量者。同期选取10名成年健康志愿者作为对照,男4例,女6例,年龄31~61岁,平均(45.3±9.3)岁;均无精神疾病病史,并经头颅MR检查证实脑部无异常改变、MRA证实无颅内及颈动脉血管病变。本研究经医学伦理委员会批准,受检者检查前均签署知情同意书。
1.2 仪器与方法 采用GE 一体化Signa TOF-PET/MR扫描仪,19通道头颈联合线圈;显像剂为自行制备的18F-FDG,放化纯度>98%。检查前嘱受检者禁食6 h以上,期间不饮用含糖的水,并于检查前1天禁酒、禁剧烈及长时间运动,在注射示踪剂前将血糖浓度控制在正常范围。18F-FDG注射剂量为3.7 MBq/kg体质量,注射后50 min开始一体化18F-FDG PET/MR检查。图像采集过程中,嘱受检者平卧、闭眼、放松、静止不动,尽量避免任何思维活动。PET扫描参数:PET图像采集时间10 min,采用飞行时间(time of flight, TOF)技术+点扩散函数(point-spread function, PSF)技术,视野35 cm×35 cm,迭代次数8,有效子集32,矩阵192×192。MR扫描参数:①T1WI,TR 3 545 ms,TE 24 ms,层厚3.0 mm,层间距1.0 mm,视野24 cm×24 cm,矩阵288×256,扫描时间1 min 55 s;②T2WI,TR 6 278 ms,TE 102 ms,层厚3.0 mm,层间距1.0 mm,视野24 cm×24 cm,矩阵 288×288,扫描时间59 s;③Flair序列,TR 11 000 ms,TE 145 ms,层厚3.0mm,层间距1.0 mm,视野24 cm×24 cm,矩阵256×256,扫描时间2 min 56 s;④DWI,TR 6 212 ms,TE 74.9 ms,层厚3.0 mm,层间距1.0 mm,视野24 cm×24 cm,矩阵128×128,扫描时间50 s;⑤3D-TOF-MRA,TR 25 ms,TE 3.7 ms,层厚1.4 mm,重叠0.7 mm,视野22 cm×22 cm,矩阵320×256,扫描时间14 min 34 s。其中T1W、T2W、Flair序列及DWI的扫描范围覆盖从颅底至颅顶全部脑组织,3D-TOF-MRA扫描范围覆盖颈部和颅内血管。
1.3 一体化18F-FDG PET/MR图像后处理与分析
1.3.1 健康志愿者PET/MRI定性和定量分析 定性分析:由1名资深核医学科医师和1名高年资放射科医师共同完成,意见不同时经协商决定。定量分析:采用AW 4.7工作站对DWI图像进行后处理获得ADC图,分别选取双侧额叶、顶叶、颞叶、枕叶为ROI,定量测量其平均ADC值(mean ADC value, ADCmean)、平均标准化摄取值(mean standardized uptake value, SUVmean)及最大标准化摄取值(maximum standardized uptake value, SUVmax)。
1.3.2 慢性缺血性脑血管病患者PET/MR图像定性和定量分析 定性分析方法同前,观察图像中有无脑梗死灶,并观察患者18F-FDG脑代谢情况以确定异常代谢区。定量分析:采用AW 4.7工作站图像后处理软件,在Flair序列图像中勾画脑梗死灶、梗死周围区作为ROI,每个区域连续勾画3个层面,将其复制到ADC图及PET图像中,分别测量ADCmean、SUVmean及SUVmax,并以镜像法获得ROI对侧相应区域的ADCmean、SUVmean及SUVmax。
1.4 统计学分析 采用SPSS 19.0统计软件对数据进行统计学分析。计量资料以±s表示,采用配对t检验比较健康志愿者左侧与右侧对称脑区间及慢性缺血性脑血管病患者病变侧与对侧相应区域间ADCmean、SUVmean及SUVmax差异。P<0.05为差异有统计学意义。
2 结果
2.1 健康志愿者一体化18F-FDG PET/MR表现 10名健康志愿者MRI均未见异常表现;18F-FDG脑代谢图均显像清晰,双侧额叶、顶叶、颞叶、枕叶区域放射性分布对称,见图1;左侧与右侧额叶、顶叶、颞叶、枕叶ADCmean、SUVmean及SUVmax差异均无统计学意义(P均>0.05),见表1。
2.2 慢性缺血性脑血管病患者一体化18F-FDG PET/MR表现 17例中,5例为左侧ICA闭塞,7例为右侧ICA闭塞,4例左侧MCA闭塞,1例为右侧MCA闭塞;DWI、ADC图显示脑梗死区呈低信号,ADCmean明显高于对侧相应区域(P<0.01),梗死周围区未见异常信号,但ADCmean仍高于对侧相应区域(P<0.01),见图2;脑梗死区18F-FDG脑代谢均明显减低,SUVmean、SUVmax与对侧相应区域比较均明显减低(P均<0.01),脑梗死周围区18F-FDG脑代谢轻度减低,但低于对侧相应区域(P均<0.01),见表2。
表1 10名健康志愿者不同脑区左侧与右侧间ADCmean、SUVmean及SUVmax比较(±s)
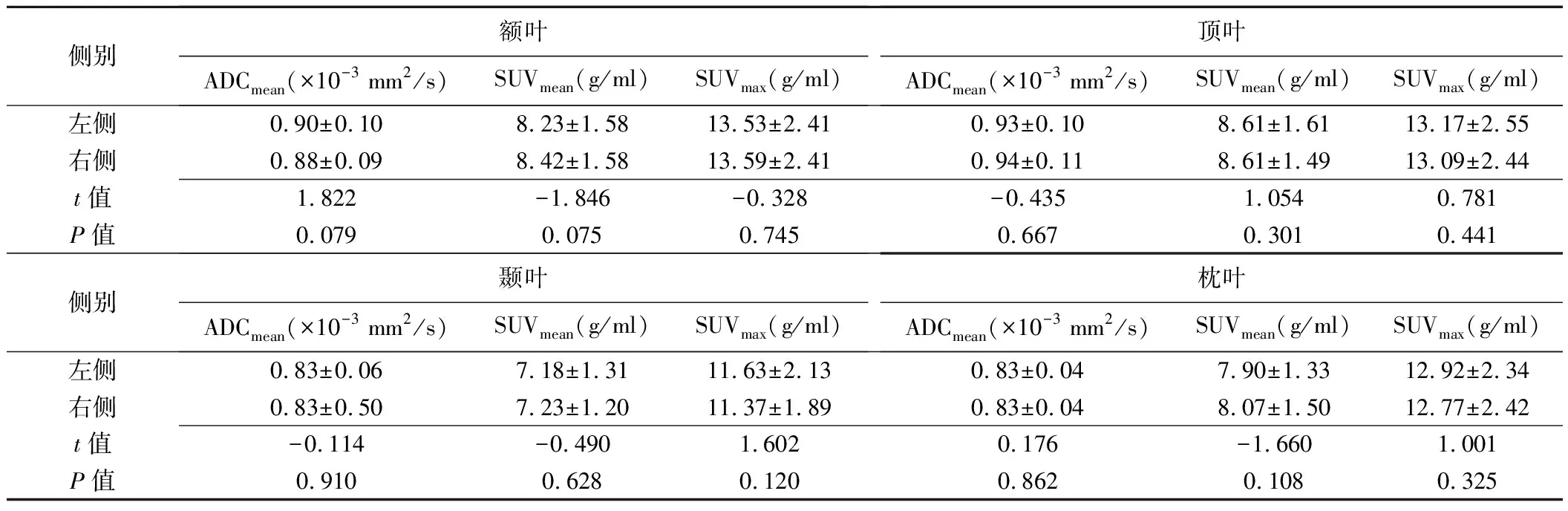
表1 10名健康志愿者不同脑区左侧与右侧间ADCmean、SUVmean及SUVmax比较(±s)
侧别额叶ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)顶叶ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)左侧0.90±0.108.23±1.5813.53±2.410.93±0.108.61±1.6113.17±2.55右侧0.88±0.098.42±1.5813.59±2.410.94±0.118.61±1.4913.09±2.44t值1.822-1.846-0.328-0.4351.0540.781P值0.0790.0750.7450.6670.3010.441侧别颞叶ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)枕叶ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)左侧0.83±0.067.18±1.3111.63±2.130.83±0.047.90±1.3312.92±2.34右侧0.83±0.507.23±1.2011.37±1.890.83±0.048.07±1.5012.77±2.42t值-0.114-0.4901.6020.176-1.6601.001P值0.9100.6280.1200.8620.1080.325

图1 健康志愿者,男,49岁,一体化18F-FDG PET/MR表现 T1WI(A)、T2WI(B)、Flair图像(C)、DWI(D)、ADC图(E)均未见异常信号,3D-TOF-MRA(F)未见血管狭窄、闭塞;18F-FDG脑代谢图(G)、18F-FDG PET/MR融合图像(H)显示双侧大脑半球均未见明确代谢异常
3 讨论
MR为脑缺血性病变最敏感的影像学检查方法,联合应用多参数序列成像可充分反映颅内解剖结构,有效评价颅内血管及病灶。PET是以代谢显像为基础,可反映人体生理、生化、化学传递的分子水平的影像诊断方法。一体化18F-FDG PET/MR实现了功能与解剖结构信息的同步获取,与单纯PET及MR检查相比,可通过提供“一站式”诊断来增强便利性,缩短扫描时间,一次扫描收集多种生理信息(如灌注、代谢、氧合等),为临床提供更加全面、细致的影像学诊断依据[5]。
脑缺血机制研究[6-7]发现,脑缺血时,最先发生的改变为脑血流减少和能量衰竭。本研究通过T1WI、T2WI、Flair序列、DWI及3D-TOF-MRA图像获取血管及颅内组织结构信息,其中MRA主要用以观察颅内血管狭窄、闭塞范围,有无代偿增生血管、是否合并动脉瘤等;T1W、T2W、DWI及Flair序列主要用于分析颅内病变性质,判断脑梗死部位及范围。DWI对于在布朗运动中的水分子扩散过程敏感,已广泛用于监测超急性期和急性期脑梗死的诊断及治疗过程,可在卒中发生的数分钟内可靠地检出严重受损的缺血组织[8-9]。此外,基于DWI图像可生成ADC图并通过ADC值描述组织中水分子弥散速度,脑梗死急性期ADC值降低,而慢性期ADC值升高。Marks等[10]报道,慢性脑梗死区ADCmean值为(1.59±0.84)×10-3mm2/s。本研究慢性缺血性脑血管病患者均为单侧ICA或MCA闭塞,且病程>1个月,病灶DWI表现为低信号,ADC图中呈高信号,ADCmean为(1.44±0.44)×10-3mm2/s。
表2 慢性缺血性脑血管病(单侧ICA或MCA闭塞)患者18F-FDG脑梗死区及脑梗死周围区患侧与对侧相应区域间ADCmean、SUVmean及SUVmax比较(±s)

表2 慢性缺血性脑血管病(单侧ICA或MCA闭塞)患者18F-FDG脑梗死区及脑梗死周围区患侧与对侧相应区域间ADCmean、SUVmean及SUVmax比较(±s)
侧别脑梗死区ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)脑梗死周围区ADCmean(×10-3 mm2/s)SUVmean(g/ml)SUVmax(g/ml)患侧1.44±0.443.69±0.937.07±2.211.16±0.258.29±1.4112.97±2.31对侧0.88±0.138.36±2.8614.06±4.300.99±0.179.81±1.6815.68±3.38t值10.862-12.77-13.817.337-12.771-12.427P值<0.01<0.01<0.01<0.01<0.01<0.01

图2 患者男,35岁,左侧ICA闭塞,一体化18F-FDG PET/MR表现 T1WI(A)示左侧颞枕叶低信号梗死灶,T2WI(B)、Flair图(C)呈高或等信号,DWI(D)呈低信号,ADC图(E)呈高信号,ADCmean为1.72×10-3 mm2/s,3D-TOF-MRA(F)显示左侧ICA闭塞(红箭);18F-FDG 脑代谢图(G)、18F-FDG PET/MR融合图像(H)显示脑梗死灶代谢明显减低,SUVmean、SUVmax分别为4.97 g/ml和9.09 g/ml,梗死灶周围区代谢轻度减低(白箭),SUVmean、SUVmax值分别为6.05 g/ml和10.74 g/ml
脑葡萄糖代谢是反映大脑供血及生理情况的有效指标,葡萄糖约占大脑能量来源的20%。18F-FDG与葡萄糖类似,可被大脑组织细胞吸收并转化为6-磷酸-FDG滞留在细胞内,反映脑组织葡萄糖利用率和代谢情况。正常生理情况下,大脑各部位葡萄糖代谢呈对称分布,13N-氨水定量脑血流量与18F-FDG反映的葡萄糖代谢均有很好的对称性[11]。本组10名健康志愿者颅脑MRI均未见明显异常表现,18F-FDG脑代谢显像大脑不同脑区左侧与右侧代谢分布基本对称,定量分析也显示左侧与右侧间ADCmean、SUVmean及SUVmax差异均无统计学意义。研究[12]报道,发生脑梗死后梗死区域葡萄糖利用率明显减低。脑梗死灶周围区虽未发生形态、结构改变,但亦存在脑血流灌注减低,是发生脑梗死的高危区域[13]。脑血管狭窄、闭塞时,其供血区血流灌注减低,早期表现为轻度脑血流量降低,及时救治可避免脑梗死发生;出现脑血流量严重减低时,则进展为不可逆性脑梗死[14-15]。有学者[16]将MR检查呈阴性但PET检查呈阳性的区域定义为“贫乏灌注”区域,该区域脑组织尚未发生梗死,但如脑供血进一步下降将会引起不可逆脑梗死[17]。本研究分析17例单侧ICA或MCA闭塞患者的一体化18F-FDG PET/MR图像,发现MRI均显示有明确梗死灶,且脑梗死区葡萄糖代谢明显减低;同时梗死灶周围区MRI虽未见明显异常,但18F-FDG脑代谢定量分析显示SUVmean及SUVmax均较对侧相应区域代谢减低,提示需临床干预。除SUVmean及SUVmax外,本组慢性缺血性脑梗死患者患侧ADCmeam亦较对侧相应区域明显增高,可能为缺血导致微循环障碍、通透性增高、细胞外水分增多等原因所致,有待进一步研究。
综上所述,一体化18F-FDG PET/MR可为诊断和评估慢性缺血性脑血管病提供全面、客观的影像学依据,有助于临床合理治疗。

