杉木人工林凋落物分解对氮沉降的响应
沈芳芳,刘文飞,吴建平,袁颖红,樊后保,*,赵 楠
1 南昌工程学院生态与环境科学研究所/江西省退化生态系统修复与流域生态水文重点实验室, 南昌 330099 2 云南大学生态学与进化生物学实验室, 昆明 650091
大气氮(N)沉降在全球范围内普遍发生,全球总活性N释放量从35 Tg N/a(1850年)增加到104 Tg N/a(1997—2013年),在未来一段时期可能继续增加[1],预计2100年达到114 Tg N/a[2]。我国正在经历严重的大气N沉降,1980—2010年期间,每年以0.41 kg N/hm2的速度增长,20世纪80年代(13.2 kg N/hm2)到21世纪初(21.1 kg N/hm2)总量增加了60%[3]。N沉降影响森林生态系统的结构和组成,尤其是森林凋落物的分解系统[4-5]。大气N沉降水平、N添加率以及凋落物质量是凋落物分解响应氮沉降增加的重要因子[6]。
凋落物分解是陆地生态系统碳(C)和养分(N、磷(P)等)循环的关键过程,是森林生态系统养分循环的重要组成部分[7]。森林凋落物分解速度的快慢决定着森林土壤养分的供应能力和森林生态系统养分循环的规模[8]。凋落物分解速率受全球范围内气候条件(如,湿度、温度)的驱动[9-10]、土壤微生物群落和动物群的影响[11]。N沉降不仅通过影响植物N的吸收量来影响凋落物的初始N含量,还可以通过影响地表植被的组成而改变凋落物的化学物质的组成比例[12]。森林生态系统对N沉降的响应研究中,植物的生长(C固定)是正向响应,但凋落物的分解(C释放)对其的响应差异很大[5],分解速率显著降低[13]或没有变化[8]或刺激分解[14]。
落叶占凋落物量的绝大部分,约为55%—73%[15],目前关于森林凋落物分解的研究也主要集中在叶的分解,如,相比单树种凋落物叶分解,两种或多种树种叶混合分解能够显著增强土壤微生物活性[11,16-17],加快凋落物叶的分解速率[18]。落枝和落果占凋落物总量分别可达13%—20%和2%—10%[15],而关于枝和果的分解研究较少。亚热带森林生态系统在全球C循环及C汇功能中发挥着不可忽视的作用。本研究选择亚热带杉木(Cunninghamialanceolata(Lamb.) Hook)人工林为研究对象,2004年开始人工模拟N沉降,至今12年。研究12年N沉降处理后的杉木凋落物叶、枝和果,经过2年分解的C、N、P养分动态,为亚热带生态系统生物地球化学循环提供科学数据,以期为我国森林生态系统对全球变化的响应提供基础支撑。
1材料与方法1.1研究区概况
试验地设在福建省三明市沙县官庄国有林场,位于117°43′29″E,26°30′47″N,属中亚热带季风气候,四季气温温暖适中,日照充足,年平均气温18.8—9.6℃,年平均降水量1606—1650 mm,无霜期271 d。试验林设置在该林场的白溪工区21林班8小班南坡上,平均海拔200 m左右,土壤为山地红壤。试验林为1992年营造的杉木人工林,面积6 hm2。其林下植被稀疏,以五节芒(Miscanthusfloridulus)、芒萁(Dicranopterisolichotoma)、蕨(Pteridiumaquilinumvar.latiusculum)等为主,盖度在3%—5%之间。选择立地和林分条件相似的杉木人工林地块建立12块固定试验样地,样地面积均为20 m×20 m,内设15 m×15 m中心区域,以便破坏性试验在中心区外围的处理区进行。2003年12月进行了模拟N沉降前各处理样地林分和土壤本底值调查[19]。
1.2 模拟氮沉降方法
模拟N沉降实验即以人工喷氮的方式对未来的氮沉降趋势进行模拟。本研究参照国外同类研究,如NITRE[20]、EXMAN[21]项目和北美Harvard Forest[22-23]等类似研究设计,氮沉降量的确定参照了当地N的沉降量(11.4—53 kg N hm-2a-1)[24]以及杉木对N的年需求量(5—8 kg N hm-2a-1)[25]。按N施用量的高低,分设4种处理,分别为N0(0 kg N hm-2a-1,对照)、N1(60 kg N hm-2a-1)、N2(120 kg N hm-2a-1)和N3(240 kg N hm-2a-1),每种处理重复3次。2003年12月建立样地后,于2004年1月开始人工模拟N沉降处理,一直延续至今。每月月初按照处理水平的要求(N0、N1、N2和N3分别为0、0.5、1、2 kg尿素),将尿素溶解在20 L水中,以背式喷雾器在林地人工来回均匀喷洒样地地面。对照样地(N0)喷施同样量的水,以减少因外加的水而造成对林木生物地球化学循环的影响。
1.3 凋落物样品采集与分析
2015年12月收集每个样地的新鲜凋落的杉木枝条和果,将叶从小枝上扯下,整枝使用。将所收集的凋落物清除杂物之后,落叶和落枝置于65℃烘箱内烘干48 h至恒重,落果置于65℃烘箱内烘干72 h至恒重。将每个样地的凋落物样品分别充分混匀后,分叶、枝和果一次性分装在尼龙网缝制的分解袋(孔径大小为1 mm×1 mm)中,每个叶分解袋装10 g,枝分解袋装8 g,果分解袋记录初始重量(确保大于5g)。装袋时另取部分叶、枝和果样品测定含水量和初始C、N和P含量。叶分解袋规格为20 cm×20 cm,枝和果分解袋规格为10 cm×5 cm。布置分解袋时,每个样地中放入叶、枝和果分解袋分别24个。放置凋落物分解袋时,先清除地表凋落物层,然后将分解袋紧贴地面水平放置,表面再简单覆盖一层凋落物。每3个月收回一次,每个样地每次收回叶、枝和果分解袋各3袋,为期2年,总共8次采样。采集时间分别为2016年3月28日(3个月)、6月22日(6个月)、9月24日(9个月)、12月28日(12个月),2017年4月6日(15个月)、7月21日(18个月)、10月18日(21个月)、12月11日(24个月)。收回的分解袋带回实验室,小心清除凋落物表面的杂物和泥土,甚或在流水中冲洗,自然晾干之后,将叶、枝和果转装入纸质信封内放入鼓风干燥器中烘72 h至恒重,称干重并计算残留率,然后粉碎过100目筛制成供试样品,测定C、N和P含量。C采用重铬酸钾-油浴外加热法。N和P经H2SO4-H2O2消煮后,N采用半微量凯氏定氮法,P采用酸溶-钼锑抗比色法。
2015年12月(与新鲜凋落物采集时间相同)采用土壤采样器进行多点混合式采集各样地的土壤样品,分析凋落物试验开始时的土壤理化性质(表1)。
1.4 计算公式
(1)凋落物干物质残留率(%)
干物质残留率=Mt/M0×100%
(1)
式中,M0为凋落物叶、枝和果的初始干重(g),Mt为t时刻凋落物叶、枝和果分解袋中剩余样品的干重(g)。

表1 凋落物试验开始时土壤理化性质
N0、N1、N2、N3分别代表4种处理,为N0 (0 kg N hm-2a-1,对照)、 N1 (60 kg N hm-2a-1)、 N2 (120 kg N hm-2a-1)和N3 (240 kg N hm-2a-1)
(2)凋落物分解速率
采用Olson[26]指数衰减模型模拟凋落物分解过程,计算凋落物分解系数(K):
Mt/M0=a·e-Kt
(2)
式中,K为凋落物分解常数,t为分解时间(a)。凋落物分解50%(T50%)和95%(T95%)所需时间计算方法参照向元彬等[27]和崔鸿侠等[28]:
T50%=-ln(0.50)/K;T95%=-ln(0.05)/K
(3)
(3)凋落物养分残留率(R, %)
R=(Ct×Mt)/(C0×M0)×100%
(4)
式中,Ct为t时刻凋落物叶、枝和果的C、N和P元素含量(g/kg),C0为初始凋落物叶、枝和果的C、N和P元素含量(g/kg),Mt为t时刻凋落物叶、枝和果的干重(g),M0为初始凋落物叶、枝和果的干重(g)。
1.5 数据分析
采用Excel 2013预处理凋落物叶、枝和果的C、N、P含量数据,SigmaPlot 13.0(Sysat software, USA)软件进行制图。凋落物叶、枝和果的C、N、P、C/N基本特征和分解袋中凋落物组分的C、N、P含量均采用SPSS 19.0(SPSSInc., Chicago, USA)统计软件进行最小差异显著法(LSD)检验及回归分析。
2 结果与分析
2.1 凋落物初始C、N、P含量
凋落物初始C、N和P含量特征值为N沉降处理12年时(2004—2015年)的凋落物养分含量。凋落物叶、枝和果的初始C、N、P含量有明显的差异(表2)。N沉降显著影响凋落物叶的P含量,凋落物枝的N、P含量和C/N值,凋落物果的C、P含量和C/N值。其中N3处理的凋落物叶和枝的P含量最高。凋落物组分的C/N值大小为枝>果>叶。
2.2 分解过程凋落物叶、枝、果干重变化和分解速度
连续2年凋落物的分解试验表明,随着分解时间的延长,凋落物叶、枝和果的干物质残留率均呈逐渐下降的趋势(图1),表现为前期下降快,后期缓慢下降。经过2年的野外原位分解,凋落物叶、枝和果的干物质残留率的平均值分别为27.68%、47.02%和43.18%,这表明凋落物叶分解最快,其次是凋落物果,最后是凋落物枝。N沉降在凋落物分解前期影响不显著,在分解末期21—24个月影响显著(P<0.05),其中N1处理均达到显著性差异。以第15个月为界,N1处理的凋落物叶、枝和果干物质残留率显著低于N0处理(P<0.05),这表明分解后期N1处理的凋落物的分解速率最快,N0处理的最慢。整个分解过程中N2处理的枝和果达到显著差异(P<0.05)。综合分解过程中N沉降对凋落物叶、枝和果分解的影响,N1处理显著促进凋落物叶、枝和果的分解,N3处理抑制了凋落物的分解。

表2 凋落物基本特征
C:全碳,total organic carbon; N: 全氮, total nitrogen; P: 全磷, total phosphorus; 不同字母表示显著性差异P<0.05

图1 氮沉降条件下凋落物叶、枝和果分解过程中干物质残留率的变化Fig.1 Changes of litterfall leaf, branch and fruit dry matter residual rate in the decomposition process under nitrogen deposition *表示不同处理之间差异显著(P<0.05)。N0、N1、N2、N3分别代表4种处理,为N0 (0 kg N hm-2 a-1,对照)、 N1 (60 kg N hm-2 a-1)、 N2 (120 kg N hm-2 a-1)和N3 (240 kg N hm-2 a-1)。Four levels of nitrogen treatment were set at 0(control,N0), 60(N1), 120(N2) and 240 (N3) kg N hm-2 a-1 respectively
表3中Olson指数衰减模型的相关系数(R2)均达到极显著相关(P<0.001),说明凋落物叶、枝和果的干物质残留率与时间之间拟合效果良好。结合分解系数(K)、半衰期(分解50%年限)和周转期(分解95%年限)3个指标可以看出,凋落物分解速率为:叶>果>枝。受长期N沉降的影响,凋落物各组分的分解速率差异明显,其中N1和N2处理均促进了凋落物的分解,N3处理呈现了一定的抑制作用。凋落物叶周转期为4—5年,凋落物枝周转期为6—8年,凋落物果周转期为5—7年。
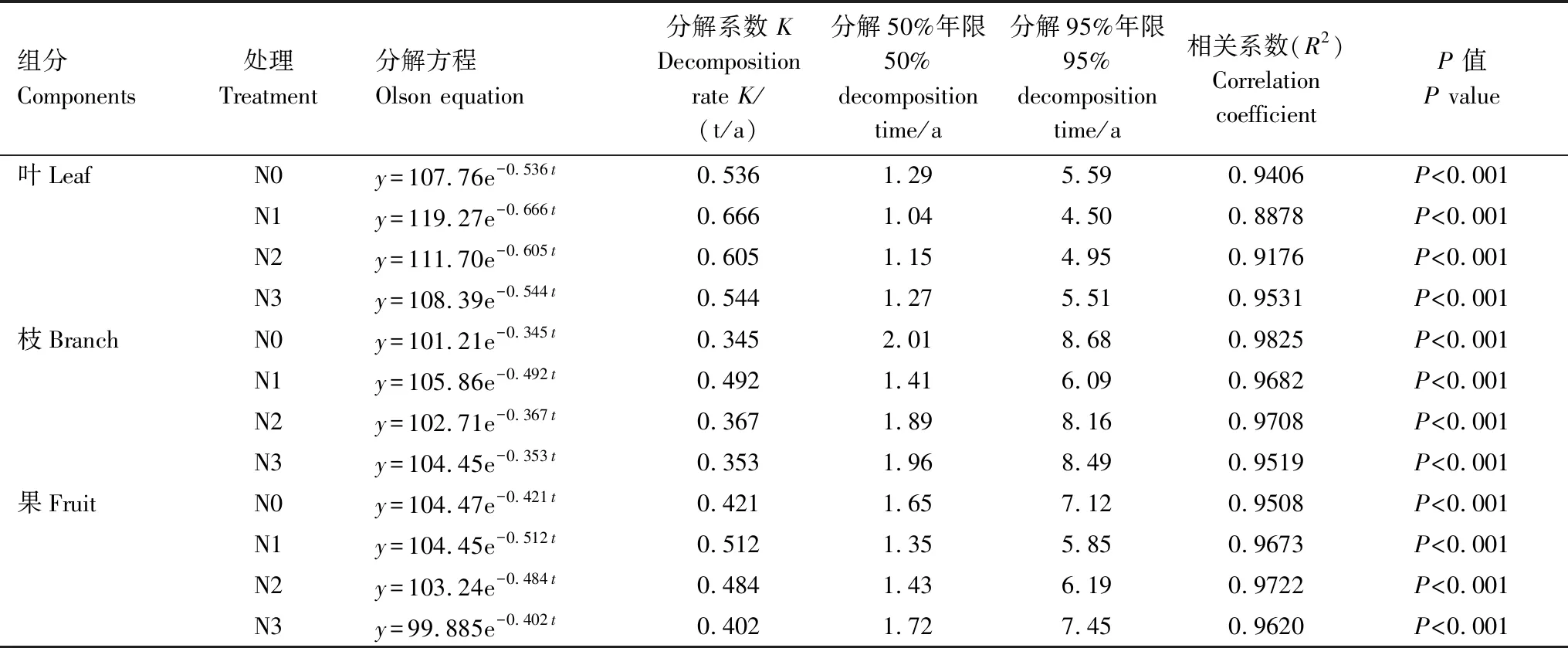
表3 凋落物叶、枝、果分解的Olson指数模型
y为凋落物组分的干物质残留率,t为时间
2.3 凋落物分解过程中C、N和P含量
凋落物分解过程中,叶、枝和果的C含量均呈现降低-增加-降低的趋势(图2)。N沉降处理的叶C含量在第18个月、枝在第3、6和18个月和果C含量在第9、12和18个月达到显著性差异水平(P<0.05)。分解24个月后,叶、枝和果的平均C含量分别为286.90、348.97 g/kg和332.83 g/kg,与初始C含量相比,分别下降了47.36%、36.73%和36.92%,且各处理之间不存在差异。
分解期间N含量呈现增加-降低-增加的趋势(图3)。叶N含量在第9个月达到最高,第18个月达到最低;枝和果N含量在第15个月达到最高,第21个月达到最低。氮沉降处理的叶N含量在第12、18、21和24个月、枝和果在第3、9、12和18个月均有显著性差异(P<0.05)。分解24个月后,叶、枝和果的N含量分别为19.78、18.35 g/kg和18.65 g/kg。相比分解前,叶、枝和果N含量分别增加了66.91%、152.75%和102.93%,其中N沉降(N1、N2和N3)显著增加了叶的N含量(P<0.05),对枝和果没有影响。
分解期间P含量呈现“W”型变化趋势(图4),0—3个月降低,3—9个月增加,9—12个月急剧降低,而后增加。各处理的叶P含量在第9、21和24个月、枝在第6、15和24个月和果P含量在第12和18个月有显著性差异(P<0.05)。分解24个月后,叶、枝、果的P含量分别为0.91、0.85、0.94 g/kg,相比分解前,分别增加了44.44%、93.18%、56.66%。相比N0处理,N1显著降低凋落物枝P含量(P<0.05)。
综合图2、图3和图4的总体变化趋势可以看出,经过2年的分解,N沉降处理在一定程度上降低了凋落物叶、枝和果分解过程中的C含量,但增加了N和P含量。

图2 氮沉降对凋落物叶、枝和果分解过程中C含量的影响Fig.2 Carbon content in decomposing litterfall leaf, branch and fruit response to nitrogen deposition 不同字母表示差异显著(P<0.05),图中数据为平均值±标准差(n=3)
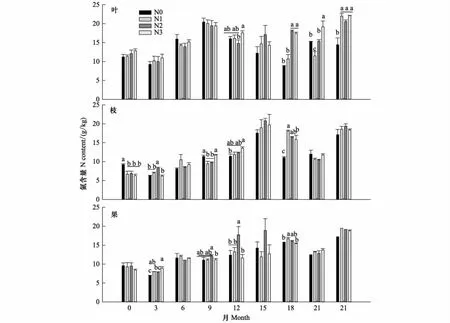
图3 氮沉降对凋落物叶、枝和果分解过程中N含量的影响Fig.3 Nitrogen content in decomposing litterfall leaf, branch and fruit response to nitrogen deposition

图4 氮沉降对凋落物叶、枝和果分解过程中P含量的影响Fig.4 Phosphors content in decomposing litterfall leaf, branch and fruit response to nitrogen deposition
2.4 凋落物分解过程中C、N和P元素的释放规律
凋落物叶、枝和果C元素的释放规律基本一致,表现为释放-富集-释放(图5)。前6个月快速释放,残留率平均下降了57.63%、62.88%和53.72%;6—9个月,C元素出现了富集;9—15个月,C元素为释放状态,15—21个月部分出现富集,而后平稳释放。总体来看,凋落物分解过程中C元素的释放量大于富集量。

图5 氮沉降对凋落物叶、枝和果分解过程中C养分残留率的影响Fig.5 Carbon remaining rate in decomposing litterfall leaf, branch and fruit response to nitrogen deposition
由图6可知,凋落物叶、枝和果的N元素前3个月均为富集,3—6个月为释放,分解末期(21—24个月)为轻微富集。其中,叶N元素在6—9个月为富集,其余为释放,释放量大于富集量;枝N元素在12—15个月为富集,其余为释放,且释放量小于富集量;N2处理的果N元素在6—15个月为富集而后释放,N1处理的果呈现释放与富集交替出现,但释放量大于富集量。

图6 氮沉降对凋落物叶、枝和果分解过程中N养分残留率的影响Fig.6 Nitrogen remaining rate in decomposing litterfall leaf, branch and fruit response to nitrogen deposition
凋落物叶、枝和果P元素残留率变化比较复杂(图7),释放与富集交替出现,前3个月均表现为释放,3—9个月为富集,9—12个月为释放,12—18个月为富集,而后逐渐释放,总体表现为释放量大于富集量。

图7 氮沉降对凋落物叶、枝和果分解过程中P养分残留率的影响Fig.7 Phosphorus remaining rate in decomposing litterfall leaf, branch and fruit response to nitrogen deposition
3 讨论
3.1 氮沉降对凋落物分解的影响
本研究中,N沉降12年时的凋落物叶、枝和果分解过程均表现为前期快速分解,后期缓慢分解,这与前期(N沉降2年时)凋落物分解试验[14]的结果和桉树人工林凋落物分解过程干重变化[29]类似。这是因为凋落物分解前期是细菌利用易溶、易分解的物质(如,可溶性糖类等)完成快速碳循环途径,这个过程受初始营养和环境因子(如,温度、湿度、蒸散量、气候区等)的控制[10];随分解时间的延长,分解后期是真菌(如,黄腐真菌、白腐真菌)利用难分解物质(如酚类、单宁、木质素等)完成慢速碳循环途径,这个过程受凋落物自身的理化性质(如,木质部/N比)和微生物的影响[28-29],同时氮沉降加剧了微生物降解中C的限制[5],导致后期的分解速度变慢[30]。Guendehou等[9]研究热带森林5种优势树种落叶化学成分的变化与分解得出凋落物化学质量是分解过程的主要因素,包括酸解化学物、木质素和初始浓度。N添加会促进高质量(低木质素)凋落物的分解,但阻碍高木质素凋落物的分解[6],是N沉降12年时与N沉降2年时的凋落物分解阶段出现类似结果的主要原因。
本研究结果表明,N沉降处理12年时,经过2年的凋落物原位分解,叶、枝和果的干物质残留率分别为27.68%、47.02%和43.18%。而N沉降处理2年时,经过2年分解的凋落物叶干物质残留率为15.46%—25.17%[14],说明N沉降处理时间的增加在一定程度上降低了凋落物叶的分解。凋落物分解95%所需时间大小依次为枝(6—8年)>果(5—7年)>叶(4—5年),介于亚热带地区森林地上凋落物周转时间为2—8年之间[8],相比N沉降处理2年时凋落物叶的周转时间(3—4年)[14]增加了。凋落物的年平均分解系数大小依次为叶>果>枝(表3),这与梁宏温[31]研究结果类似。N沉降处理2年时,凋落物分解系数与凋落物N含量和C/N之间存在显著的线性相关(除N3外),表明C/N越低,N含量越高,凋落物分解越快[14]。通过Olson指数衰减模型对凋落物干物质残留率进行拟合推算得出杉木林凋落物叶、枝和果的分解系数平均为0.588、0.389和0.455。研究表明,亚热带地区不同林龄的杉木林凋落物叶、枝、果的分解系数不同[31-34]。本研究中杉木于1992年栽种,至2016年已有24林龄,分解系数与广西龙胜里骆地区24—28年生杉木林[33]相当。
本研究中,N1和N2处理促进了凋落物叶、枝和果的分解,N3处理呈现了一定的抑制作用,这与N沉降处理2年时凋落物叶分解的结果一致[14]。N添加通过提高土壤N的有效性、改变凋落物的输入量和质量等直接影响凋落物的分解,也可以通过影响微生物群落组成的变化和土壤酶的活性间接影响凋落物的分解[35]。研究表明,N沉降促使分解者微生物群落组成向低效率转变,从而使微生物分解中C的限制加剧[5]。凋落物的分解速率与土壤N有效性之间显著正相关[36],表明土壤N有效性越高,凋落物分解越快。氮沉降增加了土壤有效N含量[37],但只有N1和N2处理的凋落物分解速率增加了,N3呈现了一定的抑制作用。究其原因,N沉降增加了土壤可利用性N,少量的可利用性N提高了凋落物的分解速率,而过量的N抑制了分解[18]。高N沉降处理(N3)通过阻碍木质素分解(特别是在凋落物分解后期),反过来减缓了干物质的损失,从而抑制了凋落物的分解[13]。N沉降增加了土壤表层(0—20 cm)纤维素酶和多酚氧化酶(主要降解纤维素和木质素的酶)的活性[38]。土壤酶活性对N沉降的响应与凋落物的化学性质和微生物群落结构有关[12]。此外,凋落物开始分解到完全转变成土壤腐殖质的过程中,约有85%的凋落物是被微生物分解的[39]。在凋落物分解后期,真菌群落也受高木质素和高N含量的限制,导致森林土壤表层的腐殖质更多的积累[13,30]。
3.2 氮沉降条件下凋落物分解过程中C、N、P元素的动态

本研究中凋落物分解过程中C元素释放规律表现为释放量大于富集量,这与樊后保等[14]研究结果一致。C是构成凋落物的主要元素,在分解过程中,C可以被氧化成CO2和溶解性有机碳(DOC)而损失(碳释放过程),也可以通过变成有机质而损失,从而造成了凋落物量的减少[43]。樊后保等[14]发现C、N元素的释放与干物质的分解密不可分。说明C释放规律与凋落物分解速率的变化规律一致[44]。研究表明,N添加是刺激凋落物腐殖化的可行方法,将凋落物转化为腐殖质,在土壤中螯合更多的C,并在矿质土壤中进行化学或物理保护,减少了微生物活性的C的有效性[5,10]。N沉降对凋落物分解过程中C含量的影响是非常复杂的,既决定于生态系统微生物的种类和活性,也受气候、植物种类及环境条件等多种因素的影响[41]。
凋落物叶、枝和果分解过程中的N和P元素(除枝N元素外)均呈现释放量大于富集量。宋新章等[12]指出低质量的凋落物在分解前期从环境中富集养分,而高质量的凋落物则释放养分,尤其是N和P养分。分解过程中N和P的富集说明N和P元素限制了微生物和森林的生长[45]。究其原因,长期N沉降增加了凋落物的N含量,高N含量的凋落物满足了微生物分解者对N的需求,导致释放量更大。N沉降处理12年时,凋落物分解过程中N呈现释放与富集交替,而N沉降处理2年时,落叶分解过程中N呈现淋溶-富集-释放模式[14]。研究表明,高浓度的N添加对有机质的影响会随时间的推移而发生变化,凋落物量的损失和微生物呼吸在短期内会增加,但长期内会减少[45]。凋落物的净N释放与C/N密切相关,表明C/N有一个临界值,当C/N小于临界值时,才会出现净N释放。Parton等[46]研究7个生物群落的21个试验点,对凋落物叶分解10年的研究结果指出这个临界值是40,但Moore等[47]在凋落物分解6年的研究基础上提出C/N临界值为55。N添加促使热带森林土壤微生物和根系释放出磷酸酶,促进了土壤P的矿化过程,加速热带森林有机质分解过程中P的释放,因此,极少P被固定[48]。研究表明,P的固定只发生在低N沉降量的凋落物中;在中-高N沉降量下,凋落物P含量降低,出现净P矿化,尤其是高N沉降[49]。
4 结论
低-中水平N沉降(60 kg N hm-2a-1和120 kg N hm-2a-1)能促进凋落物叶、枝和果的分解,其中低水平氮沉降更有利于凋落物的分解;而高N沉降(240 kg N hm-2a-1)抑制了凋落物的分解。N沉降增加了凋落物分解过程中N和P含量,但降低了C含量。除凋落物枝N元素呈现释放量小于富集量外,凋落物其他组分中的C、N、P元素均属于释放量大于富集量。凋落物C∶N∶P化学计量综合森林生态系统功能的变异性,加强C、N、P元素的耦合研究,有助于理解生态过程对全球变化的响应。凋落物分解是一个漫长的过程,通常需要几年甚或几十年才能完成,2年的分解实验时间较短,还需要更多长期时间的分解实验来精确预测生态系统碳平衡和环境变化响应的能力。

