全自动细胞处理系统与手工法制备冰冻解冻去甘油红细胞效果研究
唐静 黄文杰 范恩勇
[摘要] 目的 探討全自动细胞处理系统与手工法制备冰冻解冻去甘油红细胞制备效果。 方法 对2016年6月~2017年8月40袋原料血冰冻红细胞按照洗涤方法的不同分为手工对照组和全自动试验组,每组20袋,试验组采用全自动细胞处理系统制备冰冻解冻去甘油红细胞,对照组采用手工开放式洗涤法进行制备。对试验组和对照组制备的产品进行红细胞产品容量(mL)、血红蛋白含量(g/袋)、游离血红蛋白含量(g/L)、白细胞残留量(×107个/袋)、甘油残留量(g/L)、红细胞回收率(%)及无菌试验等指标的检测分析。 结果 两组洗涤法制备的冰冻解冻去甘油红细胞产品各项质量指标均符合国家相关规定标准要求,试验组中血红蛋白含量、红细胞回收率明显高于对照组,差异有统计学意义(P<0.05);游离血红蛋白含量、甘油残留量等指标均低于对照组,差异均有统计学意义(P<0.05)。试验组与对照组在容量、白细胞残留量质量指标方面基本一致,差异无统计学意义(P>0.05)。结论 全自动细胞处理系统可有效保证临床对Rh(D)阴性患者的紧急抢救用血,为患者抢救生命赢得时间,同时也可减少因手工开放操作而引起的血液细菌污染的可能性,提高采供血机构工作人员工作效率,提升冰冻解冻去甘油红细胞的产品质量,从而确保血液质量和临床用血安全。
[关键词] 冰冻解冻去甘油红细胞;冰冻红细胞;血红蛋白含量;甘油残留量
[中图分类号] R446.1 [文献标识码] B [文章编号] 1673-9701(2019)29-0087-03
Effect study of automatic cell processing system and manual method on preparation of frozen thawed deglycerol red blood cells
TANG Jing HUANG Wenjie FAN Enyong
Yangzhou Central Blood Station in Jiangsu Province, Yangzhou 225007, China
[Abstract] Objective To investigate the effects of the automatic cell processing system and the manual method on the preparation of frozen thawed deglycerol red blood cells. Methods Red blood cells of 40 bags of raw blood from June 2016 to August 2017 were frozen and divided into the manual control group and the automatic experiment group according to the washing method, with 20 bags in each group. In the experiment group, the automatic cell processing system was used to prepare frozen thawed glycerol free erythrocyte, while in the control group, the manual open washing method was used. Indicators, including red blood cell product volume (mL), hemoglobin content (g/bag), free hemoglobin content (g/L), leukocyte residual amount (×107 cells/bag), glycerol residual amount (g/L), red blood cell recovery rate (%) and sterility test of the two groups were detected and analyzed. Results The quality indices of the frozen thawed glycerol free erythrocyte products prepared by both the experiment group and the control group were in compliance with the relevant national standards. The experiment group was significantly higher than the control group in hemoglobin content and red blood cell recovery rate, with statistically significant differences(P<0.05), and was significantly lower than the control group free hemoglobin content, glycerol residual and other indicators, with statistically significant differences(P<0.05). The experiment group and the control group were similar in volume and leukocyte residual, with no statistically significant differences (P>0.05). Conclusion The automatic cell processing system can effectively guarantee the emergency rescue blood for patients with negative Rh (D), win time for rescuing life, as well as reduce the possibility of blood bacterial contamination caused by manual open operation, improve the working efficiency of blood collection and supply agencies, and improve the product quality of frozen thawed glycerol free erythrocyte, thus ensuring blood quality and clinical blood safety.
[Key words] Frozen thawed glycerol free erythrocyte; Frozen red blood cells; Hemoglobin content; Glycerol residues
近年来,随着临床医疗技术水平的发展和输血技术的进步,临床对稀有血型的需求量呈逐年上升,Rh血型系统作为人类第2大血型系统,在输血医学中具有极其重要的临床意义,特别是在产科手术、新生儿输血及急诊输血等方面需求较大,Rh(D)阴性血供应的难点不只是献血者的稀有,更重要的是应急性和及时性[1]。当前,国、内外绝大部分采供血机构对于Rh(D)阴性血的保存主要采用高浓度甘油冰冻保存,保存时间长,能有效缓解临床突发事件对Rh(D)阴性血的需求,且冰冻解冻去甘油红细胞制剂的作用是其他制剂不能替代的[2]。对于冰冻红细胞解冻去甘油制备方法,主要有全自动细胞处理系统和手工法制备两种。由于冰冻解冻去甘油红细胞的制备操作复杂,洗涤液的添加量、添加速度等极易受人为因素影响,制备时间也较长,工作效率不高,同时易造成冰冻解冻去甘油红细胞质量的不稳定[3-8]。为提高冰冻解冻去甘油红细胞产品的制备质量和安全,本站于2016年5月引进ACP215全自动血细胞处理系统进行冰冻解冻去甘油红细胞产品的制备,取得了较好效果,现报道如下。
1 资料与方法
1.1 一般资料
40袋血液产品均来自扬州市中心血站2016年6月~2017年8月成品库,原料血均为2 U/袋的冰冻红细胞,符合《全血及成分血质量标准》[9],冰冻红细胞的制备按照《血站技术操作规程》(2015版)的要求进行,将采集的6 d内且各项指标检测均为合格的Rh(D)阴性全血或悬浮红细胞制备成冰冻红细胞,并将其置于-65℃以下条件保存,本血站冰冻红细胞全部由去白细胞悬浮红细胞制备。
1.2 方法
取待解冻的冰冻红细胞置37℃恒温水浴箱约30 min进行解冻,按照洗涤方法的不同分为对照组和试验组,每组20袋。
(1)对照组:采用手工制备法进行解冻-复苏-去甘油化-洗涤过程,将解冻后的冰冻红细胞在4℃×2500 r/min×10 min 条件下离心,去除上清液;加入9%氯化钠溶液160 mL复苏,混匀后再离心挤出上清液;然后连接 0.9%氯化钠联袋进行洗涤,每次加入1袋氯化钠溶液250 mL,混匀、离心挤出上清液;重复上述步骤3~5次,直至离心后红细胞上清液澄清为止,去除上清液后加入0.9%氯化钠溶液,使其容量达到(400±40)mL即为冰冻解冻去甘油红细胞[10]。全部洗涤过程约需3 h。
(2)试验组:采用ACP215全自动细胞处理系统进行洗涤。首先将融化后的红细胞称重并与ACP215细胞处理系统的235型耗材采用无菌接驳机进行连接,将程序选择为去甘油洗涤,安装好耗材,根据设定的程序,分别加入9%氯化钠溶液复苏和0.9%氯化钠溶液进行梯度洗涤,经过2次稀释、5次洗涤,最后加入一定量的0.9%氯化钠溶液,即制备成冰冻解冻去甘油红细胞。具体操作方法依据ACP215细胞处理系统操作手册进行。全部洗涤过程结束约需56 min。
1.3 主要仪器与材料
ACP215细胞处理系统(美国血液技术公司生产)及配套一次性235型去甘油洗涤耗材;Com poDock型无菌接管机(德国费森尤斯)、6000i型大容量冷冻离心机(德国贺利氏)、DK-600型电热恒温水槽(上海精宏实验设备有限公司)、MEK-7222K全自动血细胞计数仪(日本光电)、BD-9050全自动细菌培养系统(美国BD公司)、Microlab 300半自动生化仪(荷兰威图);9%NaCl溶液、0.9%生理盐水(1000 mL)、0.9%生理盐水四联袋、一次性无菌空袋等均由山东威高集团公司生产。
1.4 检测指标
按照国家相关标准[9]对两组的产品容量(mL)、血红蛋白含量(g/袋)、游离血红蛋白含量(g/L)、白细胞残留量(×107个/袋)、甘油残留量(g/L)、红细胞回收率(%)及无菌试验等进行检测,由本血站质量技术科进行测定。血红蛋白含量、红细胞回收率等測定采用全自动血细胞分析仪进行,游离血红蛋白、甘油残留量采用半自动生化仪进行测定,白细胞残留量采用Nageotte细胞计数盘计数,无菌试验采用全自动细菌培养系统进行培养。
1.5 统计学处理
采用SPSS 19.0软件进行数据处理及统计学分析,计量资料用(x±s)表示,组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
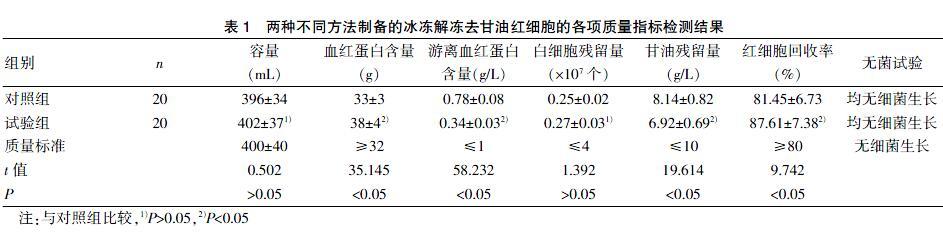
两种不同方法制备的冰冻解冻去甘油红细胞产品质量指标检测情况比较,试验组中血红蛋白含量、红细胞回收率明显高于对照组,游离血红蛋白、甘油残留量明显低于对照组,差异均有统计学意义(P<0.05),见表1。
3 讨论
冰冻红细胞作为Rh(D)阴性血、稀有血型的有效保存手段,也是临床稀有血型患者紧急抢救用血的重要来源和保障[11],可应对临床突发事件对Rh(D)阴性血或稀有血的需求,为抢救患者生命赢得时间,但手工法制备冰冻解冻去甘油红细胞的时间较长,每U约需3 h左右,不仅属于半开放环境操作,存在被细菌污染或交叉污染的安全隐患,而且制备过程复杂,影响因素较多,受冻存前白细胞的滤除、制备原料血(冰冻红细胞)质量、甘油化过程、甘油添加量、去甘油化的离心速度、处理时间等诸多因素影响[12-16]。如何能最大化保证产品质量的同时,缩短制备时间,确保临床急救用血的及时性和有效性,已成为当前采供血机构的共识。
本研究表1结果显示,两组洗涤法制备的产品质量均符合国家相关规定标准要求,但有些质量指标有所差异,试验组中血红蛋白含量、红细胞回收率明显高于对照组,游离血红蛋白含量、甘油残留量等指标均低于对照组(P<0.05)。说明全自动细胞处理系统红细胞回收率较对照组高,且洗涤后残留游离血红蛋白、甘油含量较低,说明洗涤效果较好。较高的红细胞回收率及较好的细胞洗涤效果,可提高红细胞携氧量,减少因游离血红蛋白和甘油对患者的影响,可更好地充分利用稀有血液资源,有效提高患者输血的治量效果。试验组在容量、白细胞残留量等方面与对照组比较,差异无统计学意义(P>0.05),主要原因为本血站制备冰冻红细胞的原料血为去白细胞悬浮红细胞,在制备冰冻红细胞前已将白细胞通过白细胞滤器去除;容量方面,表面看似相近,实际上是为满足《全血及成分血质量标准》中“容量”的要求时,手工添加进去的生理盐水,主要区别为手工法制备的最终产品中红细胞量较少,生理盐水较多;而自动处理系统洗涤的最终产品中红细胞量较多,生理盐水量相对较少。表面上看,与手工法相比较,虽然容量无差异,但红细胞的含量却有明显增高,细胞携氧能力及治疗效果会更好。
全自動细胞处理系统由于其制备时间短,自动化程度高,减少人为差错的发生,耗时仅1 h左右,可为抢救患者生命争取宝贵时间;同时,该系统可进一步避免血液开袋操作引发的细菌污染或交叉污染的安全隐患,越来越受到国内采供血机构的认可。全自动细胞处理系统除用于冰冻解冻去甘油红细胞的制备,也可用于原料血液冰冻红细胞的制备,对于添加甘油的量可以准确计算并添加[17],从而保证原料血液的质量,对于下一步的冰冻解冻去甘油红细胞的制备、确保最终产品的合格奠定基础。全自动细胞处理系统的缺点是设备和耗材较贵,会给患者带来一定的经济负担。
综上所述,全自动细胞处理系统可有效保证临床对Rh(D)阴性患者的紧急抢救用血,为患者抢救生命赢得时间,同时也可减少因手工开放操作而引起的血液细菌污染的可能性,提高采供血机构工作人员工作效率,提升冰冻解冻去甘油红细胞的产品质量,从而确保血液质量和临床用血安全。
[参考文献]
[1] 梁义安,苏相耿,李彬. Rh(D)阴性血在突发公共卫生事件中的应用探讨[J]. 国际检验医学杂志,2016,37(20):2882-2883.
[2] 刘米佳,尹建平. 冰冻解冻去甘油红细胞研究进展[J]. 临床血液学杂志,2014,27(8):727-728.
[3] 王惟. 不同制备方法制备冰冻解冻去甘油红细胞质量研究[J]. 中国实用医药,2013,8(26):274-275.
[4] 时卉丽,李玉秋,程菲,等. 国产与进口血细胞处理机制备冰冻解冻去甘油红细胞的质量对比[J]. 河北医科大学学报,2017,38(11):1344-1347.
[5] 肖乐宇,任明臣,马振芳,等. 机器法和手工法制备的冰冻解冻去甘油红细胞的质量比较[J]. 现代预防医学,2014,41(17);3201-3203.
[6] 李敏. 全自动与手工洗涤制备冰冻解冻去甘油红细胞效果比较[J]. 吉林医药学院学报,2012,33(4):242-243.
[7] 谭菲. 手工法和机器法制备冰冻解冻去甘油红细胞的质量分析[J]. 临床输血与检验,2015,17(6):563-564.
[8] 梁艳. 手工密闭式制备冰冻解冻去甘油红细胞的可行性研究[J]. 贵州医药,2016,40(6):592-593.
[9] 中国国家标准化管理委员会.全血及成分血质量标准(GB 18469-2012)[S]. 北京:中国标准出版社,2012.
[10] 李文静,沈瑞. 冰冻红细胞技术及其应用的研究进展[J].国际检验医学杂志,2013,34(11):1414-1415,1422.
[11] 王惟,谭菲,柴婷婷. 冰冻红细胞冰冻前去除甘油的效果研究[J]. 临床输血与检验,2015,17(4):349-350
[12] 林豪,黄文华,江伟梅,等. 冰冻-解冻-去甘油过程红细胞形态变化与损伤相关性探讨[J]. 临床输血与检验,2018,20(2):141-144.
[13] 袁文声,林惠燕. 冻存前滤除白细胞对解冻红细胞质量影响的研究分析[J].国际检验医学杂志,2015,36(9):1246-1249.
[14] 黄飞,谭均强,高炳谏. 冰冻红细胞的制备与应用分析[J].中国医药科学,2017,7(11):146-148.
[15] 纪宏革,王丽,胡乔,等. 甘油对冰冻解冻红细胞质量的影响探讨[J]. 国际检验医学杂志,2016,37(4):564-565.
[16] 林豪,黄文华,江伟梅,等. 冻存前细胞外多余甘油溶液的去留对解冻红细胞质量影响的比较[J]. 中国输血杂志,2018,31(2):159-161.
[17] 张雅莉,张贝,靳朝霞,等. 冰冻解冻去甘油红细胞制备过程质量控制方法[J]. 临床输血与检验,2014,16(1):68-70.
(收稿日期:2019-03-25)

