盐酸羟胺诱变黄瓜的生长及光合特征
罗琳 刘鉴 孙小程 吉雪花


摘 要: 為创造高光效型的黄瓜种质资源,以‘新泰密刺黄瓜(常规种)为材料,以盐酸羟氨为诱变剂,通过对0.5%、1.0%、2.0% 3种浓度盐酸羟胺诱变后的黄瓜M0代和M1代生长及光合特征进行分析,探明盐酸羟氨是否能够提高黄瓜光合作用。结果表明,诱变后黄瓜M0代和M1代种子发芽率均随盐酸羟胺浓度升高而下降,但与对照差异不显著(M0代2%处理除外);两代种子发芽势均随诱变浓度的升高而下降,且差异显著。诱变后M0代子叶表现出黄化、叶缘上卷、黏连卷缩、缺刻非全缘、下垂、无生长点等形态变异。处理后M1代子叶的叶面积,叶绿素含量及净光合率(Pn)均较对照有所下降,但气孔导度(Gs)无显著变化;M1代子叶Fv/Fm、PSII与对照差异不大,而非光化学猝灭(qN)均显著低于对照。诱变后M1代蕾期真叶(10片真叶)的叶面积、叶绿素含量及Pn值较对照显著升高;真叶的胞间二氧化碳浓度(Ci)、气孔导度(Gs)表现出与Pn一致的变化趋势,因此诱变后M1代真叶光合属于气孔限制;M1代真叶的PSII值与对照差异不大,Fv/Fm整体上低于对照,但有随浓度升高而增加的趋势,qN值随浓度升高显著降低。综合子叶和真叶的光合参数变化,认为0.5%~1%范围内的盐酸羟胺既能较少的伤害子叶,又能较好的促进真叶的光合及生长,可以作为创造黄瓜高光效种质资源的有效诱变剂。
关键词: 黄瓜; 盐酸羟胺; 子叶; 高光效; 诱变
Abstract: In order to create new cucumber materials with high light efficiency, hydroxylamine hydrochloride (HO-NH2·HCl) with 0.5%, 1% and 2% concentrations were used to ‘Xintaimici cucumber seeds(conventional species). Growth indicators and photosynthetic parameters were analyzed to make sure whether there were positive effect of hydroxylamine hydrochloride on cucumbers photosynthesis. The results showed that seeds germination percentage of M0 and M1 decreased with the hydroxylamine hydrochloride concentration, but there were no significant differences between low concentrations and the control; while the germination energy of M0 and M1 decreased significantly with the concentration. After the mutation, cucumbers cotyledon showed morphological variations as followings: yellow, leaf margin roll-up(down), adhesion, leaf margin serrate and meristem disappeared. Comparing with the control, values of leaf area, chlorophyll content and the net photosynthetic rates (Pn) of M1 cotyledons decreased significantly, but there was little fluctuation of the stomatal conductance (Gs). There were little differences of Fv/Fm and PSII in the treatments and the control of the M1 cotyledon, but qN increased with the concentration. For the M1 budding stage, the values of leaf area, chlorophyll contents and Pn were higher than that of the control, values of Ci, Gs showed similar trend with Pn, so there was stomatal limitation of the M1 budding stage. There were little differences of PSII between treatments and the control in budding stage, but qN decreased significantly with the concentration. In a word, 0.5%-1% hydroxylamine hydrochloride can not only damage cotyledons less, but also promote the photosynthetic of true leaves; so it can be an effective mutagen to create new cucumbers germplasm with higher light efficiency.
Key words:Cucumber; Hydroxylamine hydrochloride; Cotyledon; Higher light efficiency; Mutation
黄瓜是种植面积最大、产量最高的设施反季节蔬菜。设施专用品种对耐弱光和高光效性有较高的要求。光合作用是植物最基本的生命活动,叶片光合速率与作物产量密切正相关,因此促进光合速率是提高作物产量的重要途径。对水稻、小麦、玉米、棉花[1-7]等作物的研究表明,作物不同品种间的光合速率差异显著,且这种差异可稳定遗传[8],这就意味着通过品种选育提高光合速率是可能的,而筛选高光效种质资源是高光效育种的前提和基础。
诱变能引发基因突变,在保持原有优良性状的基础上提高突变频率,扩大选择谱,产生有益突变,还能打破原有基因的连锁,促进遗传重组,从而能在短时间内获得丰富突变体以育成新品种。研究指出,利用航空诱变白桦能够提高其净光合率,但是对其叶片叶绿素含量影响并不显著[9]。用秋水仙素溶液处理露地黄瓜,植株节间变短,茎变细,叶柄变短、变细,叶片变厚且颜色加深,叶面积增大,花器变大,果形指数减小,且秋水仙素浓度越高,效果越明显[10]。有人用碳重离子对藻类进行诱变,最终获得2株高光效微拟球藻突变藻株[11]。研究证明诱变后水稻通过增加叶脉密度提高光合能力[12]。相对于物理诱变,化学诱变对处理材料引起的生物损伤小,染色体畸变的比率较小,并且具有位点特异性和点突变等优点[13]。盐酸羟胺是一种重要的有机合成中间体。它在医学、农药和化学领域有着广泛的应用,但作为诱变剂处理种子的研究较少。盐酸羟胺主要与胞嘧啶反应,作用于CG→AT上,属于点突变的一种。但利用盐酸羟胺诱变选育黄瓜高光效材料的研究尚在探索。本文通过对不同浓度盐酸羟胺诱变下黄瓜后代发芽生长及光合参数的分析,探讨盐酸羟胺对黄瓜光合能力的影响,为丰富和完善黄瓜诱变育种途径,创造高光效型的黄瓜种质资源奠定基础。
1 材料和方法
1.1 材料与试剂
‘新泰密刺黄瓜(购买于新疆石河子蔬菜研究所,常规种);盐酸羟胺(HO-NH2.HCl,分析纯99.9%)用少量乙醇溶解后蒸馏水配制成0.5%、1%和2% 3种浓度。
1.2 仪器与设备
SPAD-502Plus便携式叶绿素仪, CIRAS-3光合仪, IMAGING-PAM调制荧光成像系统。
1.3 试验设计
1.3.1 试验处理 2016年4月于石河子大学农学院实验站开展。用0.5%、1%、2%浓度的盐酸羟胺浸泡黄瓜干种子各600粒(200粒为1次重复),以清水处理的种子为对照。30 min后将浸泡的种子清洗干净,室温下浸种6 h,然后放入28 ℃恒温箱催芽,统计发芽率、发芽势。将露白后的种子播在穴盘中(V草炭∶V蛭石=2∶1)育苗,并调查统计子叶变异性状及变异率。3叶1心时移栽到花盆中,每盆2株。诱变植株进入现蕾期时单株套纱网袋隔离,使其自交,获得M1代种子。2017年4月将M1代种子露地直播,按各处理播種种子数统计发芽指标,每处理3次重复。待子叶展平时各处理按移栽株数的10%(对照和0.5%处理各选45盆;1%处理选30盆,1.5%处理选18盆),测量子叶叶面积、叶绿素含量;光合速率和叶绿素荧光参数。各处理随机选5株测定。当M1代黄瓜现蕾时,选取倒3叶测量真叶叶面积、叶绿素、光合速率、叶绿素荧光等指标,取样数量同子叶期。以未经诱变的材料为对照。
1.3.2 测定项目与方法 M0、M1的发芽率从催芽后第2天开始统计,共统计9 d,第6天统计发芽势。诱变后的种子播到穴盘,第2天开始观察子叶出土及形态变异情况。重点观察子叶颜色、子叶边缘完整性和水平展开度以及生长点发育情况。叶面积测定采用方格纸法[14],将叶片压在坐标纸上,用铅笔把黄瓜子叶轮廓准确地描在事先准备好的坐标纸上(小方格为2 mm×2 mm),然后统计叶轮廓占的小方格数量(不到格子一半不计数,超过格子一半的计一格)。最后将叶轮廓的小方格数相加,即为叶面积。叶绿素含量在子叶期(子叶展平,心叶展露)和蕾期(10片真叶)从上往下第3片叶,采用SPAD-502Plus便携式叶绿素测定仪测定[15]。用CIRAS-3光合仪分别测定M1代黄瓜子叶和蕾期真叶的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(E)等参数。于2017年4月和5月选晴天,于上午11:00—14:00在室内测定光合速率,室内光照强度为800 ?mol·m-2·s-1,温度27~30 ℃。每个处理重复测定3次,结果取平均值。采用IMAGING-PAM调制荧光成像系统测定叶绿素荧光参数。
1.4 数据分析
数据处理采用SPSS 17.0 软件,差异显著性采用单因素均值LSD比较法,制表、绘图采用Excel 2010。
2 结果与分析
2.1 盐酸羟胺诱变对黄瓜种子发芽的影响
由表1可知0.5%、1%和2%盐酸羟胺处理时M0代黄瓜种子发芽率分别为94.3%、93.3%和80.0%;相应的发芽势分别为61.0%、56.7%和42.7%。M1代相应浓度的种子发芽率分别为96.3%、96.6%和95.4%,发芽势分别为75.7%、77.6%和65.3%。可知3种浓度下,M0代和M1代黄瓜种子发芽率均随盐酸羟胺浓度的升高而下降,除M0代2.0%处理的种子发芽率显著降低外,其它处理间及其与对照间发芽率差异均不显著。但两代的发芽势却随盐酸羟胺浓度的变化出现了显著差异。
2.2 盐酸羟胺诱变对M0代黄瓜子叶形态变异的影响
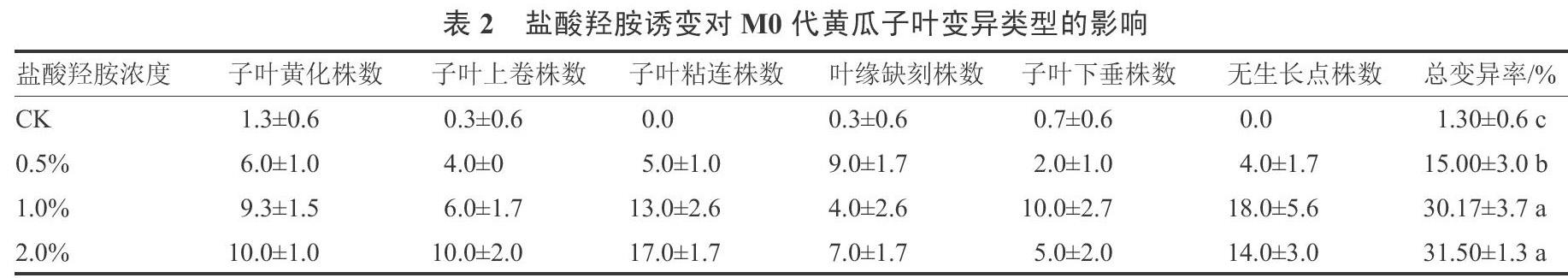
参照杨小苗[16]的方法将叶片突变形态分为以下几类。由图1可知盐酸羟胺诱变使M0代黄瓜子叶出现多性状变异,包括子叶发黄(图1-A),叶缘上卷(图1-B),子叶黏连卷缩(图1-C、1-E),子叶缺刻非全缘(图1-D、1-F),子叶下垂,无生长点(图1-E、1-F)等。调查表明(表2)0.5%浓度盐酸羟胺处理的子叶黄化植株平均有6.0株,子叶上卷类型有4.0株,子叶粘连类型有5.0株,叶缘缺刻类型有9.0株,子叶下垂类型有2.0株,无生长点类型有4.0株,总变异株率15.00%;1%和2%浓度处理的子叶总变异率分别为30.17%和31.50%。整体上,随着盐酸羟胺浓度的升高M0代黄瓜子叶变异株比例升高,但变异类型差异不大。
2.3 盐酸羟胺诱变对M1代黄瓜叶面积的影响
子叶是种子结构中重要的组成部分,黄瓜子叶由于肥厚,面积大,因此在种子萌发以及幼苗生长初期,能够进行光合自养,提供养分和能量[17-18]。试验结果表明0.5%、1.0%、2.0%浓度盐酸羟胺处理后黄瓜幼苗子叶叶面积分别比对照下降了34.88%、27.96%及45.35%,与对照差异显著(图2)。整体上各浓度盐酸羟胺均能抑制黄瓜子叶的生长。对于蕾期真叶,由图2右侧可知,诱变M1代黄瓜真叶叶面积均较对照有一定的增大,单叶叶面积在220 cm2左右,处理和对照无显著差异。
2.4 盐酸羟胺诱变对M1代黄瓜叶绿素含量的影响
叶绿素是光合作用中最重要的色素分子,排列在类囊膜上,在光能的吸收和转换中起着重要作用,直接影响植物的光合速率。试验结果表明0.5%、1.0%、2.0%浓度处理的M1代黄瓜子叶叶绿素含量分别比对照下降了0.23%、4.63%和3.17%。而诱变处理后真叶叶绿素含量显著上升,分别比对照提高了11.92%、19.13%和15.53%,与对照差异显著(图3)。
2.5 盐酸羟胺诱变对M1代黄瓜光合作用的影响
净光合率能综合反映植物的光合生理特性,是植物光能利用能力强弱的直接指标。试验结果表明,0.5%、1.0%、2.0%浓度处理的M1代黄瓜子叶净光合速率分别比对照下降了62.50%、58.70%、76.01%;相应浓度处理的M1代真叶,净光合速率分别比对照增加2.11倍、3.89倍和4.41倍。Ci的变化方向是确定光合速率变化的主要依据。试验结果表明,子叶期高浓度盐酸羟胺使M1代黄瓜Ci与对照差异显著,蕾期真叶差异不显著。0.5%、1%、2%浓度处理的M1代黄瓜子叶,Ci分别比对照下降4.95%、0.84%和升高了4.02%,真叶Ci分别比对照升高了2.30%、4.24%和6.55%。气孔是植物叶片与外界进行气体交换的主要通道,气孔导度表示的是气孔张开的程度,影响光合作用、呼吸作用及蒸腾作用,与蒸腾作用成正比。试验结果表明,0.5%、1%、2%浓度处理的M1代子叶气孔导度分别比对照下降24.90%、7.91%和升高18.64%,真叶气孔导度分别较对照增加了0.36倍、0.93倍和1.64倍。诱变后M1代子叶的蒸腾速率随盐酸羟胺浓度升高而增大,0.5%、1%浓度处理的子叶,蒸腾速率分别比对照下降了36.08%、11.36%,2%浓度处理的子叶蒸腾速率较对照升高15.91%。相应浓度处理的蕾期真叶,蒸腾速率分别比对照升高了26.70%、19.61%和79.08%,这与气孔导度的变化趋势一致(图4)。
2.6 盐酸羟胺诱变对M1代黄瓜叶绿素荧光动力学参数的影响
Fv/Fm表示暗适应下PSⅡ的最大光化学效率,反映植物潜在的光化学能力,常作为光抑制程度的重要指标。试验结果表明0.5%、1%、2%浓度处理的M1代黄瓜子叶Fv/Fm值分别比对照升高了1.82%、1.33%和1.70%;真叶Fv/Fm值分别比对照下降了3.20%、3.20%和1.70%(图5)。子葉PSII值分别比对照升高了0.35%、0.88%和1.03%,而真叶PSII值分别比对照升高了2.63%、3.77%和2.58%。诱变处理后M1代黄瓜子叶和真叶的电子传递速率无显著变化。光化学荧光淬灭系数(qN)表征了植物自我保护的程度。研究表明0.5%、1%、2%浓度盐酸羟胺处理的M1代黄瓜子叶,qN值分别比对照下降了57.13%、32.72%和2.67%;相应浓度处理下的黄瓜真叶,qN值分别比对照下降了16.67%、23.79%和25.98%。
3 讨论与结论
叶片是植物进行光合作用和蒸腾作用的主要器官,叶面积大小对植物生长发育、抗逆性及产量的影响很大。本试验中不同浓度的盐酸羟胺处理后黄瓜子叶叶面积差异不显著,但都低于对照,说明盐酸羟胺处理对黄瓜子叶叶面积有一定的抑制作用。这应该与盐酸羟胺处理种子时对黄瓜胚乳和子叶造成的伤害有关,导致子叶叶面积明显下降。
匡廷云院士在《作物光能利用效率与调控》一书中提出了“外在光能转化效率(合理株型)和内在光能转化效率(高光效)”的高光效育种路线[17]。此后国内很多学者在水稻、大麦、大豆、棉花、油菜[18-23]等作物研究中建立了高光效育种程序和方法,育成了一批高光效、高产的新品种。高光效育种目前主要几种筛选方法:一是筛选光呼吸强度低,二氧化碳补偿点低的育种材料;二是筛选净光合速率高的材料;三是筛选气孔导度大的材料;四是选择Ribisco酶活性高的材料。牛宁等[24]对150份大豆光合气体交换参数的分析发现高光效种质并不仅仅是具有高的净光合速率,较高的气孔导度及高水分利用效率也与高光效密切相关。因此提出在高光效育种实践中,不能单凭某一光合参数的高低评价光合能力,而应该综合运用多个参数全面评价。
本试验中3种浓度盐酸羟胺诱变处理M1代黄瓜子叶叶绿素含量有所下降,但蕾期真叶叶绿素含量显著升高,盐酸羟氨表现出促进真叶叶绿素合成的作用。用氮离子束辐照可诱发黑稻叶绿素含量增加,但剂量高时导致叶绿素突变,出现浅黄突变体[25]。本研究中黄瓜真叶光合速率的上升主要与叶绿素含量上升,气孔导度增大,胞间CO2浓度上升,光合碳同化底物增多有关。另一方面蒸腾作用带走热量,降低叶片温度,保护叶片不受热害,延迟了真叶的衰老。盐酸羟胺处理后,子叶的蒸腾速率增加不显著,应该与叶片发育阶段有关。子叶尚未发育完全,叶面积处在不断增长状态,表皮上的气孔数目、大小仍在不断变化,因此子叶期的光合速率主要与叶绿素含量有关,与气孔导度关系不大。进入蕾期,叶片发育成型,每片叶的气孔数目、大小不再变化,此时改变的主要是气孔开闭程度,因此光合速率主要受气孔导度限制。这与朱玉、陆璃、刘影、王静等[26-29]研究结果类似。
叶绿素荧光参数也是表征光合能力的重要指标。正常环境下高等植物叶片的Fv/Fm为0.80~0.83。本研究显示,盐酸羟胺处理时,整体上黄瓜子叶和真叶的Fv/Fm值在上述范围内,与对照差异不显著,表明盐酸羟胺处理并没有对黄瓜叶片的PSII效能和PSII反应中心的潜在活性造成伤害。非光化学淬灭系数(qN)反映了植物是否受到过剩激发能的伤害。本试验中诱变处理后黄瓜子叶的qN随着盐酸羟胺浓度升高而升高,真叶的qN随盐酸羟胺浓度的升高而下降。这表明诱变后子叶用于热耗散的能量增加,诱变使黄瓜子叶产生了过剩光能,造成了光损伤,这与之前的叶绿素含量降低,净光合速率降低相符合。真叶qN下降说明处理后黄瓜叶片PSⅡ反应中心开放程度加大,电子传递速率上升,使得更多光能转换为电子继续传递下去,因此净光合速率表现出增加的趋势,这与前人报道一致[30-31]。
近年来随着光合测定仪器的不断改进,净光合速率、气孔导度、水分利用效率等光合生理指标的相关性成为高光效育种的研究热点。本研究中盐酸羟胺诱变后黄瓜真叶的净光合速率、气孔导度都有显著升高,因此盐酸羟胺可以作为黄瓜高光效育种材料的诱变剂。
本研究表明,盐酸羟胺处理黄瓜种子时,M1代真叶长势优于对照,子叶生长虽有一定的抑制,但不影响后期生长。因此,0.5%~1.0%的盐酸羟氨为诱变剂有望创造出高光效型黄瓜种质资源。研究只从生长及光合生理层面展开了突变体的筛选,对于诱变后突变的具体位置、突变基因并未进行深入研究。
参考文献
[1] HUBBART S,PENG S,HORTON P,et al.Trends in leaf photosynthesis in historical rice varieties developed in the Philippines since 1966[J].Journal of Experimental Botany,2007,58(12):3429-3438.
[2] 曹樹青,翟虎渠,杨图南,等.水稻种质资源光合速率及光合功能期的研究[J].中国水稻科学,2001,15(1):29-34.
[3] SADRAS V O,LAWSON C,MONTORO A.Photosynthetic traits in Australian wheat varieties released between 1958 and 2007[J].Field Crops Research,2012(134):19-29.
[4] 王曙光,史雨刚,史华伟,等.春小麦光合特性与抗旱性的关系研究[J].作物杂志,2017(6):23-29.
[5] 赵明,王树安,王美云,等.我国常用玉米自交系光合特性的聚类分析[J].作物学报,1999,25(6):733-741.
[6] 李少昆,赵明,许启风,等.我国常用玉米自交系光合特性的研究[J].中国农业科学, 1999,32(2):53-59.
[7] ZENG B,XU X M,ZHOU S X,et al.Effects of temperature and light on photosynthetic heterosis of an upland cotton hybrid cultivar[J].Crop Science,2012,52(1):282-291.
[8] 郭锐,丁玉川,董二伟,等.影响高粱水分利用效率因素研究进展[J].吉林农业,2012(3):235-238.
[9] 姜静,姜莹,杨传平,等.白桦航天诱变育种研究初报[J].核农学报,2006(1):27-31.
[10] 鄢郁霖,王小蓉,唐海东,等.秋水仙素处理对黄瓜生长发育及诱变效应研究[J].长江蔬菜,2010(6):8-11.
[11] 付峰,隋正红,孙利芹,等.藻类诱变育种技术研究进展[J].生物技术通报,2018,34(10):58-63.
[12] ARYO FELDMAN B,HEI LEUNG,MARIETTA BARAOIDAN,et al.Increasing leaf vein density via mutagenesis in rice results in an enhanced rate of photosynthesis,smaller cell sizes and can reduce interveinal mesophyll cell number[J].Frontiers in Plant Science,2017(7):18-33.
[13] 唐伟,李佩洪,龚霞,等.花椒化学诱变育种技术研究[J].四川农业科技,2018(1):49-51.
[14] 李秀启,李晓琳,李颜,等.黄瓜叶面积测量方法的评价[J].长江蔬菜,2008(8):71-73.
[15] 胡学华,王珊,刘洪伟.不同耕作条件下蚕豆叶片相对叶绿素含量研究[J].内江师范学院学报,2011,26(8):54-56.
[16] 杨小苗.番茄EMS突变体库的构建及叶色黄化突变体的分析[D].沈阳:沈阳农业大学,2017.
[17] 匡廷云.作物光能利用效率与调控[M].济南:山东科学技术出版社,2004.
[18] 牛丽芳,路铁刚,林浩.水稻高光效育种研究进展[J].生物技术进展,2014,4(3):153-157.
[19] 秦丹丹,董静,许甫超,等.大麦高光效种质资源的筛选及光合特性与产量的相关性分析[J].现代农业科技,2017(23):38-41.
[20] 娄璐岩,杨素欣,于慧,等.大豆光能高效利用的分子调控机制研究进展[J].土壤与作物,2017,6(2):119-126.
[21] 姚贺盛.新疆棉花机采模式下高光效冠层结构特征及调控研究[D].新疆石河子:石河子大学,2018.
[22] 张耀文,赵小光,关周博,等.油菜角果光合特性研究现状及改良思路[J].中国油料作物学报,2017,39(5) :704-713.
[23] 李俊.油菜高光效生理特征体系的建立及其调控研究[D].长沙:湖南农业大学,2014.
[24] 牛宁,李振侠,金素娟,等.黄淮海地区大豆光合特性及高光效种质筛选[J].中国油料作物学报,2018,40( 4):524-532.
[25] 黄雅琴,李尽哲,叶兆伟,等.氮离子束对黑稻光合性状的诱变效应[J].南阳理工学院学报,2017,9(6):110-113.
[26] 朱玉,黄磊,党承华,等.高温对蓝莓叶片气孔特征和气体交换参数的影响[J].农业工程学报,2016,32(1):218-225.
[27] 陆璃,吕金印,巩擎柱,等.空间环境对小麦叶绿素荧光及光合特性的影响[J].核农学报,2006,20(6):464-468.
[28] 刘影,赵玉,崔东,等.子叶损伤对苦豆子幼苗早期生长的影响[J].草业学报,2017,26(8):139-145.
[29] 王静,郭素娟,徐丞.60Co-γ辐照燕山早丰接穗生物效应研究[J].核农学报,2018,32(4):625-632.
[30] 吴顺,张雪芹,蔡燕.干旱胁迫对黄瓜幼苗叶绿素含量和光合特性的影响[J].中国农学通报,2014,30(1):133-137.
[31] 莫亿伟,郭振飞,谢江辉.温度胁迫对柱花草叶绿素荧光参数和光合速率的影响[J].草业学报,2011,20(1):96-101.

