副猪嗜血杆菌血清13型分离鉴定及其培养特性研究
庞琳琳,赵秋华,王 欣,张俊杰,郭 爽,李蓓蓓,刘 珂,邵东华,邱亚峰,马志永,王 建,魏建超
(1.中国农业科学院上海兽医研究所,上海 200241;2.上海市闵行区动物疫病预防控制中心,上海 201109;3.上海市动物疫病预防控制中心,上海 201103)
副猪嗜血杆菌(Haemophilus parasuis,HPS)是一种位于上呼吸道的革兰氏阴性杆菌,易感染2~6周龄断奶后仔猪和保育猪,出现发热、食欲不振、呼吸困难、腹式呼吸、关节肿胀、站立困难甚至瘫痪等临床症状[1],发病率一般为10%~15%,严重时死亡率高达50%[2,3]。剖检时常见浆膜炎、脑膜炎、支气管肺炎、关节炎等病理变化。
副猪嗜血杆菌不易分离,有部分至今未被分离出。根据血清定型检测,将副猪嗜血杆菌划分为15个血清型。其中血清型1、5、10、12、13和14是强毒株,腹腔接种SPF猪4 d内即可引起猪死亡或濒临死亡[4]。近年来,国内的主要流行株为4、5、12、13、15型[5-7],强毒株13型给养猪产业带来了严重的经济损失。副猪嗜血杆菌感染虽可以用药物进行防治,但易产生耐药性,且影响食品安全,因此使用疫苗是比较经济有效的预防方法[8]。
目前,副猪嗜血杆菌疫苗的研制主要应用平板培养、灭活制备的传统方法,成本较高,产量较低[9],而液体培养可以很好弥补这些缺陷[10]。本研究通过16S rDNA测序及PCR血清分型技术确定分离菌株为13型副猪嗜血杆菌,采用动物回归试验确定分离菌毒力的强弱。通过优化不同新生牛血清浓度、影响因子(NAD)浓度的生长条件,探讨13型副猪嗜血杆菌最适的液体培养条件,观察生长曲线,并确定其生长对数期的OD600值范围及活菌数的变化趋势,从而为13型副猪嗜血杆菌的大规模培养奠定基础。
1 材料与方法
1.1 菌种将患病仔猪的心包积液、关节液均匀画线接种于含烟酰胺腺嘌呤二核苷酸(NAD)的TSA培养平板上进行培养,分离纯化后冻干保存。
1.2 培养基及试剂胰胨大豆琼脂培养基(TSA 培养基)和胰胨大豆肉汤培养基(TSB培养基)均购自英国的OXOID公司;新生牛血清购自浙江天杭生物科技股份有限公司;烟酰胺腺嘌呤二核苷酸(NAD);酸度计购自德国Sartorius公司;Agarose购自YESEN公司;2×TaqPCR Master Mix 购自天根生物有限公司。
1.3 菌种PCR鉴定根据GenBank菌类的16S rDNA序列设计引物(27F和1492R)进行PCR;1%琼脂糖凝胶电泳后进行胶回收并纯化目的条带,获得的目的基因送至上海桑尼生物有限公司测序,与GenBank中副猪嗜血杆菌参考菌株16S rDNA序列比对分析进行菌种鉴定;参考文献[11]设计引物,应用PCR对分离菌株进行血清型分型。
1.4 动物回归试验选12头30日龄的仔猪,随机分为4组,每组3头;其中3组为实验组,另外1组为对照组;实验组每头仔猪腹腔注射2 mL副猪嗜血杆菌,浓度分别为1×105、1×106、1×107CFU/mL;对照组每头仔猪腹腔注射2 mL PBS。观察各组仔猪体温、呼吸及精神状况、死亡率等。对于濒死猪进行安乐死,解剖观察其内脏组织病变并对菌株进行分离。
1.5 生化实验取少量分离菌株分别滴加到氧化酶拭纸以及过氧化氢酶生化鉴定管,观察实验结果。将少量的液体副猪嗜血杆菌在无菌条件下分别滴加到葡萄糖、蔗糖、果糖、麦芽糖、蛋白胨水、β-半乳糖苷、尿素新型微生物微量生化鉴定管中,37℃反应30 h左右,观察结果。
1.6 不同浓度的新生牛血清对分离菌株生长的影响在 NAD浓度为2.5 μg/mL的TSB液体培养基中加入新生牛血清,使其血清浓度分别为1%、5%、10%、20%。分别取4 mL不同浓度的新生牛血清培养菌放入试管中,设置3个重复。37℃,220 r/min条件下培养6、12、24 h,分别测定不同牛血清浓度及不同培养时间的OD600值,比较在不同血清浓度中分离菌的生长情况。
1.7 不同浓度的NAD对分离菌株生长的影响在新生牛血清浓度为5%的TSB中加入NAD,使其终浓度分别为0.2、1、2.5、10、25 μg/mL,将分离菌接种到TSB培养基中,置于37℃、220 r/min条件下培养12、16、22 h,分别测定不同NAD浓度及不同培养时间的OD600值。每个NAD浓度进行3次重复试验,比较在不同NAD浓度中分离菌的生长情况。
1.8 分离菌在最适培养基中的生长曲线将增殖好的分离菌按1:100的比例接种到TSB培养基中(5%新生牛血清,10 μg/mL NAD),置于37℃、220 r/min培养24 h,培养期间从第4 h开始每2 h取1次样,测定OD600值和pH,从而确定13型副猪嗜血杆菌在最适培养条件下的生长情况。测定OD600值的同时,进行活菌计数,绘制活菌数与OD600值的关系图。
2 结果与讨论
2.1 PCR鉴定结果将16S rDNA测序结果在NCBI中进行比对,确定分离菌株为副猪嗜血杆菌(图1)。通过PCR对分离菌株进行血清学鉴定,确定为血清13型(图2)。
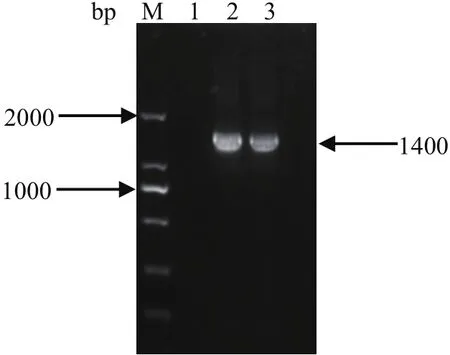
图1 分离菌株16S rDNA鉴定结果Fig.1 PCR result of 16S rDNA of isolates

图2 副株嗜血杆菌的血清分型结果Fig.2 Serotyping results of Haemophilus parasuis
2.2 动物回归试验结果实验组仔猪腹腔注射13型副猪嗜血杆菌,对照组仔猪注射PBS。攻毒组仔猪在12 h内出现呼吸困难,体温增高,流鼻涕,精神不振等临床症状;1×107CFU/mL组的临床症状更加明显,在攻毒24 h内高浓度组开始出现死亡;其他两组实验组临床症状在12~24 h内逐渐加重。实验组仔猪在感染后4 d内全部死亡。解剖濒死猪均发现心包积液、关节积液,肺部有明显的病变。对病变部位的细菌进行分离纯化,经PCR血清学鉴定后,确定为13型副猪嗜血杆菌。
2.3 13型副猪嗜血杆菌的生化实验结果生化反应结果显示,13型副猪嗜血杆菌可导致氧化酶、过氧化氢酶阳性,且能够分解葡萄糖、蔗糖、果糖、麦芽糖,但不能够与蛋白胨水、β- 半乳糖苷、尿素发生反应(表1)。
2.4 不同浓度的血清对13型副猪嗜血杆菌生长的影响检测不同浓度血清在不同培养时间的菌液OD600值,结果表明,20%的新生牛血清浓度对13型副猪嗜血杆菌的生长有抑制作用。当血清浓度为5%、10%时与浓度为1%、20%相比较分别,差异性具有极显著统计学意义(P≤0.01)。5%的浓度与10%的浓度新生牛血清相比差异不具备显著统计学意义(P>0.05)(表2)。因此,从13型副猪嗜血杆菌的生长情况及经济效益来考虑,应选择终浓度为5%的新生牛血清浓度作为其液体培养条件。
2.5 不同浓度的NAD对13型副猪嗜血杆菌生长情况的影响副猪嗜血杆菌对培养条件的要求十分苛刻,需要血清和特殊的生长因子NAD。通过检测不同培养时间不同浓度NAD的菌液OD600值,结果显示,当NAD浓度过低时,13型副猪嗜血杆菌生长趋势不明显;NAD浓度为2.5 μg/mL时副猪嗜血杆菌生长依然缓慢;NAD浓度为10 μg/mL与25 μg/mL,相比差异性不具备显著统计学意义(P>0.05)(表3),而NAD浓度为10 μg/mL与0.25、1、2.5 μg/mL相比,差异均具备显著统计学意义(P≤0.05)。从13型副猪嗜血杆菌的生长情况及经济效益情况来考虑,应选择终浓度为10μg/mL的NAD作为培养13型副猪嗜血杆菌的最适浓度。
2.5 13型副猪嗜血杆菌在最适培养基中的生长曲线将13型副猪嗜血杆菌按1∶100的比例接种到100 mL TSB培养基中(10 μg/mL NAD、5%新生牛血清),生长曲线见图3,接菌4 h后OD600值开始上升,菌体开始生长,在培养22 h时OD600值达到最大。随着培养时间的增加,OD600值开始下降。活菌对数值在培养14 h时达到最高,随后开始下降,在24 h时活菌数又有上升趋势(图4)。可以看出13型副猪嗜血杆菌的OD600值在0.2~0.6时为其对数生长期。
活菌数和OD600值之间的关系如图5所示。当OD600值小于0.4时,活菌数与OD600值之间有很好的线性关系;当OD600值大于0.4时,活菌数与OD600之间的偏差越来越大。
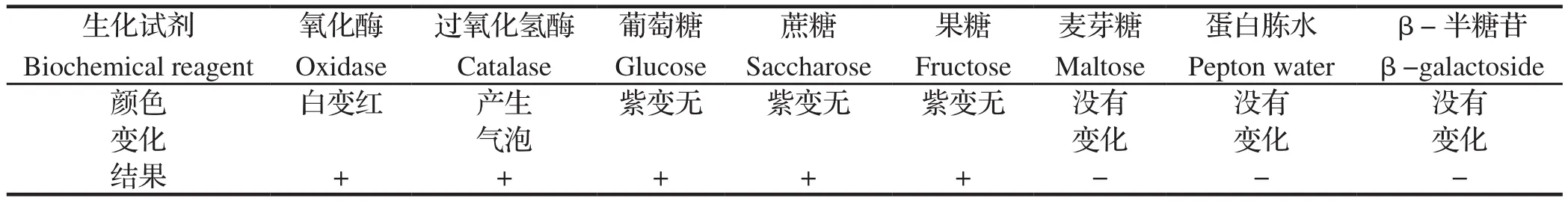
表1 分离菌株生化反应结果Table 1 Biochemical reaction results of isolated strain

表2 13型副猪嗜血杆菌在不同新生牛血清浓度中不同培养时间的OD600值Table 2 OD600 values of Haemophilus parasuis in different concentrations of newborn calf serum at different times
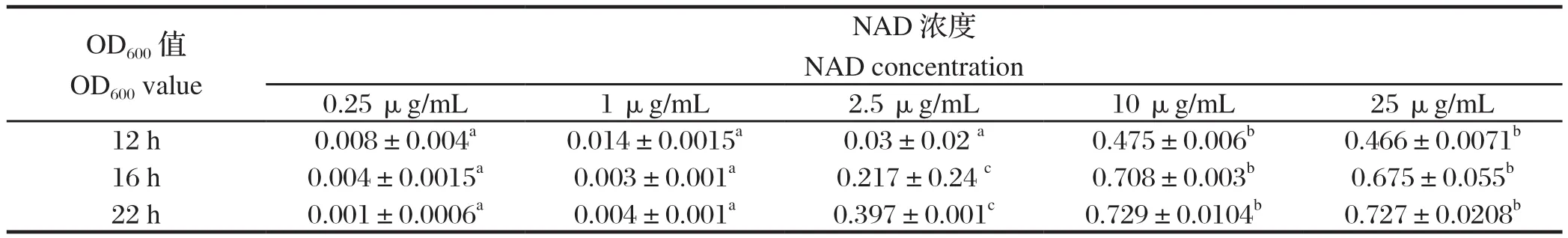
表3 13型副猪嗜血杆菌在不同NAD浓度中不同培养时间的OD600值Table 3 OD values of Haemophilus parasuis in different NAD concentrations at different times
在TSB中培养副猪嗜血杆菌,溶液pH值下降极快,培养24 h后,pH值下降至6.2。pH值对副猪嗜血杆菌的菌体浓度有一定影响[15]。13型副猪嗜血杆菌在液体培养基中存活时间较短,这一现象可能与其繁殖过程中产生大量酸有关。因此,在大规模培养副猪嗜血杆菌的过程中应注意pH值的范围。
临床上副猪嗜血杆菌常引起呼吸道疾病,发病率和死亡率相对较高,给养猪业带来了很大的经济损失。副猪嗜血杆菌血清类型很多,各血清之间的交叉免疫保护具有可变性[12]。目前防控副猪嗜血杆菌感染主要采用疫苗和药物。应用药物进行预防和治疗,效果虽佳,但易产生耐药性[13,14]。虽然在各血清型之间疫苗的交叉免疫保护现象很弱,但根据当地副猪嗜血杆菌流行特点所研制的疫苗还是具有一定的良好效果。使用商业疫苗或灭活苗可以很好的防控副猪嗜血杆菌病[16]。临床上感染13型副猪嗜血杆菌的仔猪发病率和死亡率均较高,但针对强毒株13型副猪嗜血杆菌的商业疫苗研究较少。
本研究通过16S rDNA测序及PCR测定其血清型,确定此株为13型副猪嗜血杆菌。从动物的回归试验可以判定分离株为强毒株。同时,进一步研究了13型副猪嗜血杆菌的最佳的液体培养条件,为其疫苗的研制提供了参考。
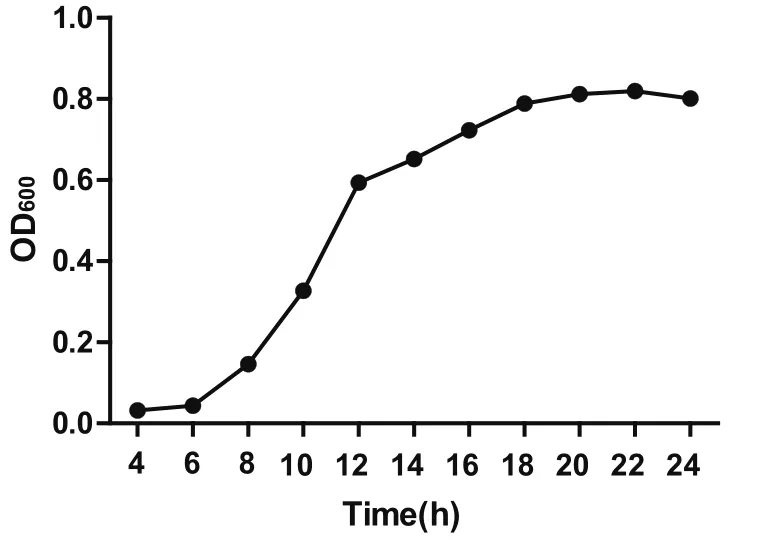
图3 13型副猪嗜血杆菌在最适培养基中的生长曲线Fig.3 Growth curve of Haemophilus parasuis 13 in the optimal medium
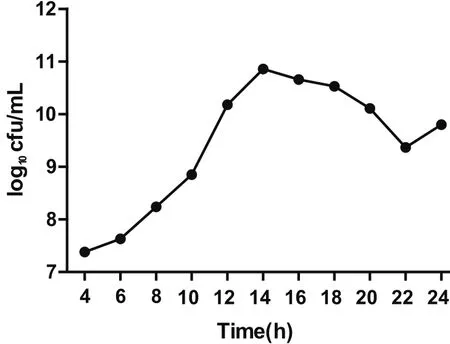
图4 13型副猪嗜血杆菌在最适培养基中的活菌对数值Fig.4 Viable counts of Haemophilus parasuis 13 in the optimal medium

图5 13型副猪嗜血杆菌的活菌数与OD600值的关系Fig.5 Relationship between viable count and OD600 value of Haemophilus parasuis 13
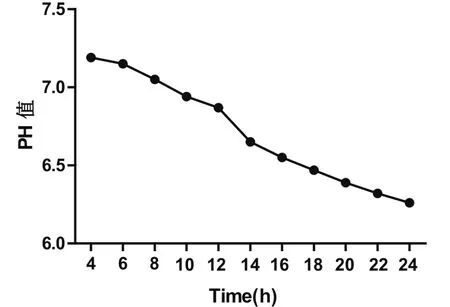
图6 13型副猪嗜血杆菌在最适培养基中的pH值Fig.6 pH values of Haemophilus parasuis 13 in the optimum medium

