肠碱性磷酸酶在肠黏膜屏障中的作用
万 军, 田 忠, 姚柏宇, 刘 翀, 何静妮, 殷 鑫, 史 旸
万军, 田忠, 姚柏宇, 刘翀, 何静妮, 殷鑫, 史旸, 中国医科大学附属盛京医院第十普通外科 辽宁省沈阳市 110000
核心提要:肠黏膜屏障是机体抵御外界病原侵袭和维持肠道稳态的重要屏障结构.肠碱性磷酸酶参与调节十二指肠pH、反映肠道的发育情况及小肠上皮细胞的吸收能力, 降低肠道脂多糖毒力、减低肠道炎症、调节肠道菌群分布、抑制细菌位移.
0 引言
肠黏膜屏障是机体抵御外界病原侵袭和维持肠道稳态的重要屏障结构, 主要由机械屏障、化学屏障、 生物屏障和免疫屏障四个部分构成[1].其中肠黏膜上皮细胞间的紧密连接蛋白构成机械屏障; 肠黏膜上皮细胞分泌黏液, 胃肠道分泌消化液和肠道共生菌产生抑菌物质共同构成肠黏膜化学屏障; 肠道共生菌群及宿主肠道微环境相互作用, 互相影响构成了肠黏膜生物屏障;肠道淋巴系统及其分泌的免疫活性物质抑制肠道炎症构成肠黏膜免疫屏障[2,3].完整的肠黏膜屏障是维持肠黏膜屏障功能的重要条件, 四个部分缺一不可, 任何一部分损伤都会破坏肠黏膜屏障稳定性, 威胁机体的生命健康.相关研究发现[4]肠碱性磷酸酶(intestinal alkaline phosphatase, IAP)在维持肠黏膜完整和改善功能上发挥着一定的作用.
1 IAP
碱性磷酸酶(alkaline phosphatase, AKP)是广泛分布于人体组织器官的单磷脂水解酶, 它本身是一种膜结合金属糖蛋白, 由两个亚单位组成, 作为同源二聚体酶, 包括四种同工酶, 主要分为组织非特异性AKP和组织特异性AKP, 前者主要在肝、肾和骨组织中表达, 后者包括IAP、胎盘碱性磷酸酶(placental alkaline phosphatase,PLAP)和生殖细胞碱性磷酸酶(germ cell alkaline phosphatase, GCAP)[5].IAP是一种能水解单磷酸酯的刷状缘蛋白, 存在于肠细胞刷状缘的顶端微绒毛中, 并分泌到肠腔和血液中, 是维持肠道稳态所必需的肠黏膜防御因子[6-9].IAP参与调节肠道脂类物质吸收, 在脂肪酸通过质膜进入肠上皮细胞过程中起到限速作用[10,11],Zhou等[12]研究发现IAP蛋白及mRNA的表达量与肥胖相关.
Narisawa等[13]研究发现通过高脂肪饮食喂养小鼠,对比IAP基因敲除的实验鼠与野生型小鼠, IAP基因敲除小鼠在高脂肪饮食条件下体重增加更多.以往研究发现IAP主要在十二指肠表达, 在碱性条件下发挥作用[13],该位置IAP的mRNA表达水平及酶的活性最高, 在空肠和回肠低表达[14], 但IAP在胃中几乎不表达[15].肠道细菌在胃十二指肠缺乏但在空回肠菌量增多, 体现了IAP表达量与肠道细菌定植水平相反的特性[16].为进一步研究IAP对肠道微生物影响提供了思路.
有研究证实[17], 通过比较喂养0-28 d的同窝不同生长天数的仔猪, 老龄仔猪相比新生仔猪肠道IAP表达量更多, 认为仔猪小肠中的IAP活性与动物生存时间具有相关性.同时也有研究[18,19]观察到啮齿类动物哺乳期IAP表达水平最低, 随着动物成长到断奶年龄, IAP表达量增至成年正常水平.以上研究提示啮齿动物IAP的表达及生物活性随饮食及年龄变化而改变.同时也有相关研究[4]证明人体饥饿时可导致肠道IAP的表达及活性下降, 增加肠道炎症的易感性.总之IAP在改善肠道功能上发挥了作用.
2 IAP与肠道屏障
2.1 IAP维护肠黏膜机械屏障 肠道机械屏障作为肠黏膜屏障重要的一部分, 其肠上皮细胞间紧密连接蛋白发挥着重要的作用, 而IAP在维持细胞间紧密连接发挥作用.相关研究证实基因敲除小鼠与野生型小鼠相比, IAP基因缺失导致了紧密连接蛋白ZO-1, ZO-2和Occludin水平显着降低, 在细胞实验中通过刺激IAP过表达紧密连接蛋白ZO-1, ZO-2的mRNA水平增加了2倍, 证实了IAP通过调节紧密连接蛋白改善肠黏膜通透性进而维持肠黏膜屏障功能[20].Rentea等[21]的研究也发现, 给予低剂量外生型牛IAP, 可以更好的降低肠黏膜的通透性, 保护肠道屏障完整.Hamarneh等[22]首先通过研究IAP基因敲除小鼠和野生型小鼠, 结果发现基因敲除小鼠紧密连接蛋白表达量较野生型小鼠低, 证实肠道屏障受损与IAP表达缺失相关.再研究给予持续缺乏肠内营养48 h的饥饿模型小鼠肠道补充外源性IAP, 发现缺乏肠内营养喂养IAP表达也会降低, 进而造成屏障紧密连接蛋白缺乏, 补充外源性的IAP可逆转肠道屏障功能障碍和改善肠内喂养不足导致的紧密连接蛋白损害.从以上研究结果可以得出, IAP在维护肠黏膜机械屏障, 改善肠道通透性中确实发挥了作用, 但目前研究对IAP、黏膜屏障及紧密连接蛋白间的具体分子机制尚不明确, 还需同时要进一步研究.
2.2 IAP支持肠黏膜免疫屏障 肠道免疫屏障由获得免疫和固有免疫两部分构成, 免疫球蛋白A(immunoglobulin A, IgA)和抗菌肽及黏蛋白分别构成获得免疫和固有免疫的重要效应分子和活性成分[23].Lassenius等[24]研究证实患有1型糖尿病的患者表现出肠道炎症的迹象.与对照组相比, 糖尿病患者的粪便钙防卫蛋白水平较高, 粪便IAP活性较低, 伴较低的丙酸盐和丁酸盐浓度.此外,1型糖尿病患者的粪便IgA含量和与氧化LDL结合的抗体水平降低.在小鼠中, 口服IAP补充剂显着增加肠IgA水平.人体肠道中存在大量的革兰阴性细菌, 脂多糖(lipopolysaccharide, LPS)作为革兰阴性细菌细胞壁重要组成部分, 是引发肠道炎症反应的重要因素.Bates等[25]和Bentala等[26]的研究发现IAP可通过激活肠上皮细胞Toll样受体(Toll-like receptors, TLR)4基因表达, 识别革兰氏阴性细菌外膜中的LPS并诱导宿主进行免疫应答和损伤修复, 巨噬细胞募集(级联诱导嗜中性粒细胞)激活诱导核因子-κB(nuclear factor kappa-B, NF-κB)和TLR3基因, 并通过 MyD88依赖途径抑制炎症性细胞因子白细胞介素(interleukin, IL)-1、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、IL-6和IL-12的表达, 从而抵抗肠道感染.TLR4的大量激活可能进一步抑制了TNF-α的表达, 抑制LPS诱导的炎症反应, 从而降低LPS的毒性.Hwang等[27]研究发现也表明, IAP通过TLR4/NF-κB介导途径维护肠黏膜屏障功能的正常.
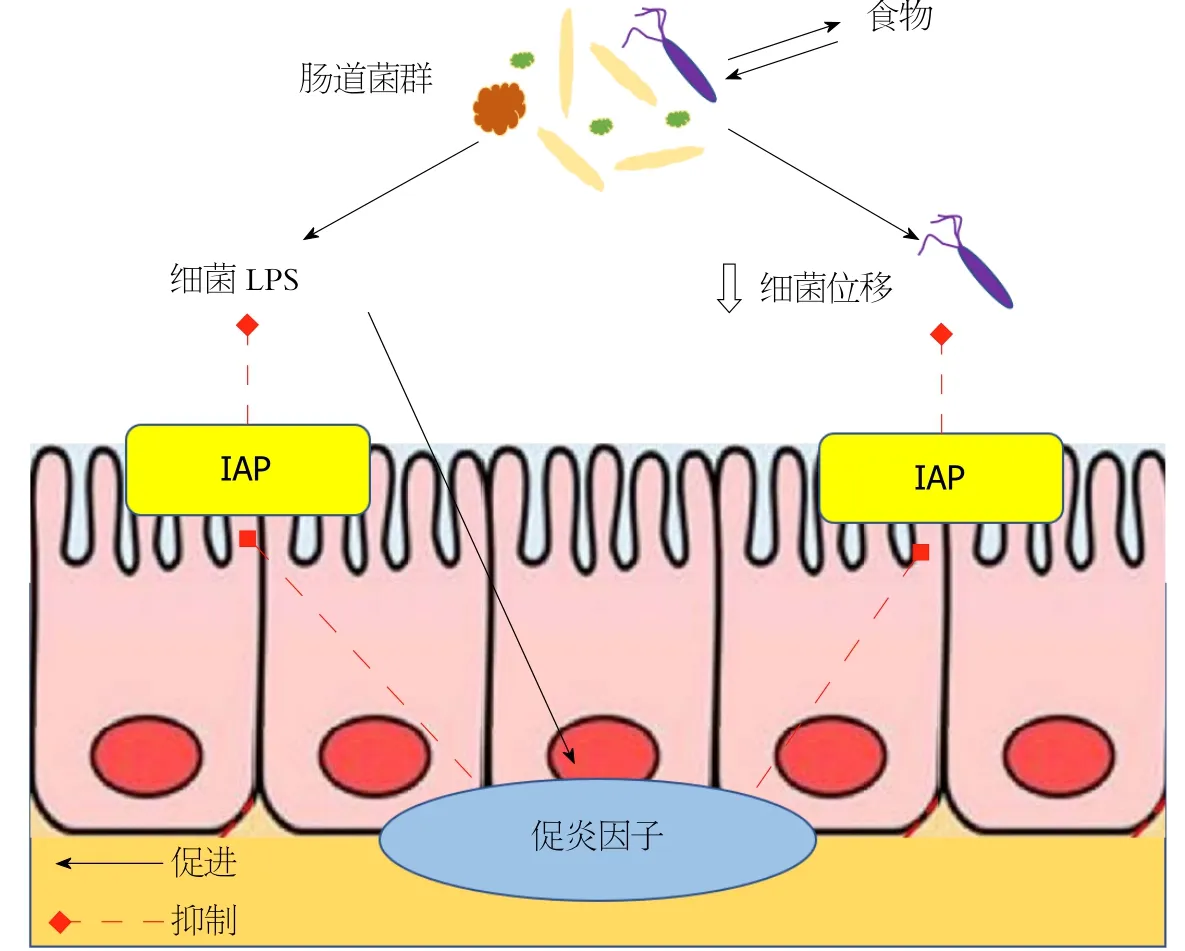
图1 刷状缘IAP对肠道菌群和LPS诱导的炎症的释放的作用机制.炎症状态下, 促炎因子可抑制有保护性作用的IAP的含量和活性.IAP使细菌LPS脱磷, 从而使LPS解毒, 从而阻止下游免疫细胞的激活和炎症反应.IAP对多种细菌的生长和存活有抑制作用, 并能抑制细菌位移.IAP:肠碱性磷酸酶; LPS:脂多糖.
2.3 IAP调节肠黏膜化学屏障 作为肠黏膜屏障中重要的一部分, 化学屏障受损也会增加肠道炎症的易感性.IAP主要在十二指肠中表达, 而空肠和回肠的AKP mRNA水平和酶活性显著降低.IAP的最适pH值>8, 其表达量及酶的活性最高[28], 十二指肠长期暴露在胃液及食糜下,十二指肠上皮细胞通过分泌HCO3-形成十二指肠黏膜pH梯度, 保护十二指肠黏膜[29].而IAP在其调控上可能发挥了重要作用.Mizumori等[30]研究发现, 当黏膜表面pH较低时, 降低了IAP所具有的ATP酶活性, 细胞外堆积的ATP刺激肠上皮细胞分泌HCO3-, 结合肠道内的H+合成碳酸释放CO2, 后者扩散入肠上皮细胞, 在碳酸酐酶的作用下重新合成HCO3-进入肠腔, 升高肠道pH, 同时IAP的ATP酶活性也随之升高.上述实验结论提示IAP作为肠道pH调节的碱性传感器, 在调节肠黏膜化学屏障、在改善肠内酸碱环境维持肠道稳态, 维持肠黏膜屏障功能的关键作用.
2.4 IAP调节肠黏膜生物屏障 肠黏膜生物屏障的完整对维持肠道共生菌稳态及抑制肠道炎症具有重要的作用.IAP在维持肠道共生菌的稳定中表现出了一定的作用, 在调节肠道菌群种类, 抑制菌群位移上发挥作用[31](图1).
LPS存在于肠道细菌的细胞壁, AKP对LPS去磷酸化降低其毒性的能力似乎是一种保守进化的功能, 在最近研究涉及的无脊椎动物鱿鱼-弧菌共生模型共生识别和稳态中也发现了这点.随着人们对动物是由微生物一步步演化发展而来的这一认识越来越清晰[32], 这种生物继续进化的能力造就了动物内源性微生物种群和功能的多样性.事实上, 已有研究证明IAP表达的变化会影响肠道微生物菌群组成[33], Wang等[34]的相关研究发现, 运用荧光标记的两种大肠杆菌予小鼠口服构建腹膜炎模型, 并予以IAP干预, 检测细菌移植, 证实外源性IAP能够抑制腹膜炎模型小鼠炎症反应, 并抑制肠道细菌位移, 同时阐明了IAP发挥作用的分子机制, 检测细胞外调节蛋白激酶(extracellular regulatory protein kinase, ERK)磷酸化水平和ERK-特异性蛋白-1(specificity protein 1,SP-1)-血管内皮生长因子(vascular endothelial growth factor, VEGF)和ERK-尾型同源异型核基因2(caudal type homeobox transcription factor 2, Cdx-2)-紧密连接蛋白2(Claudin-2)通路蛋白的表达水平, 发现IAP抑制了Claudin-2和VEGF的表达, 降低了肠黏膜通透性, 并通过维持肠黏膜屏障功能稳定来抑制肠道菌群位移(图2).
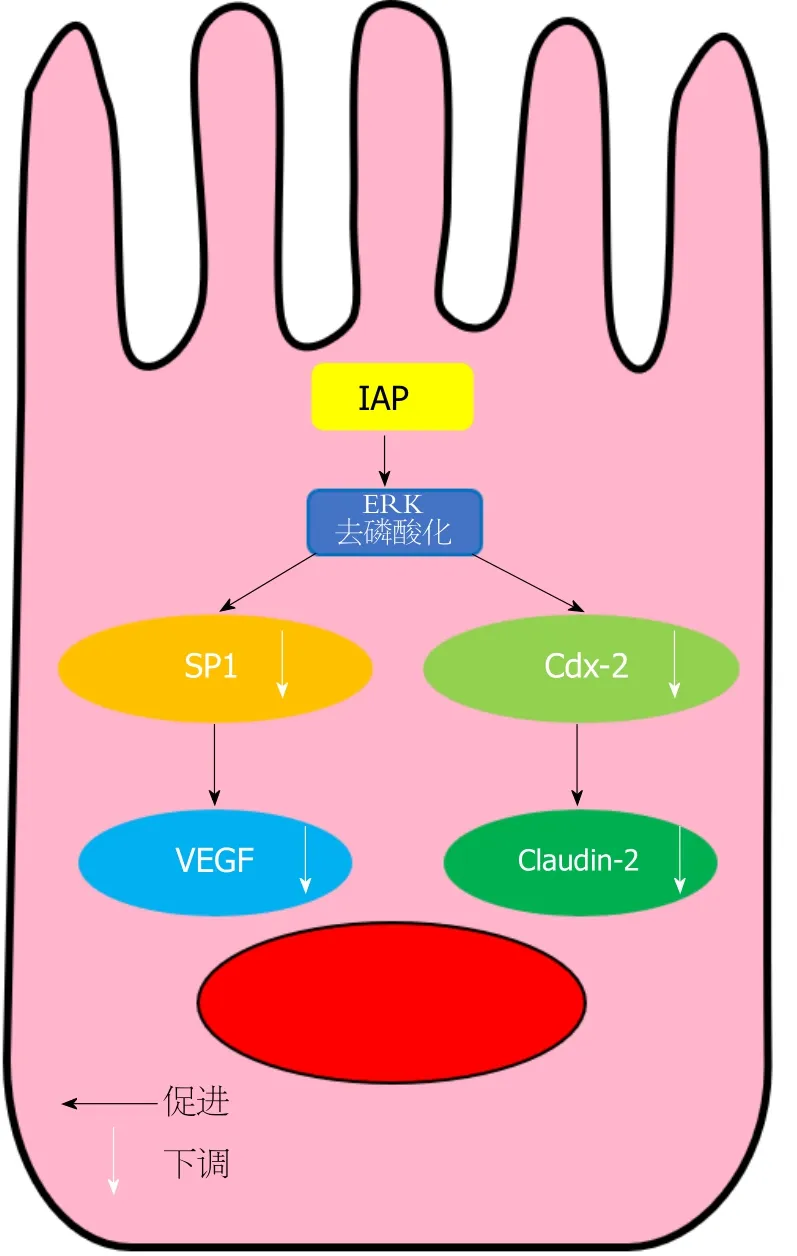
图2 刷状缘IAP发挥作用的分子机制.IAP首先降低ERK磷酸化水平, 进而下调ERK下游的转录因子SP-1.随后SP-1与VEGF启动子的结合减少, 降低VEGF基因启动子的活性, 最终VEGF表达降低.同时,IAP使ERK去磷酸化, 进一步减低下游与Claudin-2启动子结合的尾型同源异型核基因2分子数量, 最终形成通道的Caudin-2蛋白表达下降.IAP:肠碱性磷酸酶; ERK:细胞外调节蛋白激酶; SP-1:特异性蛋白-1; VEGF:血管内皮生长因子; Claudin-2:紧密连接蛋白-2.
Malo等[35]研究发现, IAP基因敲除小鼠, 在肠局部或远处缺血损伤时, 细菌转移到肠系膜淋巴结的数量增加, IAP这一作为肠道黏膜防御因子的特性与肠道微生物群存在潜在相互作用.IAP的作用在于维持肠道微生物群的正常稳态, 具有预防和治疗因致病菌引起的菌群失调和肠道感染的潜力.以上研究均证实IAP在改善肠黏膜生物屏障中发挥了作用, 并为肠道菌群失调提供了新的治疗方向和广阔的思路.
3 结语
IAP在维持肠道黏膜机械屏障、化学屏障、免疫屏障、生物屏障的功能具有重要的作用, 对维持机体健康和肠道微生物稳态发挥重要作用, 同时参与调控肠道营养物质的吸收.然而近年来对IAP的在肠黏膜保护作用机制的研究还不是很多, 具体机制还待继续研究, 相信随着人们对IAP保护肠黏膜屏障作用机制的进一步研究, 会为改善肠道稳态寻找到新的治疗方向, 并提供更多的理论依据和更广阔的思路.

