显微CT设定不同阈值范围对评价生物活性玻璃在体内成骨结果的影响
胡腾龙 杨柳 颉强
生物活性玻璃是一种硅酸盐类人工植骨材料,具有良好的成骨性能和生物力学性能,植入体内后弹性模量与人体骨骼相似且稳定,并且其很多产品已应用于临床,是目前研究较多的植骨材料[1-3]。在分析生物活性玻璃成骨效果时,显微CT是常用的手段之一[4]。
显微CT 能够反应植骨材料植入体内后的三维特点,且分辨率高,能够捕捉到细致的影像学变化。显微CT 结果的影响因素主要有:感兴趣区域(region of interest,ROI)的类型、ROI 选取部位、分割阈值、显微CT 分辨率[5,6]。本研究通过选用不同的阈值范围计算生物活性玻璃的成骨结果,比较不同阈值范围得出的成骨结果的差异,并通过与组织学对比研究,以选取合适的阈值分割范围,为采用显微CT有效评价植骨材料成骨效果奠定实验基础。
材料与方法
一、生物活性玻璃的制备
本实验所使用生物活性玻璃是直径为6 mm,高为8 mm 的圆柱体,主要成分为CaO、SiO2、Na2O、P2O5、MgO 以及少量的CaF2,孔隙率体积百分数为20%~80%,孔径范围为50~600 μm。该材料为空军军医大学西京医院骨科与美国诺邦生物制品有限公司共同研究生产。
二、动物实验
本研究中所进行的动物实验均由空军军医大学西京医院伦理委员会批准。选用6 只SD 雄性新西兰大白兔(购自空军军医大学动物实验中心),兔龄为4~5 个月,平均体重为3 kg。每只新西兰大白兔随机选择一侧股骨髁放置实验材料。
手术时,采用动物麻醉药陆眠宁及3%的戊巴比妥溶液肌肉注射进行麻醉,麻醉成功后,暴露股骨髁部,摆好体位,消毒铺单。放置材料时,沿着股骨纵轴切开皮肤,分离皮下组织及骨膜,完整显露出整个股骨髁,用与材料相同直径的电钻从髁部外侧向内侧钻孔,深度与材料高度相同。然后将无菌的生物活性玻璃植入骨缺损处,放置骨蜡固定材料,逐层缝合髁部切口,术后常规抗感染治疗。
三、显微CT分析
术后3个月,将6只动物安乐死后完整取出植骨材料,保持其外形,放置于标本管中,显微CT(eXplore Locus SP型,GE公司,美国)进行扫描。三维重建处理软件(Microview V2.1.2,GE 公司,美国)以合适参数重建标本,建立实验需要的ROI。Advanced Bone Analysis(ABA)骨骼分析软件(GE 公司,美国)采用不同阈值分割范围分别代表新生骨及剩余材料(表1),6 只动物所取标本各扫描一次,扫描后每个标本采用6种不同阈值范围分别重建6次,并根据阈值范围的不同分为A、B、C、D、E、F 组,作为实验组,计算每组材料内的新生骨体积百分比(bone volume/total volume, BV/TV),分析新骨的生成及骨长入情况。同时计算出剩余材料的体积百分比(RMVF),RMVF=剩余材料的体积/材料总体积×100%,分析植入体内材料3个月内的降解情况。

表1 实验组各个分组的阈值分割范围
四、组织学分析
所有micro-CT 扫描过的材料,梯度酒精脱水处理(70%、90%和100%),聚丙烯酸甲醋(PMMA)包埋后,用硬组织切片机(Reichert-Jung, Leica SP1600,德国)垂直于材料纵轴进行切割,得到材料圆形界面,研磨抛光后进行Van Gieson 染色(Sigm-Aldrich,美国),放置于光学显微镜下观察并随机获取图像,随机选取6例样本中的不同断层来计算结果,用Image-Pro Plus(IPP)5.1图像分析软件(Media Cybernetics 公司,美国)对切片的新生骨面积百分比进行测量和分析,作为对照组。
五、统计学分析
采用SPSS 16.0统计学软件(IBM公司,美国)进行统计分析,所有数据均用均数±标准差(x±s)表示,实验组显微CT 不同阈值成骨结果之间的比较,采用ANOVA 方差分析;显微CT 不同阈值实验组成骨结果与对照组组织学结果之间的比较,采用相关性分析进行统计学分析。以P<0.05为差异有统计学意义。
结 果
一、显微CT结果
如图1所示,红色为新生骨组织,蓝色为剩余材料,蓝色剩余材料能保持圆柱形形态,植骨材料植入股骨髁的内侧成骨较外侧多,且成骨多从植骨材料圆柱形表面开始,随着时间的延长,逐渐向植骨材料圆柱形中心延伸。通过计算,新骨生成量随阈值范围不同逐渐变化,A组新骨生成量最少,逐渐增大,F组新骨生成量最大(图2 a,表2),6组成骨结果之间的差异具有统计学意义(F=16.690,P<0.001)。剩余材料的体积比也随阈值范围不同逐渐变化,A 组最大,逐渐减小,F 组最小(图2 b,表2),6 组剩余材料体积比之间的差异也具有统计学意义(F=16.07,P<0.001)。
二、组织学结果
组织学结果见图3,图3 a为16倍镜下材料的整体圆柱面,仍保持其原有形状,黑色部分代表生物活性玻璃材料,白色为材料孔隙,红色部分为新骨,均匀分布在材料内部。图3 b为100倍镜下,蓝色部分为纤维组织,红色部分为新生成骨组织染色,使用IPP 软件统计分析,对照组新生骨占总面积的百分比为21.33%±1.25%。通过相关性分析,结果显示,实验组A 与对照组呈正相关,相关系数为0.2,P<0.05;实验组B 与对照组呈正相关,相关系数为0.2,P<0.05;实验组C 与对照组呈正相关,相关系数为0.867,P<0.05;实验组D 与对照组呈正相关,相关系数为0.2,P<0.05;实验组E 与对照组呈负相关,相关系数为-0.067,P<0.05;实验组F与对照组呈正相关,相关系数为0.333,P<0.05。实验组C 与对照组之间的相关性最高。
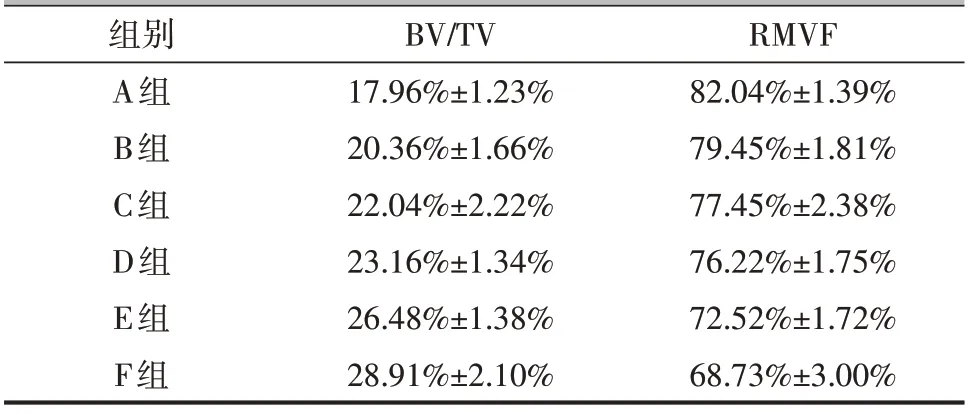
表2 实验组阈值分割后的骨体积分数及剩余材料的体积分数

图1 不同阈值范围分割植骨材料的三维重建 a、b:A组;c、d:B组;e、f:C组;g、h:D组;i、j:E组;k、l:F组
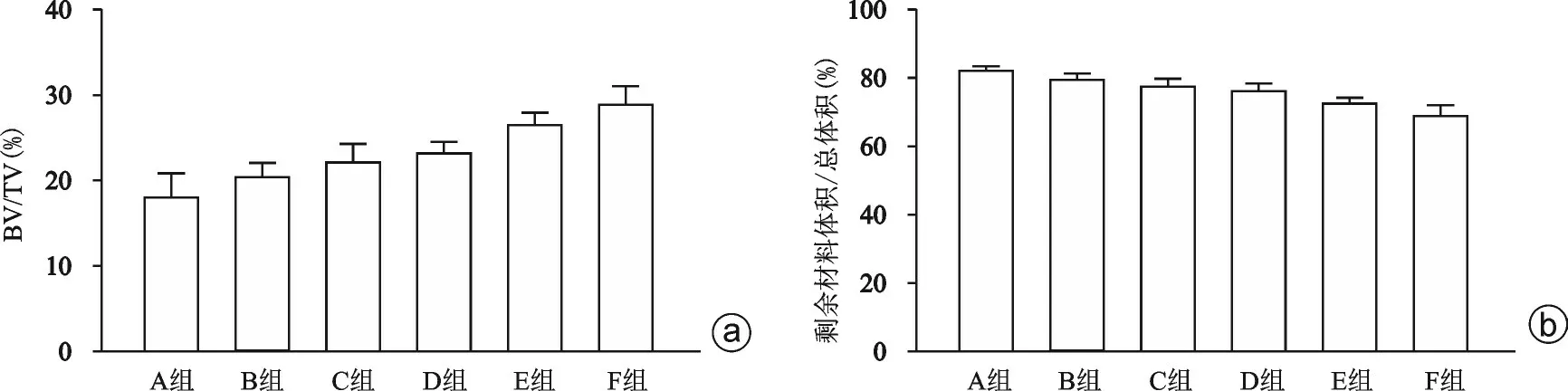
图2 实验各组CT扫描结果 a:各组的新生骨体积百分比(BV/TV);b:各组的剩余材料体积百分比
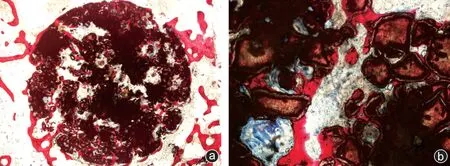
图3 组织学结果 a:显微镜下材料的横断面(Van Gieson染色,×16);b:显微镜下材料的横截面(Van Gieson染色,×100)
讨 论
显微CT能观察标本的三维结构,能从不同层面及角度观察新骨生成情况,对植骨材料成骨能力的分析有着不可替代的作用[7]。尤其是在分析生物活性玻璃成骨及降解性能时,有与其他材料不同之处。生物活性玻璃能与骨组织形成羟基磷灰石层,显微CT可采用不同阈值将其分割加以区分,能更好地判断生物活性玻璃的成骨活性[8]。显微CT 还能判断成骨集中部位及快速降解区域,为我们准确判断材料成骨及降解性能,并判断其他生物学性能及生物力学性能提供帮助。毕龙等[9]建议在采用显微CT分析骨修复效果和骨强度时,只采用单阈值分析会将不成熟的骨组织或其他与骨组织阈值相近的成分(如羟基磷灰石等)当成骨组织进行分析,因此会得出错误的判断及结果,为了更好地评价骨折愈合效果,采用多阈值分析技术更加准确[10],因此显微CT 在骨科基础实验研究中尤其是骨形成的研究中发挥着重要作用。如果阈值范围选择错误,会造成成骨结果的错误判断,直接导致后面的各种无效分析,尤其是在对成骨材料生物活性玻璃的分析中,不仅无法对成骨能力进行分析,其降解性能及形成羟基磷灰石、纤维组织的能力也无法进行正确评估。所以选择合适的阈值对实验结果尤为重要。
本次实验,我们采用不同阈值范围分析材料植入兔体后新生骨组织与剩余材料结果,实验组采用方差分析后,A 组至F 组新骨生成结果及材料降解结果均具有显著差异,表明采用不同阈值范围分析生物活性玻璃新骨生成结果及生物活性玻璃材料降解结果影响较大,不能为我们提供准确有效的判断,突出了阈值范围选择的重要性。
组织学切片是判断新生骨的金标准,因此需要比较组织学结果,通过找到与组织学结果相符合的阈值范围,来确定显微CT 的最佳阈值范围。而通过相关性分析后,C 组的阈值范围(骨组织1 200~2 700、剩余材料≥2 700)分析的生物玻璃新骨生成结果,与组织学结果最为接近,两组之间关联性最高,我们认为C 组代表新骨生成及剩余材料百分比的阈值范围最为准确,将生物活性玻璃材料的阈值确定为2 700 以上,同时根据显微CT 的类型及结合其他研究分析骨组织的阈值范围,确定骨组织的阈值范围为1 200~2 700。可利用C 组阈值范围对其余指标(骨小梁厚度、数量、连接密度等)进行进一步的分析测量。显微CT 最大的优势是能进行空间内部三维结构特征的分析,同时能对被检测对象进行“量”与“质”各种变化的精确测量,而组织切片则能帮助我们对标本局部的细胞形态和生长发育变化进行更为微观层面的解释[11]。在分析骨形成时两者结合不仅能保证实验结果的准确,更能使我们从微观至局部及整体多个方向、不同层面进行评价,更加完美地反映新生骨的形态、结构及分布的特点[12]。
本次实验仅说明了阈值选择的重要性,未做进一步详细研究。但在实际应用当中,应当注意不同阈值的选择对实验结果的影响,尤其是在对成骨材料成骨性能的判断上,要结合组织病理学结果、显微CT类型,准确判断,避免假阳性实验结果。

