分泌性中耳炎病灶组织中伴有Kazal基序富含半胱氨酸的逆转诱导蛋白的表达及其与细胞外基质重塑、骨破坏及细胞凋亡的相关性
姚 宜 张安莹 韩 蓓
(三峡大学第一临床医学院暨湖北省宜昌市中心人民医院耳鼻喉科,宜昌市 443003,电子邮箱:cnmd6032@163.com)
分泌性中耳炎是耳鼻咽喉科的常见疾病,部分患者的慢性炎症迁延不愈,造成中耳炎局部组织的细胞外基质发生重塑,严重者会出现邻近骨破坏、角化细胞凋亡[1-2]。蛋白酶活性的改变是造成细胞外基质异常水解、过度重塑的重要环节[3],但具体的调控机制仍未完全明确。伴有Kazal基序富含半胱氨酸的逆转诱导蛋白(reversion-inducing cysteine-rich protein with Kazal motifs,RECK)是一类抑癌基因,通过抑制蛋白酶活性来促使细胞外基质降解、骨基质破坏、细胞凋亡[4]。本研究探讨分泌性中耳炎病灶组织中RECK表达情况及其与细胞外基质重塑、骨破坏及细胞凋亡的相关性。
1 资料及方法
1.1 临床资料 选择2015年3月至2017年4月在我院进行开放式乳突改良根治手术或完壁式乳突根治手术的58例分泌性中耳炎患者。纳入标准:(1)符合中耳炎的诊断标准[5];(2)符合手术指征;(3)临床资料完整;(4)手术切除的中耳炎病灶组织保留完整。排除标准(1)合并耳部其他病变者;(2)合并恶性肿瘤、全身性骨病者。其中男性31例、女性27例,年龄36~58(48.92±8.21)岁。另取同期因外伤在我院行外耳道成形术的患者44例,均无耳部其他病变及感染,其中男性24例、女性20例,年龄43~59(49.28±10.28)岁,手术后留取正常外耳道上皮组织。分泌性中耳炎患者和外耳道成形术患者的性别、年龄差异均无统计学意义(均P>0.05)。
1.2 方法
1.2.1 RNA的提取及反转录:取适量分泌性中耳炎病灶黏膜上皮组织和正常外耳道上皮组织,加入Trizol裂解液后充分研磨组织,研磨得到的组织液在离心机(赛默飞世尔科技有限公司,型号:micro21R)中以12 000 r/min的速度离心5 min,取上层澄清液体,按照RNA提取试剂盒(北京天根公司,批号:DP431)的说明书提取总RNA。分离得到RNA后,按照反转录试剂盒(北京天根公司,批号:KR118)的说明书合成cDNA。
1.2.2 mRNA表达量的检测:检测以下指标的mRNA表达量,包括RECK、基质金属蛋白酶(matrix metalloproteinase,MMP)2、转化生长因子β1(transforming growth factor β1,TGF-β1)、Smad 2/3、基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase,TIMP)1、TIMP 2、Runt相关转录因子2(Runt related transcription factor 2,RUNX 2)、骨保护素(osteoprotegerin,OPG)、核因子κB受体活化因子(receptor activator of nuclear factor-κ B,RANK)、RANK配体(RANK ligand,RANKL)、第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)、含半胱氨酸的天冬氨酸蛋白水解酶3(cysteine aspartic auc specific proteinase 3,Caspase-3)、Livin、细胞周期蛋白D1(Cyclin D1)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)。取cDNA样本,按照PCR反应试剂盒(上海天根公司,批号:FP209)说明书配置PCR反应体系,包括cDNA 1 μL、试剂盒内的反应混合液10 μL、上游引物0.4 μL、下游引物0.4 μL、去离子水补足至20 μL。PCR反应程序为95℃ 3 min,95℃ 15 s,各基因特异性退火温度20 s,72℃ 25 s,40个循环。仪器为CFX96型实时荧光定量PCR仪(美国Bio-rad公司);在仪器自带的软件中自动生成循环曲线及循环阈值(Ct),以β-actin为内参,按照公式2-△△Ct计算相应基因的mRNA表达量。引物由上海生工公司合成。
1.3 统计学分析 采用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用t检验;计数资料以例数或百分比表示,比较采用χ2检验,相关性分析采用Pearson相关性分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两种组织中RECK mRNA的表达情况 分泌性中耳炎病灶组织中RECK的mRNA相对表达量为0.47±0.07,正常外耳道上皮组织中RECK的mRNA相对表达量为1.04±0.18。分泌性中耳炎病灶组织中RECK相对的mRNA表达量低于正常外耳道上皮组织(t=19.895,P<0.001)。
2.2 两种组织中细胞外基质重塑分子的mRNA表达情况 分泌性中耳炎病灶组织中MMP 2、TGF-β1、Smad 2/3的mRNA相对表达量均高于正常外耳道上皮组织,而TIMP 1、TIMP 2的mRNA相对表达量均低于正常外耳道上皮组织(均P<0.05),见表1。分泌性中耳炎病灶组织中RECK mRNA相对表达量与MMP 2、TGF-β1、Smad 2/3 mRNA相对表达量呈负相关(r=-0.324、-0.291、-0.236,P=0.008、0.013、0.022),与TIMP 1、TIMP 2 mRNA相对表达量呈正相关(r=0.288、0.382,P=0.014、0.001)
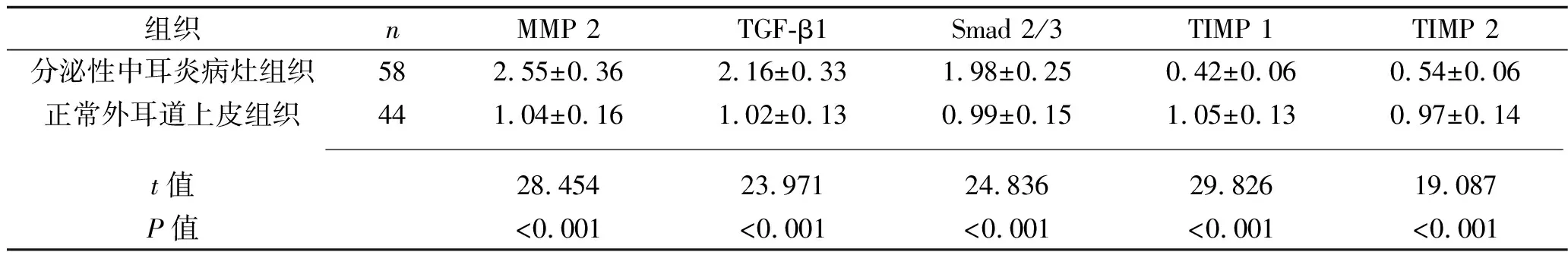
表1 两种组织中细胞外基质重塑分子mRNA相对表达量的比较(x±s)
2.3 两种组织中骨破坏分子mRNA的表达情况 分泌性中耳炎病灶组织中RUNX 2、OPG的mRNA相对表达量均低于正常外耳道上皮组织,而RANK、RANKL的mRNA相对表达量均高于正常外耳道上皮组织(均P<0.05),见表2。分泌性中耳炎病灶组织中RECK的mRNA相对表达量与RUNX 2、OPG的mRNA相对表达量呈正相关(r=0.293、0.231,P=0.018、0.024),与RANK、RANKL的mRNA相对表达量呈负相关(r=-0.212、-0.308,P=0.030、0.011)。

表2 两种组织中骨破坏分子mRNA相对表达量的比较(x±s)
2.4 两种组织中细胞凋亡基因mRNA的表达情况 分泌性中耳炎病灶组织中PTEN、Caspase-3的mRNA相对表达量均高于正常外耳道上皮组织,而Livin、Cyclin D1、PCNA的mRNA相对表达量均低于正常外耳道上皮组织(P<0.05),见表3。分泌性中耳炎病灶组织中RECK的mRNA相对表达量与PTEN、Caspase-3的mRNA相对表达量呈负相关(r=-0.393,P<0.001;r=-0.198,P=0.039),与Livin、Cyclin D1、PCNA的mRNA相对表达量呈正相关(r=0.282,P=0.018;r=0.341,P=0.002;r=0.387,P<0.001)。
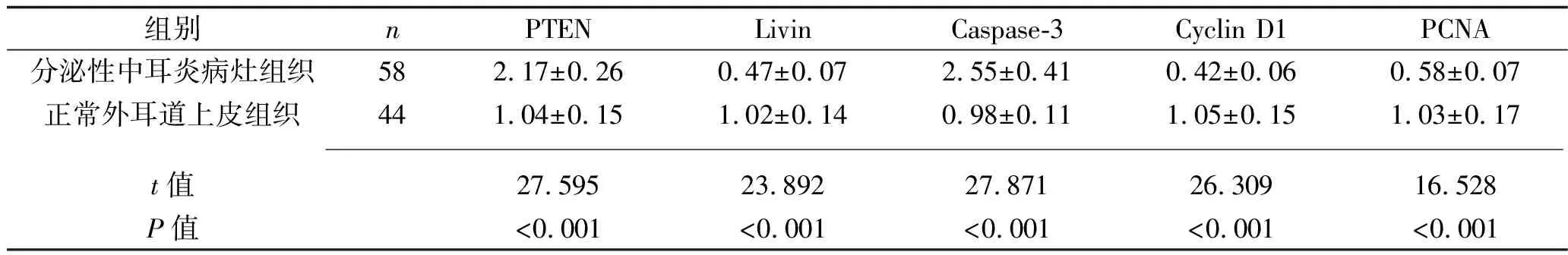
表3 两种组织中细胞凋亡基因mRNA相对表达量的比较(x±s)
3 讨 论
分泌性中耳炎迁延不愈为慢性疾病后会导致炎症周围组织发生细胞外基质重塑,严重者会出现邻近骨质的破坏以及角化细胞的凋亡。其中,骨质破坏不仅会影响听骨链的功能并造成患者听力损害,还会促进慢性炎症对颅底骨质的破坏,并增加颅内感染等严重并发症的发生概率;而角化细胞的凋亡则会造成中耳局部角化碎屑堆积并影响听力[6-7]。蛋白酶活性的改变是造成细胞外基质异常水解、过度重塑的重要病理环节,也能对骨基质进行水解并造成骨破坏[8]。目前,关于分泌性中耳炎局部组织中蛋白酶活性改变的调控机制仍未完全明确。RECK是近年来发现的蛋白酶抑制分子,其能够直接降低蛋白酶的水解活性,同时也能阻碍蛋白酶在局部组织的锚定,并抑制蛋白酶的水解活性[9-10]。本研究结果显示,分泌性中耳炎病灶组织中RECK mRNA的表达量低于正常外耳道上皮组织(P<0.05),这说明RECK的低表达与分泌性中耳炎的发生存在密切关系。结合RECK的生物学活性,我们推测RECK的低表达能够使蛋白酶活性增加,进而促进中耳炎局部组织发生细胞外基质重塑以及骨质破坏。
分泌性中耳炎局部组织的重塑依赖于多种蛋白酶及细胞因子的生物学活性,其中MMP 2是具有强大水解作用的MMP,能够使细胞间基质内的弹性蛋白、胶原蛋白、层粘连蛋白均发生过度水解,进而促进了组织重塑的过程[11];TIMP 1和TIMP 2则是MMP的特异性抑制分子,通过与MMP 2形成共价结合后降低其水解活性,进而对细胞外基质的重塑过程产生抑制作用[12-13]。TGF-β1是介导细胞外基质重塑关键的细胞因子,能够通过Smad 2/3进行信号转导,并促进细胞外基质发生异常沉积,加剧了组织重塑[14]。本研究结果显示,分泌性中耳炎病灶组织中MMP 2、TGF-β1、Smad 2/3 mRNA的表达量均高于正常外耳道上皮组织,而TIMP 1、TIMP 2 mRNA的表达量均低于正常外耳道上皮组织(均P<0.05)。这说明细胞外基质重塑促进分子的高表达、抑制分子的低表达与分泌性中耳炎的发生密切相关。此外,分泌性中耳炎病灶组织中RECK mRNA的表达量与MMP 2、TGF-β1、Smad 2/3 mRNA的表达量呈负相关,与TIMP 1、TIMP 2 mRNA的表达量呈正相关(均P<0.05)。这提示分泌性中耳炎患者局部组织中低表达的RECK能够增强细胞外基质重塑促进分子的活性,抑制细胞外基质重塑抑制分子的活性,进而在分泌性中耳炎发展过程中促进局部组织的细胞外基质重塑。
分泌性中耳炎局部组织发生细胞外基质重塑会进一步造成炎症扩散并引起骨质破坏,蛋白酶水解活性的增加会直接破坏骨基质内的胶原成分,同时也会影响成骨细胞及破骨细胞的活性[15]。成骨细胞介导的骨形成以及破骨细胞介导的骨吸收,在骨质完整性的调控中发挥了至关重要的作用:当破骨细胞活性超过成骨细胞时,骨吸收过程强于骨形成过程,从而造成了骨质破坏。RUNX 2是调控成骨细胞分化成熟的关键转录因子,能够调节多种成骨标志基因的表达并促进间充质细胞向成骨细胞分化。OPG/RANKL/RANK是调控成骨/破骨平衡的通路,其中RANKL是破骨细胞表面受体RANK的配体,两者结合后能够通过下游信号转导来增强破骨细胞的活性;OPG是成骨细胞分泌的活性蛋白,能够与RANKL竞争性结合RANK并阻碍破骨细胞的活化[16-17]。本研究结果显示,分泌性中耳炎病灶组织中RUNX 2、OPG mRNA的表达量低于正常外耳道上皮组织,而RANK、RANKL mRNA的表达量均高于正常外耳道上皮组织(均P<0.05)。这说明成骨细胞标志分子的低表达、破骨细胞标志分子的高表达与分泌性中耳炎的发生密切相关。此外,分泌性中耳炎病灶组织中RECK mRNA的表达量与RUNX 2、OPG mRNA的表达量呈正相关,与RANK、RANKL的mRNA表达量呈负相关(均P<0.05)。这提示分泌性中耳炎局部组织中RECK的低表达能够抑制成骨细胞活性、增强破骨细胞活性,进而促进了骨破坏。
在分泌性中耳炎的发展过程中,局部炎症的扩散还会造成邻近的角化细胞损伤及脱落,进而造成中耳腔内大量角化鳞屑堆积。细胞凋亡是造成角化细胞损伤的重要病理环节,该环节受到多种促凋亡基因及凋亡抑制基因的调控。PTEN是重要的促凋亡基因,具有磷酸酶活性,能够使细胞外调节蛋白激酶通路、磷脂酰肌醇3-激酶/蛋白激酶B通路中的多种信号分子去磷酸化,进而降低信号通路的活性,并阻碍细胞增殖、促进细胞凋亡[18]。Livin是具有广泛凋亡抑制活性的分子,能够阻碍凋亡级联激活通路中多种分子的激活,进而抑制Caspase-3的激活及其所介导的细胞凋亡。Cyclin D1和PCAN是在细胞增殖过程中发挥正性调控作用的分子,前者能够加速细胞周期,而后者能够加速DNA复制,两者通过对细胞增殖的促进作用来实现对细胞凋亡的抑制。本研究结果显示,分泌性中耳炎病灶组织中PTEN、Caspase-3 mRNA的表达量均高于正常外耳道上皮组织,而Livin、Cyclin D1、PCNA mRNA的表达量均低于正常外耳道上皮组织(均P<0.05)。这说明促凋亡基因的高表达、凋亡抑制基因的低表达与分泌性中耳炎的发生密切相关。此外,分泌性中耳炎病灶组织中RECK mRNA的表达量与PTEN、Caspase-3 mRNA的表达量呈负相关,与Livin、Cyclin D1、PCNA mRNA的表达量呈正相关(均P<0.05)。表明分泌性中耳炎病灶组织中低表达的RECK能够促进细胞凋亡。
综上所述,分泌性中耳炎病灶组织中RECK呈低表达,而这或可促进细胞外基质重塑、骨质破坏及细胞凋亡的发生。
——外耳道成形技术进展

