异体输血诱发巨噬细胞分化失调对糖尿病大鼠创面愈合的影响▲
朱荣誉 向 俊 姚娜娜 吴帮林 叶 刚
(湖北省恩施土家族苗族自治州中心医院麻醉科,恩施市 445000,电子邮箱:Liuzitong771702@163.com)
研究表明,异体输血对受者的免疫功能具有抑制作用,可引起感染、原发疾病复发以及器官移植耐受性降低等,从而导致患者死亡率增高[1]。来源于骨髓干细胞的巨噬细胞作为非特异性免疫细胞,是机体抵御有害刺激的一道重要防线,其主要功能是以固定细胞或游离细胞的形式对细胞残片及病原体发挥噬菌作用(即吞噬以及消化),并激活淋巴细胞或其他免疫细胞使其对病原体做出反应[2-4]。而炎症是机体对刺激的一种防御反应,巨噬细胞作为炎症阶段的主要吞噬细胞,在多种急慢性炎症性疾病中发挥多种免疫作用,负责清除机体损伤处组织和细胞的坏死碎片以及病原体等,这些物质对创伤愈合过程有重要的调控作用[3-5]。M1型巨噬细胞通过释放抵抗素,促进肝脏、骨骼肌和脂肪组织慢性炎症的形成。M2型巨噬细胞与M1型巨噬细胞存在拮抗作用,在生理情况下,脂肪细胞和肝细胞能够通过生成白细胞介素(interleukin,IL)-4和IL-13诱导巨噬细胞向M2型巨噬细胞分化;但在病理情况下,M1型和M2型巨噬细胞失衡可引发组织炎症和代谢功能障碍,从而促进胰岛素抵抗。脂肪组织内的M2型巨噬细胞与铁代谢有关,而脂肪细胞铁过载会加重全身性胰岛素抵抗[6-8]。巨噬细胞作为伤口愈合的重要防线,在糖尿病患者的伤口愈合中发挥重要作用。然而,目前尚不清楚在异体输血所致巨噬细胞分化失调的情况下,糖尿病患者伤口的愈合情况。因此,本研究建立糖尿病大鼠创面模型,模拟异体输血引起的巨噬细胞分化失调,观察其对糖尿病大鼠创面的愈合情况的影响,并初步探讨可能的机制。
1 材料与方法
1.1 实验动物 无感染C57BL/6野生型雄性小鼠购自北京大学动物试验中心[动物许可证号:SCXK(京)2016-0001],6~8周龄,体重(20.0±2.1)g;雄性SD大鼠购自北京大学动物试验中心[动物许可证号:SCXK(京)2016-0001],8~12周龄,体重(30.3±5.6)g。喂养要求:室温,相对湿度控制于50%左右,12 h光照与12 h黑夜交替,每天正常自由饮水进食,所有大小鼠正常活动。本研究已获得我院伦理委员会批准。
1.2 试剂与仪器 链脲佐菌素(美国Sigma公司,批号:XT10265),巨噬细胞集落刺激因子(美国Sigma公司,批号:AB44527),脂多糖(美国Sigma公司,批号:L2880),干扰素(interferon-γ,IFN-γ;美国Sigma公司,批号:170524),IL-4抗体(美国Sigma公司,批号:170601),IL-3抗体(美国Sigma公司,批号:170603),生物素化山羊抗小鼠IgG(美国Santa Cruz公司,批号:SC81692),完全培养基(美国Gibco公司,批号:12633-012),Trizol试剂(日本Takara公司,批号:CD-10252),PrimeScriptTMRT试剂盒(日本Takara公司,批号:DRR041A),实时SYBR Green qPCR Master Mix(日本Takara公司,批号:AK3902B),兔抗IL-12β抗体(美国Santa Cruz公司,批号:2017-AASTA152),兔抗诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体(美国Santa Cruz公司,批号:2018-01236950),兔抗肿瘤坏死因子(tumor necrosis factor-α,TNF-α)抗体(美国Santa Cruz公司,批号:2018-AABGH5690),β-肌动蛋白(美国Santa Cruz公司,批号:2017-AAAST863),辣根过氧化物酶(horseradish peroxidase,HRP)结合二级抗体(美国Santa Cruz公司,批号:2018FGO56742)。Hyperfilm X光片(美国GE公司),7500型实时荧光定量PCR仪(美国ABI公司),Cx31型显微镜(日本Olympus公司)。
1.3 糖尿病大鼠模型及大鼠创面模型的建立 (1)糖尿病大鼠模型:SD大鼠经饲养1周后,检测尾静脉随机血糖,去除血糖异常(空腹血糖>7.5 mmol/L)的大鼠。选取60只大鼠称重后,一次性腹腔注射经pH为4.2~4.5柠檬酸缓冲液稀释的链脲佐菌素(5 mg/mL),注射剂量为50 mg/kg。72 h后经尾静脉采血检测血糖,血糖值>16.7 mmol/L的大鼠进入下一步实验。分别于造模1、3及8周后再次检测尾静脉随机血糖,血糖值持续>16.7 mmol/L达8周者视为糖尿病大鼠模型建模成功。建模期间,所有大鼠正常饮食,适当供给蛋白质。除去造模过程中血糖恢复或因血糖波动死亡的大鼠,最终纳入45只建模成功的大鼠(糖尿病组)以建立创面模型。另取45只血糖正常的健康SD大鼠作为健康组。(2)大鼠创面模型: 一次性腹腔注射5%水合氯醛(麻醉剂量为6 mL/kg)以麻醉两组大鼠,消毒大鼠背部皮肤,在大鼠背部距颅后线3.5 cm正中处,用亚甲蓝标记出面积为1 cm2的正方形手术区域,去皮并用纱布压迫止血。数码照相后贴膜覆盖,胶布固定包扎。大鼠苏醒并自主活动后进行单只单笼饲养。
1.4 异体红细胞悬液的制备以及异体输血 取10只SD大鼠,用手术镊夹取大鼠眼球进行眼眶采血,取出全血约5 mL/只。用无菌注射器将收集到的全部大鼠血液(约50 mL)推入一次性去白细胞滤器血袋中。将去白细胞后的红细胞悬液,以1 800 rpm离心10 min,去除上清液后,加入红细胞保存液,全血与保存液体积比为4 ∶1,即制成红细胞悬液。取20只C57BL/6野生型小鼠,腹腔注射异体浓缩红细胞悬液(2 mL/只)。
1.5 髓源性巨噬细胞的培养 注射异体浓缩红细胞悬液后3 d断颈处死20只C57BL/6野生型小鼠,将双侧股骨和腔骨分离后清除残留肌肉和关节,用含2%胎牛血清的磷酸缓冲盐溶液(phosphate buffered saline,PBS)收集骨髓,制成单细胞悬液,4℃下1 800 rpm离心15 min后弃去上清液;用含有10 ng/mL巨噬细胞集落刺激因子的完全培养基6 mL重悬小鼠骨髓细胞,接种至5 cm平皿中并于37℃的CO2恒温培养箱中培养;4 d后,PBS清洗两次,加入新的含有巨噬细胞集落刺激因子的完全培养基,培养7d后获得髓源性巨噬细胞(bone marrow derived macrophage,BMDM)。
1.6 诱导巨噬细胞分化 向BMDM中加入10 ng/mL脂多糖和10 ng/mL IFN-γ各100 μL后将细胞移入CO2恒温培养箱中培养1~3 d,即可诱导巨噬细胞向M1型巨噬细胞分化,参考文献[9]判断细胞分化成功与否。向分化成熟的M1型巨噬细胞中加入10 ng/mL IL-4和10 ng/mL IL-3各100 μL后将细胞移入CO2恒温培养箱中培养1~3 d,即可诱导巨噬细胞向M2型巨噬细胞分化。于创面模型建造成功当天,通过尾静脉向每只大鼠体内注入1 mL向M1型巨噬细胞分化的BMDM悬液(含1×106个巨噬细胞),隔天通过尾静脉向每只大鼠体内注入1 mL向M2型巨噬细胞分化的BMDM悬液(含1×106个巨噬细胞)。
1.7 创面取材 在创面形成后5、10、15 d,每组采用随机数字表法随机选取15只大鼠进行麻醉并切取部分创面组织,用10%福尔马林固定组织,用于后续形态学观察及免疫学检测,切取其余创面组织置于-80℃冻存行分子生物学检测。
1.8 观察指标
1.8.1 创面愈合率:在创面形成后5、10、15 d,处死大鼠前,采用透明膜描记法观测创面面积,记录两组大鼠创面愈合情况,计算创面愈合率。创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%。
1.8.2 创面组织炎症细胞浸润情况:组织切片脱蜡水化后烘烤1~2 h,苏木精染色5 min,自来水冲洗后伊红染色40 s,自来水继续冲洗5 min后脱水、透明、中性树胶封片。在显微镜下观察创面组织中炎症细胞浸润情况,每张切片随机计数5个高倍视野下炎症浸润细胞(将染色为褐色的细胞判定为阳性细胞)数量,取平均值。
1.8.3 巨噬细胞表型标志物CD68+的检测:组织切片脱蜡水化后烘烤1~2 h,将切片浸入pH为6.0的枸橼酸盐缓冲液,微波加热冷却后,PBS洗涤并滴加生物素化山羊抗小鼠IgG,苏木素轻度复染,脱水、透明并封片,光学显微镜下每张切片随机计数5个高倍视野下CD68+细胞(将染色为褐色的细胞判定为阳性细胞)数目,取平均值。
1.8.4 创面组织中炎症因子mRNA的检测:采用Trizol法提取创面组织总RNA。用分光光度法和1%琼脂糖凝胶电泳测定RNA的浓度和纯度。利用PrimeScriptTMRT试剂盒和寡核苷酸引物将提取的RNA反转录为cDNA,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用实时SYBR Green qPCR Master Mix进行实时定量PCR。引物序列见表1。反应体系为20 μL,包括10 μL SYBR预混物Ex Taq、上下游引物(10 μmol/L)各0.4 μL、2 μL cDNA和7.2 μL的无核酸酶水。在95℃反应30 s后,进行40个PCR循环,每个循环包括变性(95℃,5 s)和退火(60℃,30 s)。采用2-△△CT法分析IL-12β、iNOS、TNF-α mRNA的表达量。

表1 引物序列
1.8.5 创面组织中炎症因子蛋白含量的测定:取创面组织,加入细胞裂解液匀浆25 min,8℃下以10 000 rpm/min离心20 min,取上清液,并采用二喹啉甲酸法测定蛋白质浓度。在12%十二烷基硫酸钠-聚丙烯酰胺凝胶上加载等量(每道40 μg)蛋白质,在70 V的恒定电压下电泳30 min,然后在120 V下电泳90 min,最后在300 mA下将蛋白转移到聚偏氟乙烯膜。用5%脱脂乳在20℃封闭膜2 h,然后加入兔抗IL-12β抗体(1 ∶500)、兔抗iNOS抗体(1 ∶500)、兔抗TNF-α抗体(1 ∶2 000)和β-肌动蛋白(1 ∶4 000)抗体,37℃孵育过夜。在TBS中清洗3次,并在室温下用适当的HRP结合二级抗体(1 ∶5 000)孵育2 h后,在X光片上用ECL检测观察条带。
1.9 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料采用(x±s)表示,两组均数比较采用t检验或t′检验,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料采用例数(百分比)表示,组间比较采用χ2分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同时点两组大鼠伤口愈合情况比较 随着观察时间的延长,两组大鼠的创面愈合率均有升高趋势(均P<0.05);在不同时间点,糖尿病组大鼠的创面愈合率均低于健康组大鼠(均P<0.05)。见表2及图1。

表2 不同时间点两组大鼠创面愈合率比较(x±s,%)
注:与同组5 d比较,*P<0.05;与同组10 d比较,#P<0.05。
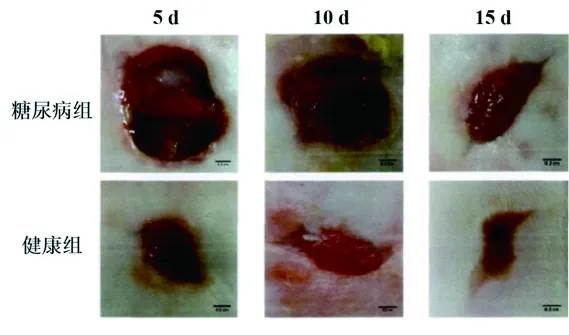
图1 不同时间点大鼠创面愈合情况
2.2 不同时间点两组大鼠创面组织炎症浸润情况比较 创面形成后5 d时,糖尿病组创面组织中炎症浸润细胞计数少于健康组,而在创面形成后10、15 d,其创面组织中炎症浸润细胞计数多于健康组(均P<0.05)。随着时间延长,健康组创面组织中炎症浸润细胞计数逐渐减少,而糖尿病组的计数逐渐升高(均P<0.05)。见表3及图2。

表3 不同时间点两组大鼠创面组织炎症浸润细胞计数比较(x±s,个/高倍镜视野)
注:与同组5 d比较,*P<0.05;与同组10 d比较,#P<0.05。
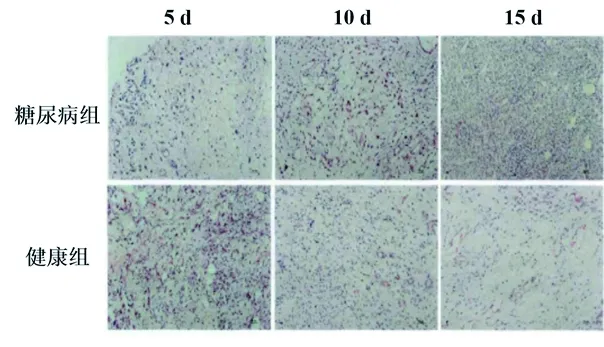
图2 不同时间点两组大鼠创面炎症细胞浸润情况(苏木精-伊红染色,×200)
2.3 两组大鼠创面组织CD68+染色结果 创面形成后5 d,糖尿病组大鼠创面组织CD68+细胞数量少于健康组;创面形成后10 d,两组大鼠创面内均可见大量CD68+细胞浸润,其中糖尿病组的细胞浸润数量多于健康组;创面形成后15 d,两组创面组织CD68+细胞数量较建模后5 d时有所下降,但糖尿病组的细胞浸润数量仍多于健康组。见图3。

图3 不同时间点两组大鼠创面组织CD68+免疫组织化学染色结果(×400)
2.4 两组创面组织中IL-12β、iNOS、TNF-α mRNA表达水平比较 创面形成后5 d时,糖尿病组IL-12β、iNOS、TNF-α的mRNA表达量均低于健康组(均P<0.05);创面形成后10 d,糖尿病组IL-12β、iNOS的mRNA表达量均高于健康组(均P<0.05),而TNF-α的mRNA表达量低于健康组(均P<0.05);创面形成后15 d,糖尿病组的IL-12β、iNOS、TNF-α的mRNA表达量均高于健康组(均P<0.05)。见表4。
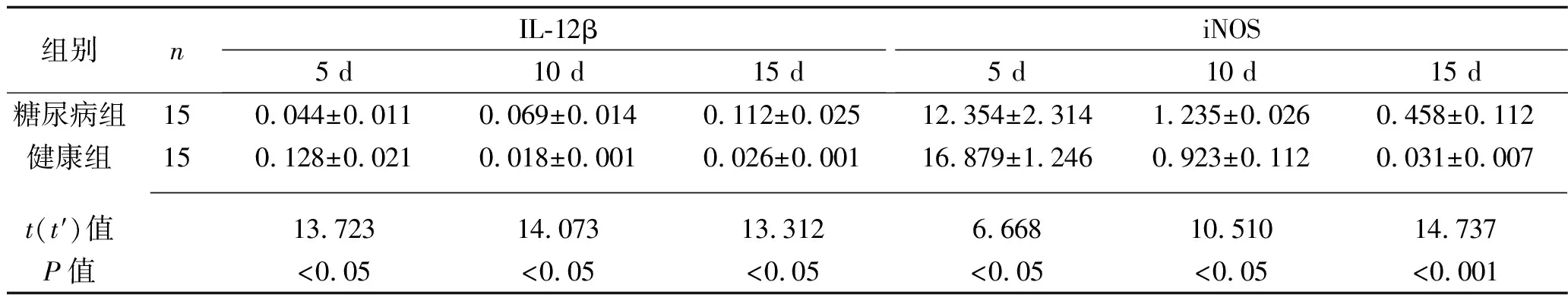
表4 两组创面组织IL-12β、iNOS、TNF-α的mRNA相对表达量比较(x±s)
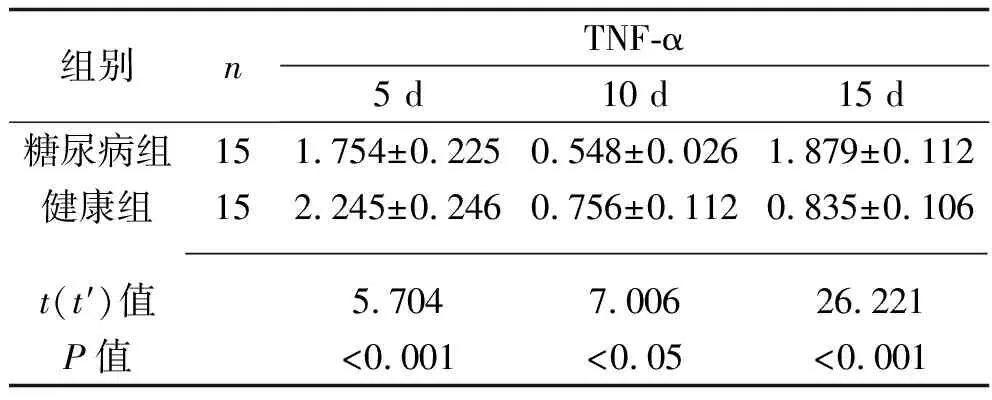
组别nTNF-α5 d10 d15 d糖尿病组151.754±0.2250.548±0.0261.879±0.112健康组152.245±0.2460.756±0.1120.835±0.106 t(t′)值5.7047.00626.221P值<0.001<0.05<0.001
2.5 两组大鼠创面组织中IL-12β、iNOS、TNF-α蛋白表达水平比较 创面形成后5 d时,糖尿病组IL-12β、iNOS、TNF-α的蛋白表达量均低于健康组(均P<0.05);创面形成后10 d,糖尿病组IL-12β、iNOS的蛋白表达量均高于健康组(均P<0.05),而TNF-α的蛋白表达量低于健康组(均P<0.05);创面形成后15 d,糖尿病组的IL-12β、iNOS、TNF-α的蛋白表达量均高于健康组(均P<0.05)。见图4及表5。

表5 两组创面组织IL-12β、iNOS、TNF-α蛋白表达水平的比较(x±s)

组别nTNF-α5 d10 d15 d糖尿病组15952.62±55.29112.89±12.63529.15±48.75健康组151 220.26±91.36558.63±82.37459.68±67.52 t(t′)值 9.70720.7163.231P值<0.0010.0010.003
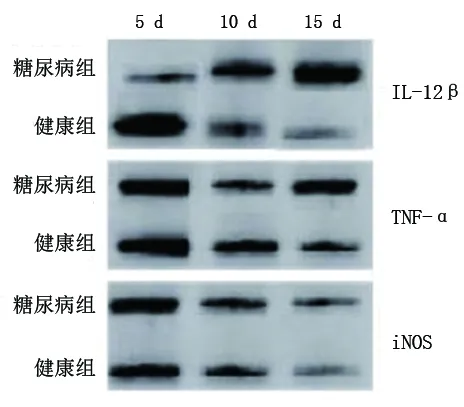
图4 各时间点两组大鼠创面组织中IL-12β、iNOS、TNF-α蛋白表达水平
3 讨 论
随着生活节奏日益加快,糖尿病患者数量逐年增多[9]。糖尿病患者一旦出现伤口,则容易导致感染等并发症,严重者会导致组织坏死甚至死亡[10-12]。研究表明,糖尿病患者发生皮肤溃疡与免疫系统有关[13-16],在该过程中,炎症因子增加,抗炎症因子减少[17]。巨噬细胞作为伤口愈合的重要防线,既可清除异物,又可促进伤口的愈合。巨噬细胞在某些刺激物如抗原等的刺激下,会出现分化失调,从而导致伤口愈合缓慢。而异体输血则会引起巨噬细胞分化失调[18-20]。本研究中,两组大鼠输注分化失调的BMDM悬液后,创面愈合率均随着观察时间的延长而升高,其中在创面形成15 d时健康组大鼠的平均愈合率已达93.23%,提示异体输血发生巨噬细胞分化失调后正常大鼠创面的愈合仍属正常;但在不同时间点糖尿病组大鼠的创面愈合率均低于健康组大鼠(均P<0.05),这提示异体输血造成的巨噬细胞分化失调会对糖尿病大鼠伤口的愈合造成不利影响。
研究表明,巨噬细胞与中性粒细胞相互作用后导致中性粒细胞凋亡,巨噬细胞吞噬凋亡的中性粒细胞后发挥相应的抗炎作用,促进创面组织愈合,其中腺苷单磷酸活化蛋白激酶α1在该过程中发挥重要作用[21]。然而,当炎症处于低氧环境时,能使单核细胞发生经典型活化而成为M型巨噬细胞[22],从而影响创面的愈合。另外,巨噬细胞和炎症因子的比例也会因为外界环境的刺激而发生变化,而促炎症反应介质的释放可影响巨噬细胞对炎症反应的调节作用。本研究结果显示,随着时间延长,健康组创面组织中炎症浸润细胞计数逐渐减少,而糖尿病组逐渐升高,且与健康组大鼠相比,糖尿病组大鼠创面组织中炎症浸润细胞数量、炎症因子IL-12β、TNF-α及iNOS的水平均呈早期(创面形成后5 d)减少晚期(创面形成后15 d)增多趋势。这提示异体输血造成的巨噬细胞分化失调,可导致糖尿病大鼠创面持续存在炎症反应。正常创面的愈合过程主要包括炎症反应期、细胞增殖期以及组织修复期。而糖尿病大鼠由于受到病理影响而导致创面愈合过程减缓甚至停滞,通常表现为创面炎症反应的发生而导致细胞增殖异常,进而影响组织修复。此外,在创面愈合过程中,糖尿病组大鼠CD68+细胞早期(创面形成第5天时)进入创面的数量少于健康组大鼠,但在第10、15天时其CD68+细胞数量均多于健康组大鼠,提示在创面愈合晚期巨噬细胞持续停留于糖尿病大鼠创面。巨噬细胞是创面愈合主要防线,但异体输血时可发生M1型和M2型细胞分化失调,引起腺苷单磷酸活化蛋白激酶α1分泌发生异常,进一步加大了创面愈合的难度。
综上所述,异体输血诱发巨噬细胞分化失调时,对正常大鼠创面的愈合无影响,但会对糖尿病大鼠伤口的愈合造成不利影响,这可能与其创面持续存在炎症反应及巨噬细胞功能异常有关。因此,对于糖尿病患者进行异体输血时临床应严格把握输血指征,避免不必要的输血,同时提倡成分输血,避免全血输注。

