穿心莲内酯对食管癌细胞的放射增敏作用
康亚辉,葛宁,洪福,王娟,周庆,詹必红
食管癌是世界上常见的恶性肿瘤之一,病死率占整个恶性肿瘤死亡的第6位[1],而我国又是食管癌的高发国家之一,其发病人数占全世界50%以上[2],在全国恶性肿瘤死亡总数中占了22.34%[3],病死率为世界最高。食管癌主要类型仍是鳞癌,侵袭性强,预后差。近年来采用术后精确放疗配合化疗,食管癌5年生存率提高到25%[4]。已有报道穿心莲内酯(andrographolide)具有抗黑色素瘤(B16F-10)、结肠癌(HT-29)[5]和食管癌(EC9706)[6-7]的作用。本实验于2017年5月至2018年2月主要研究穿心莲内酯对ECA-109细胞的增殖抑制作用,迁移和放射敏感性的影响及可能的相关机制。
1 材料与方法
1.1 主要试剂含10%新生牛血清、胰蛋白酶、完全型RPMI 1640培养基均购于美国Gibco公司,穿心莲内酯购于南京植朗公司(纯度>98%),羊抗兔二抗、4′,6-二脒基-2-苯基吲哚(DAPI)染色试剂盒、四甲基偶氮唑盐(MTT)、标准蛋白质分子量、十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)上样缓冲液、RIPA蛋白裂解液、TE电泳缓冲液、10×Western转膜缓冲液、30%(丙烯酰胺/甲叉双丙烯酰胺预混液)Acry-Bis、(三羟甲基氨基甲烷)Tris-HCl、过硫酸铵(AP)、SDS、四甲基乙二胺(TEMED)、碘化丙啶(PI)均购于海门碧云天生物技术研究所,B淋巴细胞瘤-2基因(Bcl-2)及核因子κB(NF-κB)单克隆抗体、驴抗兔-PE藻红蛋白标记荧光二抗购于美国Santa Cruz公司,(半胱氨酸天冬氨酸蛋白酶-3)caspase-3多克隆抗体购自谷歌生物,促凋亡蛋白Bax多克隆抗体购自美国Epitomics公司,甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自美国BIOWORLD公司,膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/PI双染色法流式细胞检测试剂盒购于南京凯基生物科技发展有限公司,抗磷酸化组蛋白H2AX(γ-H2AX)兔多克隆抗体购于美国Millipore公司,羊抗兔-FITC二抗购于南京海普乐生物科技中心。
1.2 主要仪器倒置显微镜(日本Olymbus公司,CKX41-C31BF),酶标仪(美国Bio Rad公司,680),激光共聚焦显微镜(德国leica公司,TCS SP5),流式细胞仪(美国BD公司,FACS Calibur),医用直线加速器(美国VARIAN公司,23EX),电泳仪(美国Bio Rad公司,Mini-protean4),紫外分光光度计(南京五义科技有限公司,OD-1000+),凝胶成像仪(美国Bio Rad公司,ChemiDoc XRS+)。
1.3 细胞培养与处理食管癌ECA-109细胞株为安徽省肿瘤医院放疗科保存,用含10%新生牛血清的RPMI 1640培养基,于37℃,含5%二氧化碳的恒温培养箱中孵育培养,每2~3天传代1次。
1.4 照射条件采用6 MV X射线垂直照射,源靶距(SSD)=100 cm,照射野面积15 cm×20 cm,吸收剂量率为400 cGy/min。
1.5 方法
1.5.1 四甲基偶氮唑盐微量酶反应比色法(MTT法)检测穿心莲内酯对细胞增殖的影响 指数生长期细胞,以4~6×104/mL的密度接种于96孔培养板,每孔终体积100 L,待细胞贴壁后,分别加入终浓度为7.5、15、30、60、120、240、360、480 g/mL的穿心莲内酯,每组设6个复孔,同时设调零组(仅加入RPMI 1640培养基100 L)和空白对照组(仅加入单细胞悬液,即药物浓度为0 g/mL),分别培养12、24、48 h后,弃去药物,并加入磷酸缓冲盐溶液(PBS)清洗1~2遍,每孔加入含5 mg/mL的MTT 20 L,继续置于培养箱中孵育4 h后,弃去上清,每孔加入150 L二甲基亚砜(DMSO),低速震荡10 min使紫色结晶充分溶解后,用酶联免疫检测仪于波长490 nm处测定各孔吸光度。
1.5.2 细胞划痕实验 取指数生长期ECA-109细胞接种于35 mm培养皿中,培养至细胞完全饱和。分组:空白组,单纯放射组,药物+放射联合组,凡用药组放射前予穿心莲内酯预处理6 h。一次性与6 MV X线照射,照射后立即更换为无药完全培养基。采用200 L无菌枪头在每个皿中划出等宽的直线划痕,并用无菌PBS清洗3次。分别于0、6、12、24 h在倒置相差显微镜下观察划痕的宽度,并拍照记录(×100)。
1.5.3 蛋白质印迹法(Western Blot)检测细胞内半胱氨酸天冬氨酸蛋白酶3(caspase3)、Bax、Bcl-2、NF-κB表达 穿心莲内酯处理细胞6 h后予以放射,继续培养2、24 h后收集各组细胞,用1×SDS上样缓冲液裂解不同处理组细胞,提取细胞总蛋白,测定蛋白浓度,制作10%分离胶和5%浓缩胶,待其凝固后加入蛋白样品15 L。电泳条件:80 V,10 min;120 V,30 min。转移蛋白至聚偏二氟乙烯膜(PVDF膜),转膜条件:恒流300 Ma,90 min。将转膜后的PVDF膜浸润在含5%脱脂奶粉的等渗缓冲盐溶液(TBST)中1 h,加入特异性一抗(1∶400)于4℃过夜,加入辣根过氧化物酶(HRP)标记的二抗室温孵育2 h,最后加入发光底物经X射线曝光显示蛋白条带,重复实验至少3次。其中NF-κB按照碧云天核蛋白提取试剂盒操作步骤提取。
1.5.4 克隆集落形成实验检测穿心莲内酯的放射增敏作用 取指数生长期的ECA-109细胞,以适当密度接种于6孔板中,待细胞贴壁后分组:空白组、单纯穿心莲内酯的单药组、单纯放射的单放组、穿心莲内酯+放射的联合组,药物浓度为120 g/mL,照射前药物预处理6 h,分别给予0、1、2、4、6、8 Gy的6 MV X射线照射,照射后立即更换不含药物的培养基继续培养,每3天换液1次,当6孔板中出现肉眼可见克隆时(约10 d),终止培养,弃去上清,用PBS冲洗3遍,无水甲醇固定10 min,姬姆萨染色15 min,然后用流动水洗去染色液,自然晾干后于倒置显微镜下计数大于50个细胞的克隆数。按照克隆形成率(%)=(对照组克隆数/实验组细胞数)×100%,存活分数(SF)=实验组克隆形成率/对照组克隆形成率计算。根据单击多靶模型SF=1-(1-e-D/D0)n,用 GraghPad Prism 5.0 软件统计拟合细胞存活曲线,式中D为放射剂量,D0为曲线指数下降63%所需的放射剂量,D0=1/k,k为存活曲线斜率;Dq=D0×lnN,Dq为细胞受损所需的准阈剂量。计算放射增敏比(SER)=对照组D0/实验组D0,重复实验3次。
1.5.5 Foci(焦点形成实验)焦点形成检测DNA分子损伤 将指数期ECA-109细胞分组:空白组、单纯穿心莲内酯的单药组、单纯放射的单放组、穿心莲内酯+放射的联合组,药物浓度为120 g/mL,照射前药物预处理6 h,给予6 Gy的6 MV X射线照射。以每张载玻片10~20万细胞甩片制片,制片后加入免疫染色固定液固定,用免疫染色封闭液封闭1.5 h,加入γ-H2AX多克隆抗体(1∶250)4℃过夜,PBS洗涤后加入羊抗兔-PE标记的二抗(1∶150)常温孵育1.5 h,PBS洗涤后DAPI染核3 min,抗荧光淬灭剂封片后置于湿盒中,在激光共聚焦显微镜下检测foci焦点形成情况(×400)。
1.5.6 免疫荧光实验检测Bax表达水平 取指数生长期细胞进行分组:空白组、单纯穿心莲内酯的单药组、单纯放射的单放组、穿心莲内酯+放射的联合组,药物浓度为120 g/mL,照射前药物预处理6 h,给予6 Gy的6 MV X射线照射。以每张载玻片10~20万细胞甩片制片,制片后加入免疫染色固定液固定,用免疫染色封闭液封闭1.5 h,加入稀释的Bax单克隆抗体(1∶200)于4℃孵育过夜,用羊抗兔-PE标记的二抗(1∶150)常温孵育1.5 h,DAPI染核3 min,抗荧光淬灭剂封片后置于湿盒中,在激光共聚焦显微镜下检测Bax的表达(×400)。
1.5.7 流式细胞术检测细胞凋亡 将ECA-109的单细胞悬液接种于平皿中,分组:空白组、单纯穿心莲内酯的单药组、单纯放射的单放组、穿心莲内酯+放射的联合组,药物浓度为120 g/mL,照射前药物预处理6 h,给予6 Gy的6 MV X射线照射,照射后继续孵育24 h收集细胞,用稀释后的PBS悬浮细胞,使其密度>1×106/mL。取100 L的细胞悬液于5 mL流式管中,加入5 L Annexin V-FITC和10 L PI溶液混匀后,于室温避光孵育15 min。于流式细胞仪上机检测,激发波长(Ex)=488 nm,发射波长(Em)=530 nm,计算凋亡率。
1.6 统计学方法每组实验重复至少3次,实验数据以xˉ±s表示,采用GraghPad Prism 5.0拟合细胞存活曲线,采用SPSS 19.0统计软件进行分析,多组间比较用单因素方差分析,两组之间采用成组t检验比较,P<0.05为差异有统计学意义。
2 结果
2.1 穿心莲内酯对ECA-109细胞增殖的影响用不同浓度的穿心莲内酯作用到指数生长期的ECA-109细胞不同时间后观察细胞的生长情况,可见穿心莲内酯基本以剂量和时间依赖性抑制食管癌ECA-109细胞的增殖。随着药物浓度的升高,对细胞增殖的抑制作用逐渐增强,随着药物作用时间的增加,对细胞增殖的抑制作用也逐渐增强。但24 h低剂量药物组7.5 μg/mL、15 μg/mL出现了毒物兴奋效应。穿心莲内酯处理24 h的ECA-109细胞显示抑制浓度IC20为95.39 μg/mL,故在后续研究中使用120 μg/mL(约 IC27)浓度。120 μg/mL 浓度组作用24、48、72 h与相应对照组(0 μg/mL)比较,细胞生长抑制差异有统计学意义(P<0.01),见表1,图1。
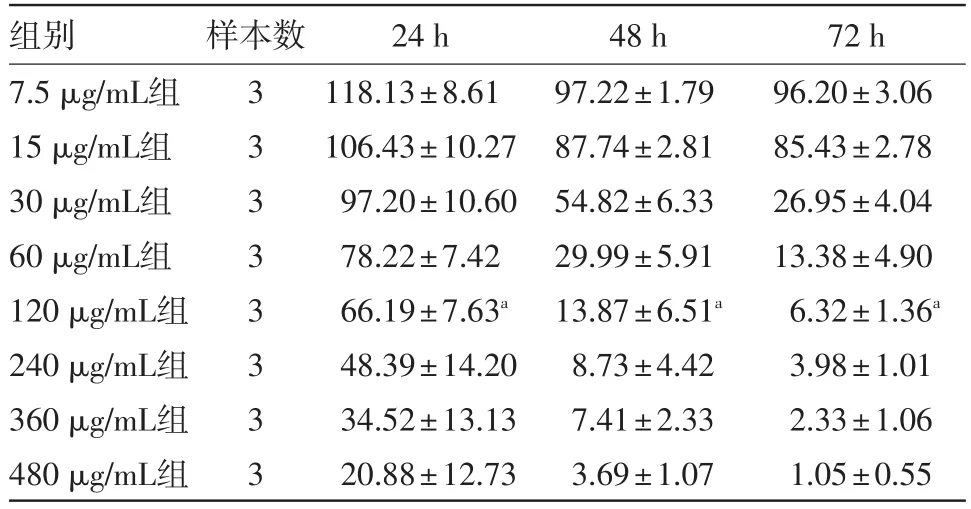
表1 不同浓度的穿心莲内酯作用不同时间对ECA-109细胞存活率的影响/(%,xˉ±s)
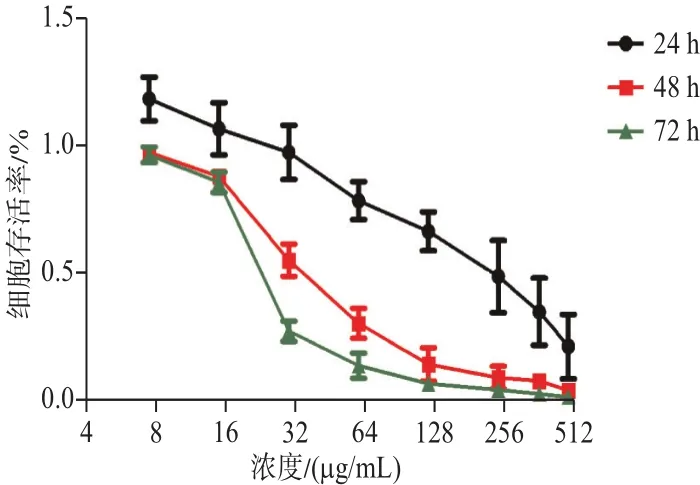
图1 不同浓度的穿心莲内酯作用不同时间对ECA-109细胞存活率的影响
2.2 穿心莲内酯对Eca-109细胞增殖迁移影响空白组随着时间的推移逐渐“愈合”,而单放组则合拢较为缓慢,联合组则没有合拢的趋势,说明药物联合放射会影响细胞增殖迁移的能力。细胞经放射后死亡剥脱的细胞明显增多,联合组较单放组更为明显,说明药物联合放射增加了细胞死亡的程度,增加了放射敏感性。见图2。
2.3 穿心莲内酯对凋亡相关蛋白及NF-κB蛋白表达的影响蛋白质印迹法结果显示,单纯药物对促凋亡蛋白caspase3、Bax的表达可稍上调,说明药物本身即有促肿瘤细胞凋亡作用,随时间推移,单纯放射也会有明显的促凋亡蛋白表达增加,而药物联合放射后,这种促凋亡蛋白的表达更加明显,说明药物联合放射可以明显增加肿瘤细胞的凋亡。抑制凋亡蛋白Bcl-2的表达则截然相反,再次验证的了药物联合放射的增敏效应。核内NF-κB蛋白的表达与Bcl-2趋势基本一致,说明穿心莲内酯或许通过NF-κB信号通路发挥了抗肿瘤作用。见图3。

注:actin为肌动蛋白,NF-κB为核因子κB,caspase3为半胱氨酸天冬氨酸蛋白酶3,Bcl-2为B淋巴细胞瘤-2基因,Bax属于促凋亡蛋白图3 穿心莲内酯对凋亡相关蛋白及NF-κB蛋白表达的影响(蛋白质印迹法):A为空白组;B为单纯药物组;C为单纯放射2 h;D为单纯放射24 h;E为药物联合放射2 h;F为药物联合放射24 h
2.4 穿心莲内酯对食管癌细胞放射敏感性的影响食管癌ECA-109细胞经过处理后,根据单击多靶模型拟合细胞的存活曲线,计算出加入120 g/mL穿心莲内酯联合放射的SER。可见使曲线指数下降63%的放射剂量下,加入穿心莲内酯组的细胞存活分数(0.67±0.04)%明显低于单纯照射组(0.86±0.06)%(t=4.59,P=0.02),当细胞受到不同剂量X射线的照射后,加入穿心莲内酯的处理组,明显改变了细胞的存活曲线,使存活曲线的斜率增大,D0值下降,SER增加(SER=1.28),说明穿心莲内酯具有明显的放射增敏作用。见图4,表2。
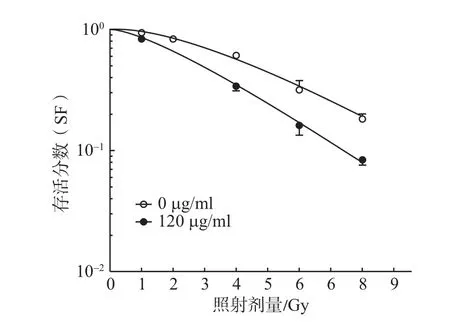
图4 穿心莲内酯对ECA-109细胞放射敏感性的影响
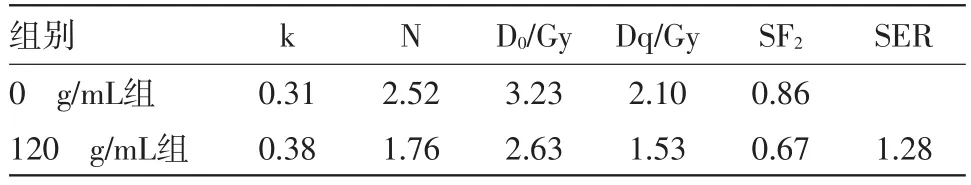
表2 穿心莲内酯联合照射的放射敏感性相关参数
2.5 Foci焦点形成检测DNA分子损伤通过检测γ-H2AX免疫荧光染色后foci焦点形成数目,观察细胞核内DNA分子损伤情况(双链DNA断裂,DSB)。结果一次性予6 Gy照射后,放射后30 min即出现明显foci焦点,但联合组焦点数更多。2 h后放射组和联合组foci焦点数均少量减少,联合组仍明显多于放射组。24 h后放射组和联合组焦点数明显减少,联合组仍较放射组多。这说明穿心莲内酯与X射线联合作用,有明显的放射增敏作用。见图5。
2.6 免疫荧光检测Bax表达情况通过检测凋亡相关蛋白Bax反应穿心莲内酯联合放射对食管癌ECA-109细胞影响。结果可见未经处理食管癌ECA-109细胞Bax表达很少。单纯使用穿心莲内酯作用细胞后其表达有所增加,也说明了药物本身具有促进凋亡作用。单纯放射后其表达明显增加,而联合穿心莲内酯放射后表达尤为显著。见图6。
2.7 穿心莲内酯对ECA-109细胞凋亡的影响采用AnnexinV/PI双染色后经流式细胞分析仪检测细胞凋亡情况,结果可见食管癌ECA-109细胞经24 h处理后,联合组细胞凋亡率(32.5±0.9)%明显高于单放组(26.5±2.2)%(P<0.05)和单药组(20.8±0.8)%(P<0.001),联合组细胞死亡率(52.5±4.9)%也明显高于单放组(30.8±0.6)%(P<0.01)和单药组(14.1±0.5)%(P<0.001),说明穿心莲内酯与X射线联合作用,有增加细胞凋亡的作用,即穿心莲内酯有放射增敏作用。见图7。
3 讨论
近年来中医药逐渐成为抗肿瘤研究的热门方向,而放疗随着技术的发展,放疗也日益成为治疗食管癌的重要手段之一。但传统的药物,化疗方法和手术治疗疗效并不理想,容易复发和远处转移。这与肿瘤细胞的自我跟新产生异质性,化疗耐药和放射抗拒密切相关。
穿心莲为爵床科穿心莲属植物,具有清热解毒、凉血消肿等作用,其主要成分为穿心莲内酯,为二萜类内酯化合物。现代药理研究表明,穿心莲内酯及其衍生物具有消炎抗菌、抗病毒感染、抗心血管疾病、抗肿瘤、免疫刺激等功能。目前,对穿心莲内酯的研究主要集中在抗炎、抗菌、抗肿瘤、抗病毒机制及临床疗效等方面。
本实验研究结果表明,穿心莲内酯可以明显抑制食管癌ECA-109的生长,并与穿心莲内酯的处理浓度和处理时间成正比,即剂量依赖性和时间依赖性。
细胞凋亡是放疗另一个重要作用机制[8]。Caspase家族在介导细胞凋亡中起到重要作用,其中Caspase3是关键分子。Bcl-2是与凋亡密切的原癌基因之一,Bcl-2家族包括Bcl-2、Bax、Bad、Bcl-x等。以上凋亡相关蛋白不仅和恶性肿瘤的发生、发展相关,还参与放射诱导细胞凋亡[9]。本研究结果显示,穿心莲内酯可以上调促凋亡蛋白Bax和细胞凋亡效应性蛋白裂解酶Caspase3,下调抑制凋亡蛋白Bcl-2。联合放射后更加明显。由此推断,穿心莲内酯可能是通过调节这些凋亡相关蛋白进而诱导细胞凋亡的发生,并且联合放射后这种调节作用更加明显。
活化的NF-κB可以进入核内与下游调控基因上Kb序列结合,参与细胞的增殖、转化、侵润和抗凋亡。然而,抑制NF-κB信号通路的活性会阻断它促进下游基因表达的功能。抑制NF-κB的活化可以抑制肿瘤细胞的增殖,会引起细胞周期的停滞并诱导凋亡[10-11]。本研究结果显示,穿心莲内酯可以下调食管癌细胞ECA-109中细胞核内NF-κB的表达,联合放射后下调作用更加明显,其总体趋势与Bcl-2基本相一致。由此推断,NF-κB在调节细胞凋亡上起到和Bcl-2类似的抗凋亡作用,联合放射后该作用更加明显,这提示了穿心莲内酯对ECA-109细胞的作用机制可能与抑制NF-κB信号通路密切相关。
此外,本研究将无明显不良反应的低浓度穿心莲内酯预处理后,可明显增加食管癌细胞ECA-109对X射线的敏感性,其SER为1.28。这可能与凋亡相关蛋白调节机制相关。
虽然其作用机制还有待进一步研究,但本研究结果表明穿心莲内酯不仅仅可作为抗食管癌细胞生长和转移的有效抗肿瘤药物,也可作为一种食管癌放射增敏的新药。
(本文图2,5~7见插图12-4)

图2 穿心莲内酯对ECA-109细胞增殖迁移影响(×100):A为空白组,B为单放组,C为联合组
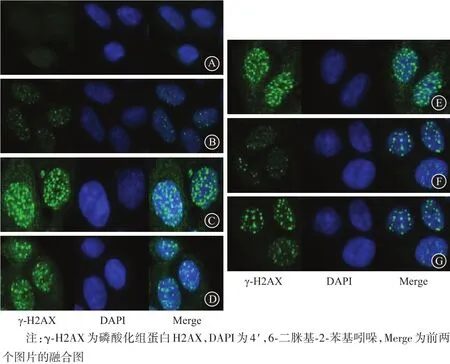
图5 Foci焦点形成检测DNA分子损伤(免疫荧光+DAPI染色×400):A为空白组,B为放射30 min组,C为联合30 min组,D为放射2 h组,E为联合2 h组,F为放射24 h组,G为联合24 h组
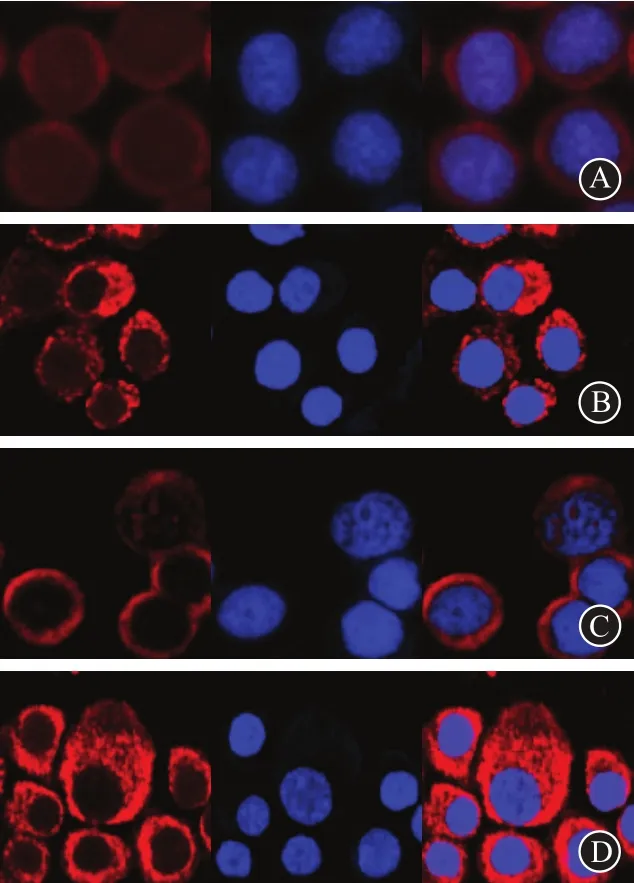
图6 免疫荧光检测Bax表达情况(免疫荧光+DAPI染色×400):A为空白组,B为单药组,C为单放组,D为联合组
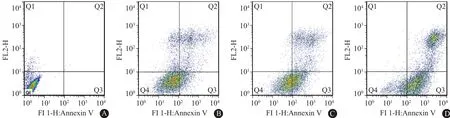
图7 不同措施处理后的ECA-109细胞凋亡情况:A为空白组,B为单药组,C为单放组,D为联合组

