单中心腹膜透析相关性腹膜炎病原菌及耐药性分析
邱英,任伟,兰雷
腹膜透析(腹透)是终末期肾脏病病人一体化治疗的重要方法。腹膜透析相关性腹膜炎(PDAP)是腹膜透析常见严重并发症,是导致病人退出腹透及死亡的原因之一[1]。研究显示,PDAP的致病菌谱及耐药性也不断发生变化,各腹透中心的致病菌谱及耐药性也不尽相同[2]。本课题组通过回顾147例次PDAP病人,分析其中66例次腹水培养阳性病人资料,分析致病菌分布、耐药性及预后,为临床规范用药及PDAP合理化治疗提供指导。
1 资料与方法
1.1 一般资料搜集中国科学技术大学附属第一医院(安徽省立医院)肾内科2011年1月至2018年12月就诊的终末期肾脏病、维持性腹膜透析病人中发生PDAP的病人资料。PDAP诊断标准参照2016年国际腹膜透析协会(ISPD)指南[3]:(1)具有腹膜炎的症状和体征,透出液浑浊和(或)腹痛和(或)发热;(2)透出液白细胞计数≥100×l06/L,其中多核细胞≥50%;(3)透出液涂片或培养发现病原微生物。具备以上3项中的至少2项可诊断为腹膜炎。
纳入标准:(1)确诊为终末期肾脏病,且纳入研究时腹膜透析时间大于3个月;(2)符合以上腹膜炎的诊断标准。排除标准:(1)急性肾衰竭;(2)自动化腹膜透析(APD)病人;(3)非感染性腹膜炎;(4)合并其他感染性疾病的病人。本研究经病人或近亲属知情同意,且符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 标本留取及药敏试验疑似PDAP病人入院后,在启动抗生素治疗前留取透出液,采用无菌操作方法,分别送检腹水常规、腹水涂片抗酸染色找结核杆菌,并用血培养瓶(需氧及厌氧)留取10 mL透出液送检病原菌培养。对腹透液培养阳性者进行药物敏感分析。其中该中心真菌感染未开展药敏试验。
1.3 PDAP的治疗及预后标准入院后留取透出液标本后立即予以治疗,同时覆盖革兰阳性菌(G+)及革兰阴性菌(G-),经验性使用第一代头孢菌素联合第三代头孢菌素或第三代头孢菌素联合万古霉素或去甲万古霉素局部腹腔加药行经验性治疗,如有头孢菌素类过敏,则予以氨基糖苷类覆盖G-菌,万古霉素或去甲万古霉素覆盖G+菌,如伴有全身症状(如伴发热等)同时给予抗菌药物静脉滴注治疗。待透出液培养和药敏结果回报后,根据药敏结果必要时再调整抗菌药物,治疗总疗程2~3周。拔管时机:包括难治性腹膜炎,即合适的抗生素治疗5 d后引流液未变清;复发性腹膜炎,即上一次腹膜炎痊愈后4周内再次发生的致病菌相同或培养阴性的腹膜炎。一旦确诊真菌性腹膜炎,尽早拔除腹膜透析导管,并使用静脉抗真菌药物。结核性腹膜炎根据2016年ISPD指南[3]起始联合使用4种抗结核药物:利福平、异烟肼、吡嗪酰胺、氧氟沙星,经抗结核治疗并严密观察5 d仍无明显缓解,拔除腹膜透析导管。治愈标准:非真菌感染病人治疗后症状、体征完全缓解,无须抗生素治疗,无须拔除腹透管,透出液白细胞<100×l06/L,透析液变清,多核白细胞<50%,连续3次病原学检查结果均为阴性,30 d内无复发为治愈。退出标准:因腹膜炎导致拔除腹透导管、改血液透析或死亡,其他指未完全治愈,但因各种原因要求自动出院而失访。
1.4 统计学方法采用SPSS 17.0软件进行统计学分析,定量资料采用xˉ±s表示;分类数据采用频数和百分比表示,组间比较采用χ2检验(Pearsonχ2检验或连续校正χ2检验)或Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料描述腹透病人共发生147例次PDAP,透析液病原菌培养阳性66例次(60例病人)阳性率44.90%,其中男性38例,女性22例,年龄范围为22~76岁,年龄(47.75±12.89)岁;原发病分别为慢性肾小球肾炎53例(88.33%),糖尿病肾病5例(8.33%),梗阻性肾病1例(1.67%),多囊肾1例(1.67%)。
2.2 病原菌分布147例次PDAP中,透出液病原菌培养阳性66例次,其中混合感染1例次,共检出菌株67株,其中G+菌38株(56.72%),G-菌18株(26.87%),真菌10株(14.93%),结核分枝杆菌1株(1.49%)(见表1)。
2.3 耐药性分析G+菌对青霉素G的耐药性最高,为68.42%,对替加环素、万古霉素、利奈唑胺、利福平的耐药率最低(见表2);G-菌对抗生素,头孢唑林耐药性最高,为55.56%,对头孢哌酮舒巴坦、厄它培南、阿米卡星的耐药率最低(见表3)。
2.4 PDAP病人的预后66例次透出液培养阳性的PDAP病人经治疗后38例次治愈(57.58%),退出22例次(33.33%),退出病人中1例死亡,病死率1.52%,21例次拔管改血透。其中36例次G+菌感染的病人中,退出7例次(19.44%),18例次G-菌感染病人,退出7例次(38.84%);真菌的退出率高达80%,部分病人要求自动出院,未在我中心继续诊治而失访(见表4)。单独比较G+菌与G-菌感染病人,发现G+菌感染的病人治愈率、退出率与G-菌感染者比较,均差异无统计学意义(χ2=2.103,P=0.147;χ2=1.458,P=0.227)。
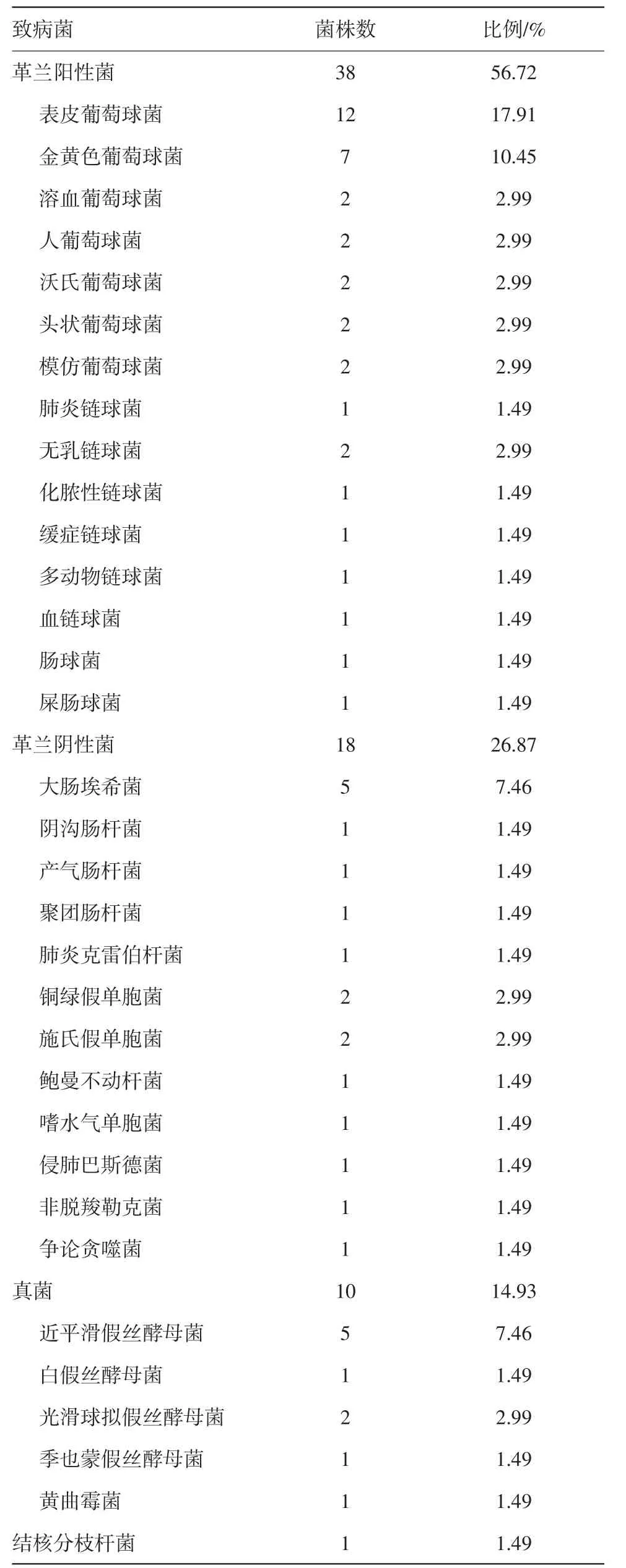
表1 腹膜透析相关性腹膜炎培养147例次的67株致病菌分布及构成情况
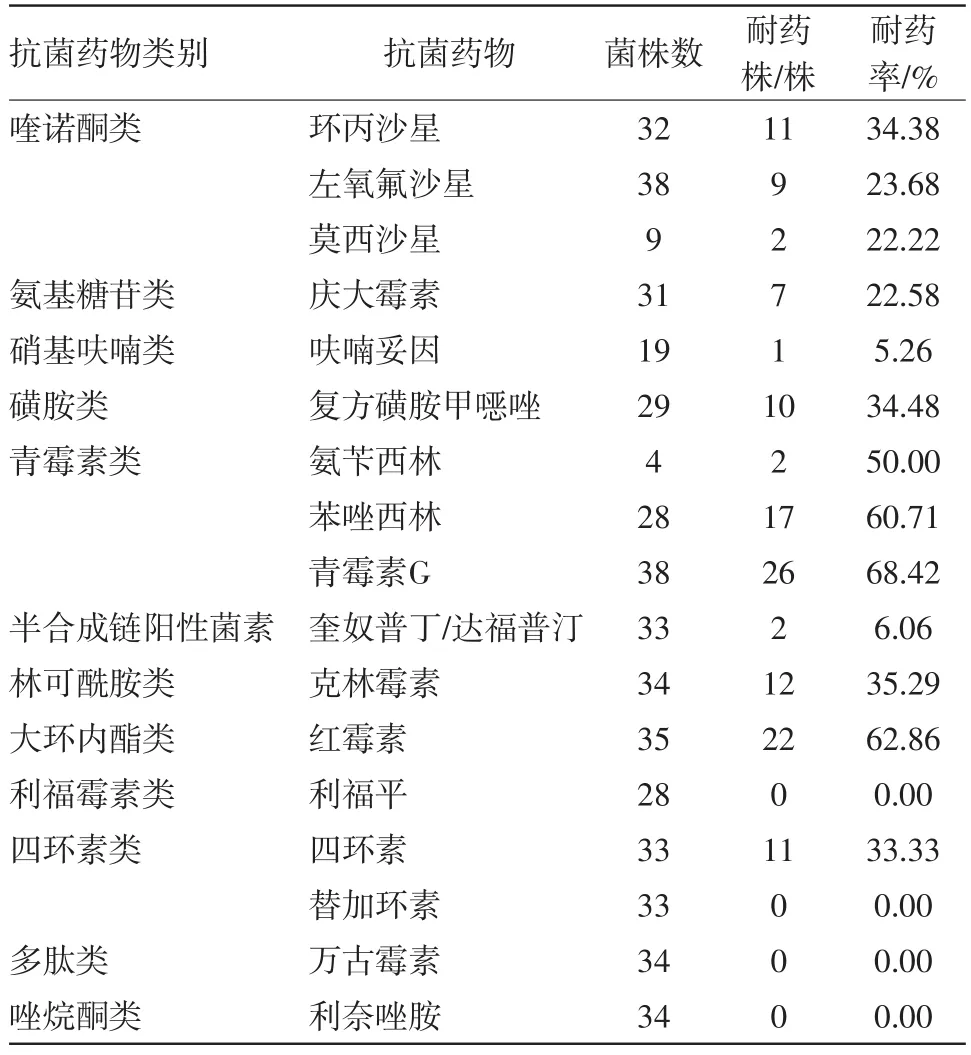
表2 腹膜透析相关性腹膜炎147例次分离的革兰阳性菌对抗菌药物耐药性分析
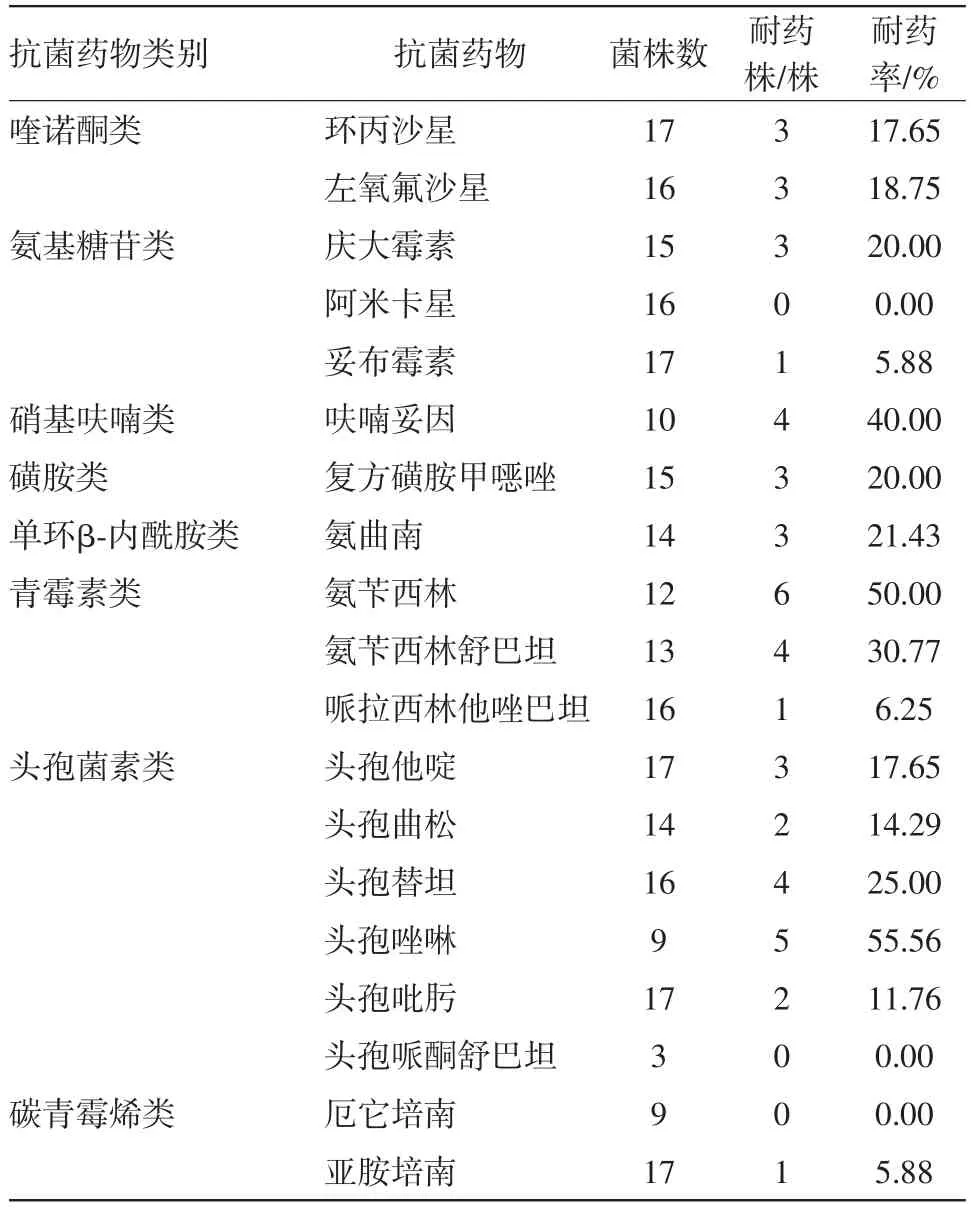
表3 腹膜透析相关性腹膜炎147例次分离的革兰阴性菌对抗菌药物耐药性分析
3 讨论
随着透析技术的成熟,腹透培训管理水平及模式的提高及完善,近些年,腹膜炎发生率已显著下降[4],病人能够维持更长时间的腹膜透析[5]。但PDAP仍显著增加病人住院率和病死率,是导致腹透病人终止腹膜透析的主要原因[6-8]。
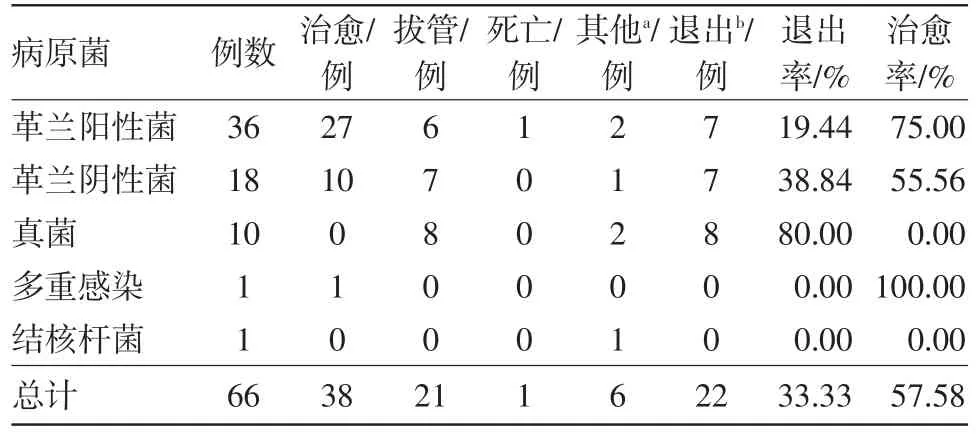
表4 腹膜透析相关性腹膜炎147例次的预后分析
透出液病原菌培养及药敏试验对PDAP的诊断和治疗有重要指导意义。根据2016年ISPD指南[3],腹膜炎病原菌培养阳性率应大于85%,本研究结果显示,该中心培养阳性率仅为44.90%,低于ISPD指南的要求,且低于国内许多中心的研究阳性率[4,9]。阳性率偏低考虑与病人就诊不及时、就诊前在门诊或外院使用抗生素、透出液标本留取方法以及培养技术有关。因此应建立该中心腹膜炎处理的标准化流程,在用药前正确地留取标本并及时送检、多次送检,同时提高病原菌检测技术。反转录PCR(RT-PCR),尤其多重RT-PCR技术能同时检测多种病原菌,更快捷,阳性率更高[10],该中心可逐渐开展这项技术。
本研究中PDAP的致病菌以G+菌为主(56.72%),其中以表皮葡萄球菌最多(检出率17.91%),其次是金黄色葡萄球菌(10.45%),这两种细菌感染多为接触污染、无菌操作不规范造成。回顾病人的病历资料,发现此类病人发生腹膜炎前多有操作不规范史,且多数为农民、文化水平偏低、无菌观念淡薄。研究表明,定期对腹膜透析病人随访和培训可降低PDAP发病风险[11]。因此,应加强对病人标准流程的严格培训、教育,定期标准化随访以及随访时的再培训和再教育。培训也包括针对居住环境进行指导,帮助病人改善操作环境,因为居住环境也是PDAP的影响因素[12]。治疗仍首选万古霉素、利福平、左氧氟沙星等敏感药物。本研究培养G-菌中,以大肠埃希菌为主(7.46%),多数病人腹膜炎发生前存在明显的腹泻、便秘或肠梗阻等肠道感染因素,因此,避免不洁饮食,重视病人的饮食教育、肠道问题,及时干预处理。本研究中,腹膜透析病人发生真菌性腹膜炎较多,检出率达14.93%,高于国内外水平[4,9,13]。可能原因为腹膜透析病人大多有抵抗力低下、长期营养不良、贫血等情况,且在就诊前已使用大量广谱抗生素药物,极易发生二重感染。因此新指南建议:腹膜透析病人行抗生素治疗时可预防性应用抗真菌药物。另外,贫血、低蛋白血症等营养不良是病人发生多发性腹膜炎并预后不良的危险因素,加强对腹膜透析病人的营养管理至关重要[14]。
本研究结果显示G+菌对青霉素耐药率最高,高达68.42%,对利福平、替加环素、万古霉素、利奈唑胺耐药率均为0,该中心多使用万古霉素或去甲万古霉素作为G+菌感染者的初始经验治疗,可以继续使用或考虑使用利福平、替加环素或利奈唑胺。G-菌对阿米卡星、头孢哌酮舒巴坦、厄它培南未出现耐药,对妥布霉素、亚胺培南、头孢吡肟、头孢曲松、头孢他啶等耐药率较低,可能与氨基糖苷类药物毒副作用较大,碳青霉烯类药物较广谱,现均使用较少相关。遂基于此因素,上述两种药物现仍不作为常规使用。因此,该中心对G-菌感染的初始经验治疗仍以第三代头孢菌素治疗为主,但Kitterer等[15]的研究显示G-菌对第三代头孢耐药性较前增加,因此,在治疗过程中应强调个体化原则,动态监测该中心的腹膜炎的病原菌谱变化及药敏结果选择更合理的抗菌药物。
引起PDAP最常见的病原体为G+菌,但多发性腹膜炎病菌谱中G-菌及真菌比例明显升高[14],且G-菌及真菌引起的腹膜炎可能预后更差,退出率及病死率均较高[16-17]。本研究预后分析中总体退出率较高,可能与真菌感染较多相关,真菌性腹膜炎病人几乎均拔管,G+菌感染的病人治愈率、退出率与G-菌病人比较,均差异无统计学意义。原因可能为部分病人,包括结核性腹膜炎病人自动出院而失访,使研究结果存在一定偏差。
综上所述,PDAP的主要致病菌仍以G+菌为主,万古霉素可推荐作为G+球菌的初始经验用药。该中心需提高培养阳性率。G-菌及真菌性腹膜炎预后更差,需重视G-菌及真菌性腹膜炎的管理。

