微RNA-27a介导3T3-L1脂肪细胞胰岛素抵抗的作用机制
谢军,韩造木,尹琬凌
微RNAs(miRNAs)在糖尿病及胰岛素抵抗的发生过程中起重要作用,目前已发现多种miRNA通过各种作用方式导致或改善胰岛素抵抗。作者前期研究发现miR-27a可以促进脂肪细胞胰岛素抵抗[1]。本研究于2017年11月至2018年7月以肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导3T3-L1脂肪细胞的胰岛素抵抗为模型,进一步研究miR-27a介导胰岛素抵抗的作用机制及作用靶点。
1 材料与方法
1.1 实验材料3T3-L1前脂肪细胞购于中国科学院细胞库,Dulbecco’s Modified Eagle Medium(DMEM)高糖培养基购于美国Hyclone公司,胰蛋白酶购于bioswamp公司,胎牛血清(fetal bovine serum)购于美国Gibco公司,胰岛素(Insulin),TNF-α,地塞米松(dexamethasone),异丁基甲基黄嘌呤(isobutyl methyl xanthine,IBMX)均购于美国sigma公司,脂质体2000(Lipofectamine 2000)购于美国Invitrogen公司,SYBR Green PCR试剂盒购于美国KAPA Biosystems公司,逆转录试剂盒购于日本TAKARA公司。miR-27a类似物(mimics)和miR-27a抑制物(inhibitor)购于广州锐博生物科技有限公司。胰岛素受体底物1(insulin receptor substrate 1,IRS1),苏氨酸蛋白激酶(Akt),糖原合成激酶(GSK-3β)等细胞信号通路蛋白及其磷酸化活性形式p-IRS1,p-Akt,p-GSK-3β抗体均购于英国Abcam公司,甘油醛-3-磷酸脱氢酶(GAPDH)抗体购于美国Cell Signaling Technology公司。
1.2 实验方法
1.2.1 3T3-L1细胞胰岛素抵抗模型的建立及miR-27a对葡萄糖摄取的影响3T3-L1前脂肪细胞在37℃,5%二氧化碳及饱和湿度条件下,用含10%胎牛血清的DMEM培养基中恒温培养、传代。试验时,将细胞接种于6孔板中,当汇合度达到70%时,用含诱导液(10 mg/L胰岛素、1 μmol/L地塞米松和0.5 mmol/L异丁基甲基黄嘌呤及10%胎牛血清)的DMEM培养基诱导分化48 h,撤掉地塞米松、IBMX,用含10 mg/L胰岛素的DMEM培养基再培养48 h,然后换成含不含胰岛素的10%胎牛血清的高糖DMEM培养基再继续培养4 d,采用油红O染色鉴定细胞的分化情况。向培养基中添加10 ng/L TNF-α继续培养24 h,即可成功建立3T3-L1脂肪细胞胰岛素抵抗模型。
细胞分为正常对照组,模型组,miR-27a mimics+模型组,miR-27a inhibitor+模型组。将3T3-L1细胞培养于24孔板中,实验前1 d用含0.2%BSA的无血清培养基培养过夜。实验前细胞在37℃含0.2%BSA的KRB缓冲液[含120.0 mmol/L氯化钠(NaCl),6.0 mmol/L氯化钾(KCl),12.5 mmol/L 4-羟乙基哌嗪乙磺酸(HEPES),1.2 mmol/L硫酸镁(Mg-SO4),0.4 mmol/L磷酸二氢钠(NaH2PO4),0.6 mmol/L磷酸氢二钠(Na2HPO4),1.0 mmol/L氯化钙(CaCl2)]中作用2 h,然后每孔加入含5微居里(μCi)脱氧3H葡萄糖的-脱氧葡萄糖混合液50 μL孵育5 min,然后吸去全部孵育液,冰磷酸缓冲盐溶液(PBS)洗涤细胞5次,干燥后室温下每孔加入500 μL Triton-100裂解细胞30 min,最后取400 μL细胞裂解液于液闪计数器下检测。
1.2.2 蛋白质印迹法(Western Blot)检测胰岛素信号通路相关蛋白的表达变化 3T3-L1细胞分为正常对照组,模型组,miR-27a mimics+模型组,miR-27a inhibitor+模型组,分别以蛋白质印迹法检测胰岛素信号通路IRS1,Akt,GSK-3β的蛋白水平及蛋白磷酸化水平(活性形式)的变化。
1.2.3 实时荧光定量多聚核苷酸链式反应(qPCR)检测过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的表达 分别收集各组的3T3-L1细胞,Trizol法提取总RNA,应用TAKARA逆转录试剂盒进行逆转录,采用SYBR Green PCR试剂盒进行qPCR。反应体系按照说明书进行配置。采用GAPDH作为内参,根据qPCR反应曲线得到各组样品目的基因和内参基因的Ct(Cycle threshold)值。首先计算△△C t值=(实验组目的基因的Ct平均值-实验组内参基因的Ct平均值)-(对照组目的基因的Ct平均值-对照组目的内参基因的Ct平均值),则基因相对表达量为2-△△Ct。
1.2.4 双荧光素酶报告基因法检测miR-27a的靶点 利用pmirGLO双荧光素酶报告基因检测系统检测miR-27a对PPARγ的直接调控作用。克隆PPARγ 3’非翻译区(3’-UTR)区域,同时采用Quick Change XL Site-Directed Mutagenesis kit试剂盒设计miR-27a结合位点突变区域(即阴性对照),插入pmirGLO载体中,扩增并抽提质粒。然后利用lipofectamine 2000与miR-27a mimics或inhibitor以及对照共转染HEK293细胞。培养24 h后于荧光光度计下检测荧光值以验证miR-27a对PPARγ 3’-UTR的直接作用。
1.3 统计学方法所有结果利用SPSS 19.0软件进行统计学分析,所有数据采用xˉ±s表示,数据间比较采用单因素方差分析+LSD法或成组t检验,P<0.01表示数据间差异有统计学意义。
2 结果
2.1 miR-27a对胰岛素抵抗模型葡萄糖摄取的影响我们采用TNF-α法建立了3T3-L1胰岛素抵抗的细胞模型,同时检测了miR-27a对脂肪细胞胰岛素抵抗模型中的葡萄糖摄取的影响。结果显示:正常对照组,模型组,miR-27a mimics+模型组,miR-27a inhibitor+模型组四组的吸光度值分别为(2.03±0.20),(1.28 ± 0.27),(1.43 ± 0.20),(1.97 ± 0.18),模型组成功抑制了3T3-L1脂肪细胞对葡萄糖的摄取,而miR-27a inhibitor则逆转了模型组细胞对葡萄糖摄取的抑制。见图1。
2.2 miR-27a对胰岛素信号通路的影响胰岛素和胰岛素受体结合后会通过磷脂酰肌醇3-激酶(PI3K)/Akt信号通路促进葡萄糖的摄取和转运,从而降低血糖。因此我们检测了miR-27a对PI3K/Akt信号通路相关蛋白的影响,结果显示miR-27a mimics抑制了胰岛素信号通路中IRS1、Akt、GSK-3β的磷酸化,而miR-27a inhibitor则恢复了模型组对IRS1、Akt、GSK-3β的磷酸化的抑制。见图2。

图1 miR-27a对葡萄糖摄取的影响(n=3)
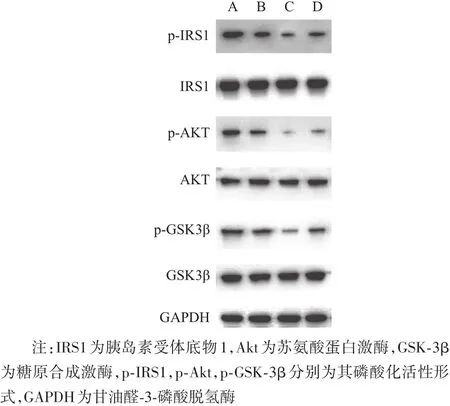
图2 miR-27a对胰岛素抵抗细胞模型信号通路的影响:A为正常对照组;B为模型组;C为模型组+miR-27a mimics;D为模型组+miR-27a inhibitor
2.3 qPCR验证miR-27a对PPARγ的影响PPARγ在脂肪细胞分化及糖尿病的发病过程中起重要作用。有文献报道miR-27a可以抑制PPARγ的表达,通过qPCR我们检测了miR-27a对PPARγ表达的影响。结果显示对照组和mir-27a组的相对值分别为(1.00±0.08)和(0.59±0.14),miR-27a可以显著抑制PPARγ的表达。见图3。
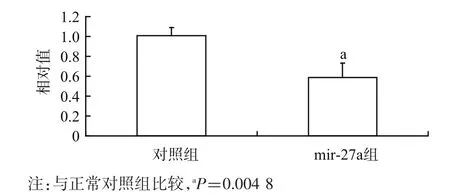
图3 miR-27a mimics抑制PPARγ mRNA的表达(n=3)
2.4 双荧光素酶报告基因法验证miR-27a的靶点 双荧光素酶报告基因检测法是验证miRNA靶点的标准方法。本研究通过双荧光素酶报告基因检测法验证PPARγ是否为miR-27a的靶点。结果显示:miR-27a可以显著抑制报告基因的表达,而miRNA的对照mir-NC及突变了结合位点的载体Mut均不能抑制报告基因的表达。结果证明PPARγ是miR-27a的靶点。PPARγ WT+miR-NC,PPARγ WT+miR-27a,PPARγ Mut+miR-NC,PPARγ Mut+miR-27a四组的荧光值分别为(5.37±0.80)、(3.17±0.57)、(4.94±0.63)、(4.68±0.74))。见图4。
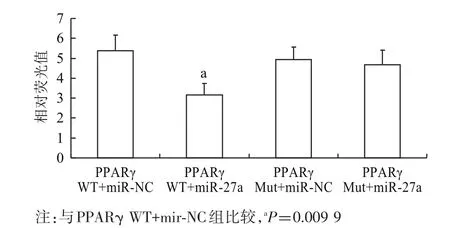
图4 双荧光素酶报告基因检测法验证miR-27a的靶点(n=3)
3 讨论
miRNAs是在一类长约20~24个核苷酸在进化上高度保守的非编码RNA。miRNAs主要在转录水平上,通过与目标靶基因mRNA 3’-UTR结合,抑制目标靶基因的翻译或者促进目标靶基因mRNA的降解,从而抑制目标靶基因的功能。到目前为止已发现多个miRNA通过各种不同的机制和途径调节着糖尿病的发生和胰岛素抵抗:如miR-29b可以通过调控PI3K通路抑制胰岛素抵抗[2]。miRNA-93可以通过抑制葡萄糖转运蛋白4(glucose transporters 4,GLUT4)表达从而导致胰岛素抵抗[3],miRNA-145等通过p65转录因子途径导致肝细胞胰岛素抵抗等[4]。MiR-27a是一个调节脂肪细胞分化和成熟的miRNA[5],大量研究表明 miR-27a在糖尿病病人及糖尿病动物模型中表达上调[6-11],作者前期研究结果也表明miR-27a参与了脂肪细胞的胰岛素抵抗,但是其作用机制却并不清楚[1]。进一步了解miR-27a在糖尿病的发病机制及胰岛素抵抗中的作用将为糖尿病的检测和治疗提供新的手段。
胰岛素和胰岛素受体结合后通过活化IRS1,激活PI3K/Akt信号通路,从而促进葡萄糖的摄取和利用。胰岛素抵抗的产生主要是胰岛素信号通路中的信号传导受阻所致。我们检测了miR-27a对胰岛素信号通路的影响,结果显示miR-27a抑制了胰岛素信号通路中IRS1、Akt、GSK-3β的磷酸化,提示miR-27a通过抑制胰岛素信号通路促进了胰岛素抵抗。
然而,miR-27a的具体靶点并不清楚,生物信息学分析结果提示IRS1及GSK-3β的3’-UTR存在miR-27a的结合位点,提示IRS1及GSK-3β可能为miR-27a的靶标,但是我们蛋白质印迹法的结果以及双荧光素酶报告基因的结果(结果未显示)并未证明IRS1及GSK-3β是miR-27a的直接靶标。PPARγ是参与脂肪细胞生成、成熟、分化的一类核转录因子,主要表达于脂肪组织及免疫系统中。PPARγ在代谢性疾病,特别是糖尿病中起重要作用。PPARγ激动剂噻唑烷二酮类药物已被用来治疗糖尿病。已有研究表明miR-27a可以调节PPARγ的表达[12-14],本研究则通过qPCR及双荧光素酶报告基因检测法进一步证实了PPARγ是miR-27a介导脂肪细胞胰岛素抵抗的直接靶点。
由于一个miRNA可以有多个靶基因,一个靶基因也可以有多个miRNAs调节。为了了解miR-27a是否还有其它作用靶点,我们还对文献[16-18]报道的miR-27a的靶基因同时也是调节胰岛素信号通路的基因进行了检测。叉头框蛋白1(Forkhead box O1,FOXO1)是一类重要的转录因子,主要表达于胰岛效应细胞,如脂肪细胞、肌肉细胞、肝细胞中。在胰腺中也仅表达于β细胞。FOXO1与糖脂代谢,胰岛β细胞增殖与凋亡以及胰岛素抵抗有密切关系[15]。有研究表明miR-27a可以通过靶向FOXO1从而调节细胞增殖与分化[16-18]。然而,在3T3-L1细胞中,我们并没有观察到miR-27a的对FOXO1靶向作用。同样,有研究表明mir-27a可以靶向PI3K[19],然而我们的实验结果也并未显示miR-27a直接调节PI3K的表达。是否还有其它的作用靶点,需要进一步研究证实。
综上所述,在作者前期研究中发现miR-27a可介导3T3-L1脂肪细胞产生胰岛素抵抗,然而机制并不十分清楚。在本研究中,进一步证实miR-27a可通过抑制胰岛素信号通路、靶向PPARγ的表达进而介导胰岛素抵抗。而miR-27a对PPARγ的下游信号通路的影响以及炎症信号通路的影响将进一步明确miR-27a的作用机制。

