维替泊芬影响骨肉瘤MG63细胞增殖和迁移侵袭的作用机制
陈蔚,余铃,陈敬腾,夏露,郭卫春
骨肉瘤是来源于间叶组织的恶性骨肿瘤,好发于青少年,生长迅速且恶性程度高,预后极差[1]。20世纪70年代新辅助化疗的引入使病人5年生存率提高到65%~70%,保肢手术的开展也使病人生存质量得到显著改善[2]。但是出现化疗耐药和远处转移的病人仍预后不良,5年生存率不足20%[1,3]。因而寻找更加有效的针对骨肉瘤的治疗药物具有十分重要的意义。
Hippo通路是一种进化上高度保守的信号转导通路,通过控制细胞增殖和凋亡起到调节器官大小和维持组织稳态的作用。经典Hippo信号通路核心成分有哺乳动物STE20样蛋白激酶1/2(mammalian STE20-like protein kinase 1/2,MST1/2)、接头蛋白Salvador同源物1(Salvador homolog 1,SAV1)、大肿瘤抑制基因1/2(large tumour suppressor 1/2,LATS1/2)和 MOB 激酶活化剂 1(Mob kinase activator 1,MOB1),Yes-相关蛋白 1(Yes-associated protein 1,YAP1)。其中YAP1为Hippo信号通路下游的转录共激活因子,通过调节各种转录因子的活性参与细胞增殖、凋亡、化疗耐药和血管生成等过程[4-5]。目前越来越多研究证实YAP1在许多恶性肿瘤中高表达,并且参与肿瘤发生、发展以及复发。Wang等[6]发现YAP1可以调节骨肉瘤细胞的增殖能力及其对化疗药物的敏感性,表明YAP1可能是治疗骨肉瘤的潜在药物靶点,寻找针对YAP1的抑制剂有望为治疗骨肉瘤病人带来新的曙光。
维替泊芬是一种苯并卟啉类衍生物光敏剂,临床上用于治疗新生血管性黄斑变性[7]。然而有研究表明维替泊芬可作为非光敏激活剂治疗多种疾病[8],如维替泊芬能抑制YAP1基因的转录和翻译,在没有光激活的情况下破坏YAP1与靶蛋白TEA转录因子(TEADs)相互作用,从而调控多种肿瘤细胞增殖和凋亡,如乳腺癌和前列腺癌等[9-10]。但目前尚未见维替泊芬作用于骨肉瘤的报道。本研究于2018年6月至2019年3月观察不同浓度维替泊芬对骨肉瘤MG63细胞增殖、细胞周期、细胞凋亡、侵袭及转移能力的影响,初步探究了维替泊芬抗骨肉瘤作用的相关分子机制,以期为维替泊芬治疗骨肉瘤提供理论依据。
1 材料与方法
1.1 材料人骨肉瘤MG63细胞购于中国科学院细胞库上海保藏中心(批号TCHu124)。维替泊芬购于Selleck公司(批号S1786),DEME高糖培养基购于美国Hyclone公司(批号SH30022.01),新生胎牛血清购于Gibco澳洲公司(批号10099-141);1%双抗(青霉素 100 U/mL,链霉素 100 μg/mL)(批号G4003)、二甲基亚砜(DMSO,批号D2650)和胰蛋白酶(批号G4004)购于武汉赛维尔生物科技有限公司;人胆囊收缩素/缩胆囊素八肽(CCK-8)试剂盒购于南京碧云天公司(批号C0038);膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒与细胞周期检测试剂盒(批号KGA108-1,KGA511)购于南京凯基生物科技发展有限公司;8.0 μm孔径TranswellTM小室(批号PI8P01250)、聚偏二氟乙烯膜(PVDF膜,批号ISEQ00010)均购于Millipore公司;兔抗人Yes相关蛋白1(YAP1,批号4912S)、TEA转录因子1(TEAD1,批号D9X2L)、磷酸化Yes相关蛋白1(pYAP1,批号D9W2I)、β-肌动蛋白(β-actin,批号13E5)抗体均购于美国CST公司;实验所用仪器包括自动酶标仪、流式细胞仪和倒置显微镜。
1.2 方法
1.2.1 细胞培养 骨肉瘤MG63细胞培养于含有10%新生胎牛血清,1%青霉素(100 U/mL)及链霉素(100 μg/mL)的DEME高糖培养液中,放置在37℃、5%二氧化碳培养箱中培养,取对数生长期细胞进行后续实验。
1.2.2 细胞增殖能力检测 取对数生长期的骨肉瘤MG63细胞以5×104/mL浓度接种于96孔板上,每孔100 μL,孵育24 h待细胞贴壁后加入不同浓度的维替泊芬(0、2、4、6、8、10 μmol/L),分别培养24、48、72 h,然后每孔加入10 μL CCK-8试剂,继续孵育2 h,用自动酶标仪测量每孔细胞在450 nm波长的吸光度值。所有试验均进行3次。
1.2.3 细胞周期检测 不同浓度维替泊芬(0、2、4、6、8 μmol/L)处理骨肉瘤MG63细胞24 h后,收集细胞,用冷磷酸缓冲盐溶液(PBS)洗涤2次,用70%乙醇固定1 h后再用PBS洗涤1次,然后用200 μL冷PBS重悬细胞,再加入1 mg/mL核糖核酸酶A(RNase A)和50 μg/mL PI,混匀后避光孵育30 min,随即用流式细胞仪分析细胞周期分布。
1.2.4 细胞凋亡分析 不同浓度维替泊芬(0、2、4、6、8 μmol/L)处理骨肉瘤MG63细胞24 h后,收集细胞,用冷PBS洗涤2次,1 000 r/min离心5 min后去上清,将细胞制成单细胞悬液,加入5 μL Annexin V-FITC和5 μL PI,混匀,避光孵育15 min,然后再加入400 μL结合缓冲液,随即用流式细胞仪进行细胞凋亡检测。
1.2.5 划痕实验 取对数生长期的MG63细胞,以每孔5×104个接种于12孔板中,待细胞长到完全融合后,用无菌100 μL枪头在每个孔底划出1条直线,PBS洗涤2次,用倒置显微镜拍照后,分别加入无血清DMEM高糖培养基,并调整维替泊芬浓度为0、2、4、6、8 μmol/L,继续培养48 h后用倒置显微镜观察划痕-愈合度,拍照记录,每组实验重复3次,按下列公式计算细胞迁移率:

1.2.6 TranswellTM侵袭实验 将TranswellTM小室放入24孔板中,每孔上室加入50 μL稀释后的基质胶(无血清DMEM培养基稀释),然后于37℃恒温无菌培养箱中培养4 h,吸出基质胶表面的液体。收集维替泊芬处理过的骨肉瘤MG63细胞,重悬后加入上室,每孔细胞约4×104个,下室加入500 μL含150 mL/L胎牛血清的完全培养基。各组上室中分别加入DMSO、终浓度为2、4、6、8 μmol/L的维替泊芬后,于37℃恒温无菌培养箱中培养24 h。取出小室,应用无菌棉签擦去小室内残留的细胞,甲醛中固定20 min,然后用PBS清洗,后加入结晶紫染色10 min,晾干后于倒置显微镜下观察滤膜底附着的细胞数,统计侵袭细胞数。每组随机选取5个视野(×100),每组实验均独立重复3次。
1.2.7 蛋白质印迹法(Western Blot) 不同浓度维替泊芬(0、2、4、6、8 μmol/L)处理MG63细胞48 h后用细胞裂解液提取总蛋白,吸取40 μg蛋白行聚丙烯酰胺凝胶电泳,转膜后用5%脱脂奶粉于室温封闭1.5 h,加入相应一抗孵育4℃条件下孵育过夜。滤膜经TBS缓冲液漂洗3次后加入相应二抗,室温摇床孵育2 h。在暗室中将PVDF膜用发光剂显色曝光后分析结果,β-actin蛋白条带作为内参。
1.3 统计学方法 应用SPSS 13.0统计软件进行数据分析,计量数据以xˉ±s表示,采用单因素方差分析进行组间比较,P<0.05认为差异有统计学意义。
2 结果
2.1 维替泊芬抑制骨肉瘤MG63细胞增殖CCK-8结果显示,随着维替泊芬作用时间延长和使用浓度增加,其细胞活力不断下降,24、48、72 h的半抑制浓度(IC50)分别为(6.592±0.121)μmol/L、(4.668±0.075)μmol/L、(2.953±0.078)μmol/L。说明在0~10 μmol/L浓度区间内,维替泊芬可以呈时间、浓度依赖性地抑制MG63细胞的增殖。其中24 h内各浓度下(2、4、6、8、10 μmol/L)细胞存活率分别为:(81.43±1.70)%、(73.50±1.34)%、(56.10±1.56)%、(39.17±0.78)%、(33.27±8.1)%;48 h内各浓度下(2、4、6、8、10 μmol/L)细胞存活率分别为:(75.63±1.30)%、(56.87±1.43)%、(44.67±1.83)%、(28.37±0.93)%、(22.97±1.30)%;72 h内各浓度下(2、4、6、8、10 μmol/L)细胞存活率分别为:(63.2±0.90)%、(41.40±1.40)%、(24.00 ± 1.28)%、(17.30 ± 1.28)%、(8.40 ±1.47)%。见图1。

图1 维替泊芬抑制骨肉瘤MG63细胞增殖
2.2 维替泊芬导致骨肉瘤MG63细胞周期阻滞流式细胞术结果显示。与对照组相比,不同浓度的维替泊芬处理24 h后,处于G0/G1的细胞比例显著上升,G2/M期细胞比例变化不明显,而S期细胞比例则明显降低,且呈浓度相关性。这一结果提示维替泊芬可以导致骨肉瘤MG63细胞周期阻滞于G0/G1期。其中24 h内各浓度下(0、2、4、6、8 μmol/L)G0/G1期比率分别为:(43.33±0.89)%、(57.33±0.89)、(66.67 ± 0.88)%、(72.67 ± 0.88)%、(86.00 ±1.53)%(F=236.61,P<0.05);各浓度下(0、2、4、6、8 μmol/L)S期比率分别为:(36.33±1.21)%、(23.67±0.88)%、(14.67± 0.88)%、(8.33±0.88)%、(4,33±1.53)%(F=194.82,P<0.05);各浓度下(0、2、4、6、8 μmol/L)G2/M期比率分别为:(19.00±0.58)%、(16.67±0.88)%、(20.00±1.73)%、(19.33±0.88)%、(18.33±0.81)%(F=1.42,P=0.30)。见图2。
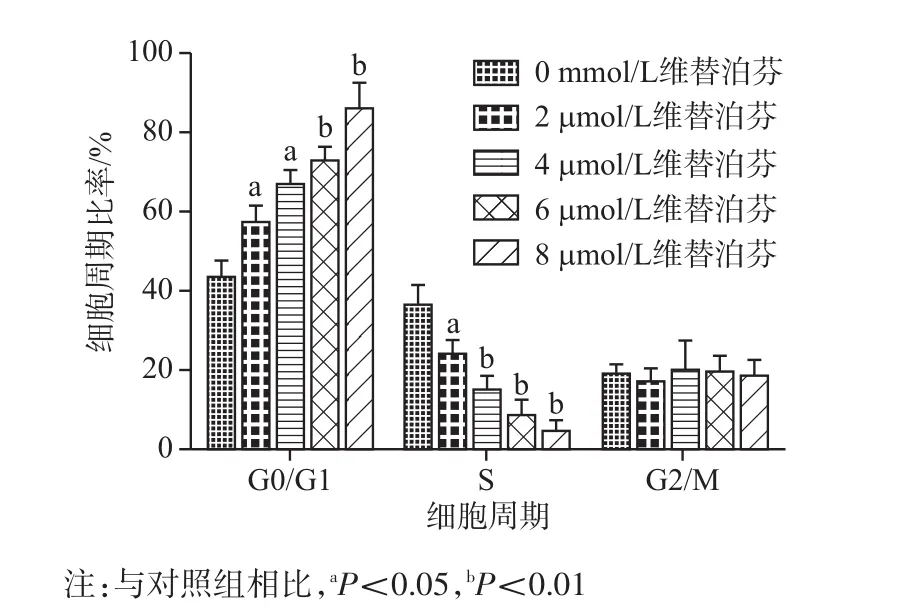
图2 不同浓度维替泊芬影响MG63细胞周期分布
2.3 维替泊芬诱导MG63细胞凋亡不同浓度(0、2、4、6、8 μmol/L)维替泊芬处理MG63细胞24 h后,采用Annexin V/PI双染检测细胞凋亡率,结果显示不同浓度(0、2、4、6、8 μmol/L)维替泊芬处理24 h均可诱导MG63细胞凋亡,与对照组相比差异有统计学意义(P<0.05或P<0.01),且凋亡率随着维替泊芬浓度的增加而逐渐增高。各浓度下(0、2、4、6、8 μmol/L)细胞凋亡率分别为:(6.19±0.52)%、(8.02±0.43)%、(10.95±0.95)%、(25.44±0.40)%、(32.19±0.82)%(F=302.68,P<0.05)。见图3。
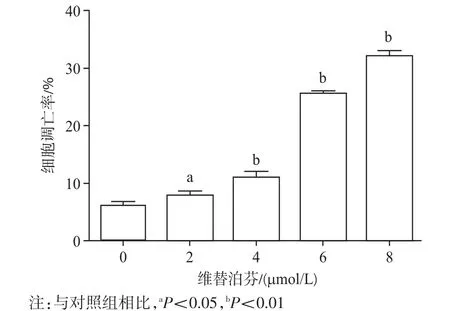
图3 维替泊芬处理MG63 24 h后对骨肉瘤MG63细胞凋亡率的影响
2.4 维替泊芬抑制骨肉瘤MG63细胞迁移和侵袭细胞划痕实验结果显示,与对照组相比,不同浓度(0、2、4、6、8 μmol/L)维替泊芬处理MG63细胞后迁移率均降低,6 μmol/L和8 μmol/L维替泊芬处理组开口区域明显增宽,差异有统计学意义(P<0.05或P<0.01)(见图4A)。同样,Transwell实验结果显示维替泊芬处理后MG63细胞侵袭性下降,其中6 μmol/L和8 μmol/L处理组较对照组显著降低,差异有统计学意义(P<0.05或P<0.01)(见图4B)。其中各浓度下(0、2、4、6、8 μmol/L)划痕闭合率分别为:(48.33 ±0.88)%、(42.33 ± 2.60)%、(40.00 ± 2.87)%、(36.67 ±3.18)%、(28.00±3.79)%(F=6.99,P=0.006)。各浓度下(0、2、4、6、8 μmol/L)细胞侵袭数分别为:(137.00±5.29)个、(124.67±6.77)个、(115.67±6.17)个、(110±5.13)个、(87.33±3.71)个(F=11.25,P=0.001)。
2.5 维替泊芬抑制YAP1及其相关靶基因的表达采用蛋白质印迹法检测YAP1及TEAD1表达的变化。结果显示,不同浓度(0、2、4、6、8 μmol/L)维替泊芬处理MG63细胞24 h后,YAP1及其转录因子TEAD1的表达水平均降低(P<0.05),而磷酸化YAP1表达水平不变(见图5),提示维替泊芬能抑制MG63细胞的YAP1及其下游靶基因TEAD1表达。
3 讨论
越来越多研究表明细胞信号转导通路介导骨肉瘤耐药,如磷酯酰肌醇3激酶/蛋白激酶B(PI3K/Akt)、Notch、Wnt/β-catenin 及葡萄糖转运 蛋 白(GLUT1)等[11-14]。有文献报道Hippo信号通路参与骨肉瘤耐药过程,且其关键分子YAP1可能成为骨肉瘤治疗的药物靶点[6],寻找Hippo信号通路上游药物作用靶点抑制剂有望为骨肉瘤治疗带来新的希望。
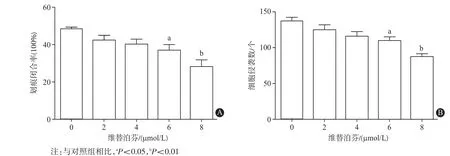
图4 维替泊芬处理MG63 24 h后对骨肉瘤MG63细胞迁移(A)与侵袭(B)的影响
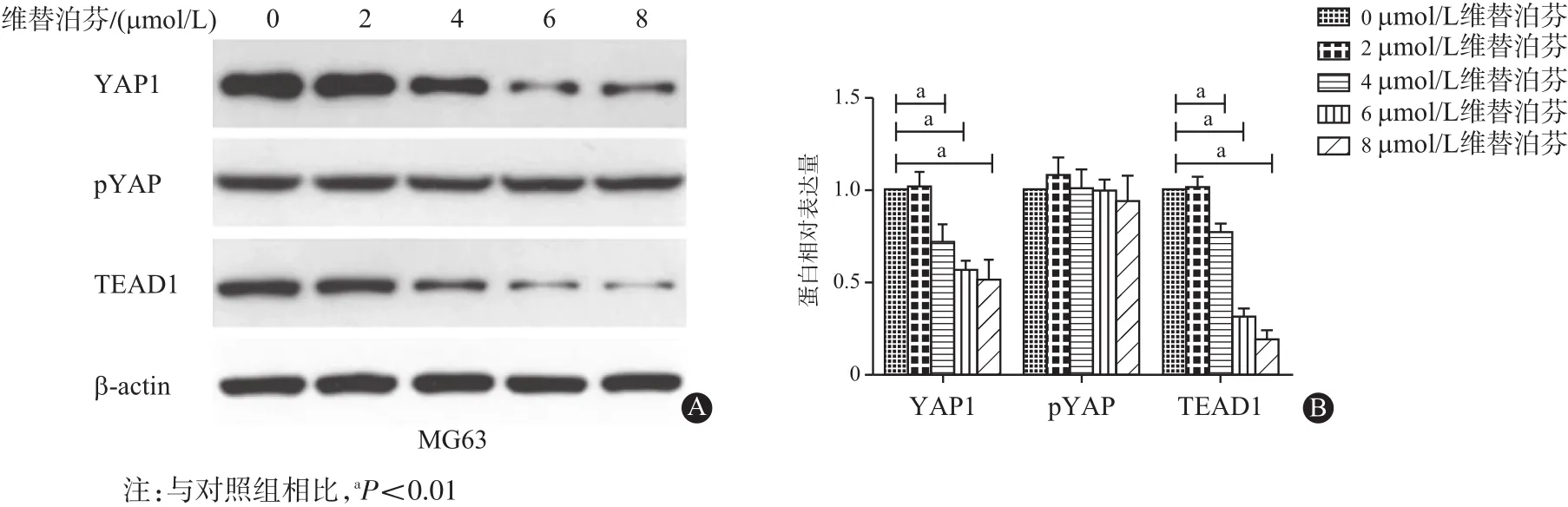
图5 维替泊芬对骨肉瘤MG63细胞Yes-相关蛋白1(YAP1)、磷酸化Yes-相关蛋白1(pYAP1)、TEA转录因子1(TEAD1)蛋白表达的影响:A为蛋白电泳图;B为量化图
目前维替泊芬作为非光敏剂治疗多种肿瘤的研究引起许多学者的注意[8],蒋玉林等[9]研究证实维替泊芬可抑制乳腺癌MDA-MB-231细胞的增殖、迁移及侵袭,而Al-Moujahed等[15]证实维替泊芬可抑制胶质瘤LN229和SNB19细胞体外生长。然而关于维替泊芬对骨肉瘤细胞的影响还尚未有报道。本实验探究了维替泊芬对骨肉瘤细胞株MG63细胞增殖和凋亡的影响,发现维替泊芬能够抑制MG63细胞的增殖,使MG63细胞周期阻滞于G0/G1期,并促进其凋亡,且均呈浓度依赖性,这与Zhang等[11]在胰腺导管腺癌中的研究结果相一致。同时,本研究发现维替泊芬对MG63细胞的迁移及侵袭能力具有抑制作用,且呈浓度依赖性。
近年来,越来越多研究表明维替泊芬作为YAP1抑制剂在治疗各种肿瘤中发挥着重要作用[16]。YAP1作为Hippo通路的核心效应蛋白,可转移至细胞核内通过与TEAD1蛋白以及其他转录因子形成复合物,触发下游靶基因如Areg的转录,进而促进肿瘤形成[4]。研究表明维替泊芬能够作用于YAP1-TEAD1复合物,破坏其结构后预防致癌性生长达到抑制肿瘤的作用[16]。Liu等[17]研究证实,体内高表达YAP1或者失活神经纤维瘤病Ⅱ型(NF2)会引起肝脏组织过度生长,而采用维替泊芬治疗后肝脏的生长速度受到抑制。Brodowska等[18]研究视网膜母细胞瘤细胞的生长和生存能力机制时,发现维替泊芬能够干扰YAP1-TEAD1复合物的形成,从而延长癌细胞的倍增时间。李美娇等[19]研究发现维替泊芬通过下调YAP1、TEAD1表达抑制鼻息肉细胞生长;Wei等[10]也发现维替泊芬通过摧毁YAP1-TEAD1复合物可以抑制胰腺导管腺癌存活、血管生成及仿血管发生。本实验采用蛋白质印迹法检测了维替泊芬处理后YAP1、pYAP1、TEAD1的蛋白表达水平,结果显示YAP1、TEAD1表达下调,而pYAP1表达不变,与上述研究结果相符,表明维替泊芬可能通过下调YAP1、TEAD1,阻止YAP1与TEAD1相结合,抑制MG63细胞的增殖、迁移及侵袭能力,而促进其凋亡。
但是本研究也存在一些缺陷。首先,本研究仅采用了一种骨肉瘤细胞系进行研究,是否适用于其他骨肉瘤细胞系及原代骨肉瘤细胞尚需进一步研究;其次,本研究没有进行动物体内实验,是否在体内同样具有良好的效果值得进一步探讨;另外,本研究设置的观察时间和浓度范围较窄,虽然发现了时间、浓度依赖性,但不能排除可能存在平台期和峰值浓度,尚需深入研究。

