沉默Fis1基因对METH诱导体外培养SH-SY5Y细胞增殖能力、线粒体膜电位和超微结构的影响
黄仕美,牟登峰,王 琪,郑 丹,齐晓岚,官志忠,于燕妮,楼迪栋
(1. 贵州医科大学法医学院法医病理学教研室, 贵州 贵阳 550004; 2. 贵阳妇幼保健院围产期保健科,贵州 贵阳 550004;3. 贵州医科大学地方病与少数民族疾病教育部重点实验室,贵州省医学分子生物重点实验室,贵州 贵阳 5500044. 贵州中医药大学基础医学院,贵州 贵阳 550004)
甲基苯丙胺(methamphetamine,METH)因毒性较低、起效较快、作用持久,并趋向低龄化,已严重危害到公共卫生安全和社会安全。探索METH致神经细胞的神经毒性机制,获取治疗和预防METH神经毒性的方法已迫在眉睫。研究认为,线粒体病理过程与METH致细胞损伤密切相关,包括线粒体氧化还原平衡[1]、线粒体自噬[2]、线粒体钙管理[3]、线粒体能量合成[4]和线粒体促凋亡因子释放[5]。线粒体过度分裂产生新的线粒体,新生线粒体膜电位较低、线粒体DNA(mitochondrial DNA,mtDNA)含量低[1,6],这些受损的线粒体不能产生足够的ATP来促进细胞新陈代谢,而且释放出促凋亡因子进入细胞质/细胞核,以启动线粒体凋亡途径[7-8]。例如,在内皮氧化损伤中,线粒体分裂损害线粒体DNA转录和复制,并因此抑制线粒体呼吸复合物的表达[6],导致ATP消耗。我们前期研究发现,METH可诱导体外培养人神经母细胞瘤细胞(human neuroblastoma cells,SH-SY5Y cells)增殖能力减弱,线粒体膜电位(mitochondrial membrane potential,MMP)水平下降,线粒体超微结构改变,线粒体趋向分裂,启动线粒体自噬,并发现线粒体融合蛋白1(mitofusin 1,Mfn1)和线粒体分裂蛋白1(fisson 1,Fis1)蛋白表达异常,这些线粒体形态与功能改变可能与Mfn1和Fis1调节的线粒体动力学有关。为进一步探索METH诱导SH-SY5Y细胞毒性损伤与Fis1之间的相互关系,本研究拟通过沉默Fis1基因,下调Fis1蛋白表达后,检测和观察METH诱导SH-SY5Y细胞增殖能力、MMP水平和线粒体超微结构,探讨Fis1在METH诱导体外培养SH-SY5Y细胞增殖能力、线粒体膜电位和超微结构变化中的作用。
1 材料与方法
1.1 细胞SH-SY5Y细胞,购于Sigma公司。
1.2 试剂与仪器METH(美国Cerilliant公司,标准品编号:M-009,纯度:99.9%);siRNA(上海吉玛制药技术有限公司);脂质体LipofectamineTM3000(美国Invitrogen公司);JC-1线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司);胎牛血清(美国BI公司);兔抗人Fis1单克隆抗体(美国Abmart公司);兔抗人β-actin抗体(美国Gene Tex公司)。恒温细胞培养箱、ND2000型超微量紫外分光光度计(美国Thermo公司);ELX800UV酶标仪、化学发光成像系统(美国Bio-Rad公司);DMi8型倒置显微镜(德国Leica公司);H-7650型透射电镜(日本Hitachi公司);AllegraX-30R高速冷冻离心机(美国Beckman公司)。
1.3 细胞培养、转染及METH处理将体外培养SH-SY5Y细胞冻存管迅速放入37 ℃恒温水浴箱中,轻轻摇动融化后移入培养瓶中,并加入4 mL的完全培养基(90%高糖DMEM培养基+10%灭活胎牛血清+1%双抗),轻柔匀速吹打细胞制成单细胞悬液,放入37 ℃、5% CO2恒温培养箱中培养。次日更换培养基,继续放入恒温箱中培养。待培养瓶中细胞贴壁长至80%~90%时,将细胞按1×106·mL-1的密度接种于6孔培养板。待细胞贴壁生长至70%~80%进行转染,转染实验按照说明书严格操作。分组:未沉默组(0 mmol·L-1METH、1.0 mmol·L-1METH、2.0 mmol·L-1METH);沉默阴性组(0 mmol·L-1METH+siRNA-NC、1.0 mmol·L-1METH+siRNA-NC、2.0 mmol·L-1METH+siRNA-NC),siRNA-NC非特异性序列:5′-UUCUCCGA ACGUGUCACGUTT-3′,5′-ACGUGACACGUUCGGAGA ATT-3′;沉默组(0 mmol·L-1METH+siRNA-Fis1、1.0 mmol·L-1METH+siRNA-Fis1、2.0 mmol·L-1METH+siRNA-Fis1),siRNA-Fis1特异性序列:5′- GCUGUGUCCAAGUCCAAAUTT-3′,5′-AUU UG GACUUGGACACAGC TT- 3′。METH诱导未沉默组、沉默阴性组和沉默组24 h,浓度和时间选择参照文献[9]和细胞增殖-毒性检测实验(CCK-8)结果。
1.4 CCK-8法检测细胞增殖将siRNA-Fis1和siRNA-NC分别转染后的细胞消化、吹打成单细胞悬液,按1×104个/孔接种于96孔培养板中,放入37 ℃、5% CO2恒温培养箱中培养。待细胞贴壁长至60%~70%时,换含有METH(0、1.0、2.0 mmol·L-1)的培养液培养,未沉默组、沉默阴性组和沉默组的每个浓度做6个复孔,METH诱导24 h后,向每孔加入10 μL CCK-8溶液,将96孔板放入37 ℃、5% CO2恒温培养箱中孵育3 h后,用酶标仪测定在450 nm处的吸光度(OD)值,并计算细胞存活率。细胞存活率/%=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.5 Western blot法检测Fis1蛋白表达水平使用RIPA裂解细胞提取总蛋白,超微量紫外分光光度计检测各样本蛋白浓度。经12%聚丙烯酰胺凝胶电泳分离蛋白(浓缩胶电泳80 V,分离胶电泳120 V)、转膜(100 V,45 min。)、室温封闭2 h后,一抗Fis1(1 ∶2 000)、β-actin(1 ∶5 000)4 ℃孵育过夜,二抗(1 ∶10 000)室温孵育1 h。将PVDF膜与超敏发光液(ECL)试剂反应1 min后,使用化学发光成像系统扫描PVDF膜,ImageJ软件分析Fis1蛋白条带,使用β-actin蛋白条带校正。
1.6 MMP检测采用JC-1法,按照试剂盒说明书操作。使用倒置荧光显微镜观察METH诱导SH-SY5Y细胞24 h后的各组细胞的红、绿荧光,计算机采集荧光图像,使用ImageJ软件重叠红绿荧光,将合成荧光的光密度比值作为膜电位表达水平值。
1.7 透射电镜观察体外培养SH-SY5Y细胞线粒体超微结构收集细胞;将细胞固定于2.5% 戊二醛溶液中4 h(4 ℃),0.1 mol·L-1PBS漂洗;1%锇酸溶液后固定2 h(4 ℃),0.1 mol·L-1PBS漂洗;丙酮脱水;Epon812树脂包埋;切片;醋酸铀、硝酸铅染色;在H-7650型透射电镜下,根据观察内容不一选择不同的放大倍数进行超微结构观察和拍照;每个样本随机拍片9张,同时避免同一细胞重复拍照。将类圆形(短轴/长轴≥0.7)线粒体定义为小球状线粒体,短轴/长轴<0.7的线粒体定义为棒状线粒体,并排除因为图片质量模糊等原因不能明确定义形态的线粒体。计数每组样本中棒状线粒体数和小球状线粒体数,小球状线粒体数与棒状线粒体数比值代表线粒体分裂水平。
2 结果
2.1 CCK-8法检测结果如Fig 1所示,使用METH(0、1.0、2.0 mmol·L-1)诱导体外培养SH-SY5Y细胞24 h后,SH-SY5Y细胞存活率随METH浓度的增加而减小(P<0.05),METH抑制SH-SY5Y细胞增殖。且在2.0 mmol·L-1METH诱导下,沉默组细胞存活率明显高于未沉默组和沉默阴性组(P<0.05)。
2.2 沉默Fis1基因对Fis1蛋白表达的影响如Fig 2所示,未沉默组、沉默阴性组和沉默组中,各组组内与对照组(0 mmol·L-1METH)比较, 1.0和2.0 mmol·L-1METH诱导SH-SY5Y细胞,Fis1蛋白表达水平分别升高31%、47%,32%、45%,22%、51%(P<0.05);与未沉默组相同浓度比较,沉默组Fis1蛋白表达水平分别降低27%、32.5%、25%(P<0.05);与沉默阴性组相同浓度比较,沉默组Fis1蛋白表达水平分别降低31%、36%、28%(P<0.05)。
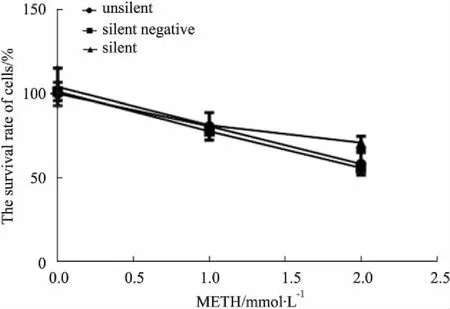
Fig 1 Effect of METH on survival rate of SH-SY5Y cells cultured in vitro
2.3 SH-SY5Y细胞MMP水平如Tab 1、Fig 3所示,未沉默组、沉默阴性组和沉默组中,各组组内与对照组(0 mmol·L-1METH)比较, 1.0和2.0 mmol·L-1METH诱导SH-SY5Y细胞,MMP水平降低(P<0.05),荧光显微镜下,随METH浓度增加,SH-SY5Y细胞红色荧光减弱,绿色荧光增强;与未沉默组和沉默阴性组相同浓度比较,沉默组MMP水平升高(P<0.05),红色荧光增强。

Tab 1 MMP red-green overlapping fluorescence ratio of SH-SY5Y cells cultured in vitro between control groups and METH treatment groups n=3)
*P<0.05vscontrol
2.4 METH对SH-SY5Y细胞线粒体超微结构的影响如Tab 2、Fig 4所示,与对照组(0 mmol·L-1METH)比较,未沉默组、沉默阴性组和沉默组在2.0 mmol·L-1METH诱导24h后,透射电镜观察见各组线粒体小球状结构增加,线粒体分裂水平明显增高(P<0.01);与未沉默组和沉默阴性组比较,沉默组线粒体分裂水平差异无显著性(P>0.01)。未沉默组和沉默阴性组中部分线粒体呈现出空泡化,损伤严重,同时在沉默阴性组中发现自噬溶酶体,沉默组中个别棒状结构的线粒体内外膜完整,线粒体嵴清晰可见。
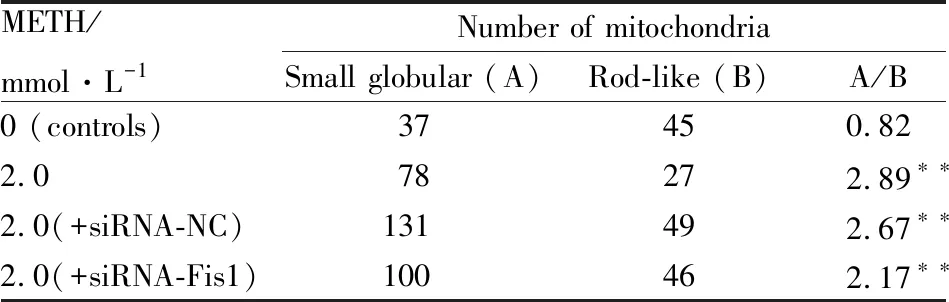
Tab 2 Comparison of ratio of small globular mitochondria to rod-like mitochondria in SH-SY5Y cells cultured in vitro for 24 h (n=9)
**P< 0.01vscontrol
3 讨论
METH俗称“冰毒”,具有极强的精神兴奋和致幻作用,METH长期滥用已严重危害社会安全,探明METH的神经毒性机制可为预防和治疗METH的神经毒性作用探寻高效、便捷的靶点。Parameyong等[9]研究认为,METH通过诱导线粒体分裂途径,引起SH-SY5Y细胞线粒体动力学紊乱,参与线粒体碎裂成小球状结构。此外,MMP的下降是线粒体膜损伤和细胞凋亡的早期指标,此过程与线粒体不断的分裂有关[10]。线粒体分裂过度或融合不足都会导致线粒体碎裂,降低呼吸作用和能量生产,增加神经元损伤和细胞凋亡的可能性[11]。Fis1的过度表达可以导致线粒体分裂,造成线粒体功能障碍,导致细胞凋亡,药物抑制分裂可以减轻细胞凋亡[12]。我们前期实验也发现[13],METH可诱导体外培养SH-SY5Y细胞增殖能力减弱,MMP水平下降,线粒体超微结构改变,线粒体趋向分裂,启动线粒体自噬,并发现Mfn1和Fis1蛋白表达异常,这些线粒体形态与功能改变可能与Mfn1和Fis1调节的线粒体动力学有关。为了进一步研究Fis1在METH诱导SH-SY5Y细胞损伤中的重要作用,本实验通过基因干扰法,沉默Fis1基因,探讨Fis1在METH诱导SH-SY5Y细胞损伤中的作用。
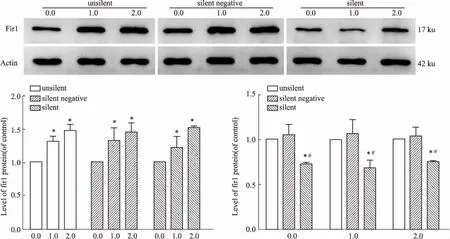
Fig 2 Expression of Fis1 protein in SH-SY5Y cells n=3))*P<0.05 vs control; #P<0.05 vs silent negative group
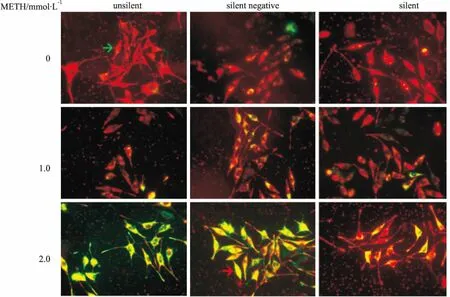
Fig 3 MMP in SH-SY5Y cells cultured in vitro detected by red-green overlapping fluorescence (×400) Green arrows indicate the normal MMP, while red arrows indicate the decreased MMP.
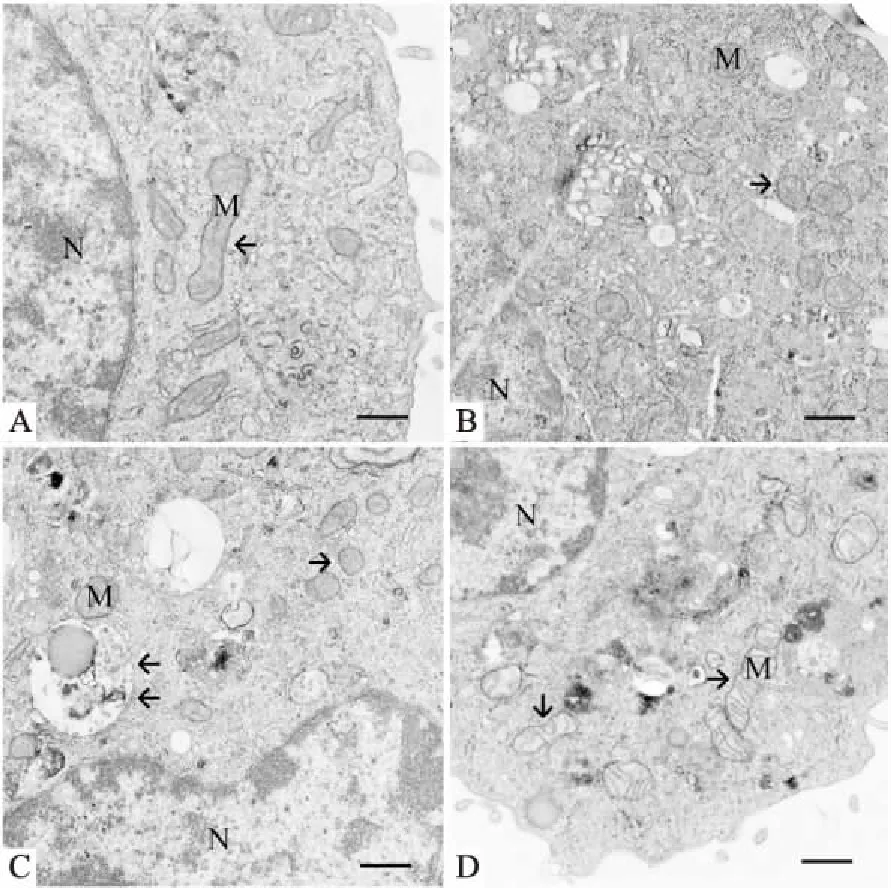
Fig 4 Observation of mitochondrial ultrastructure of SH-SY5Y cells by TEM (scale bar= 5 μm)
A: Control groups, mitochondria elliptical rod-like structure, normal and clear; B: Unsilent groups: mitochondrial globular structure increased significantly (arrow); C: Silent negative groups: mitochondrial globular structure increased significantly (arrow); D: Silent groups, mitochondrial globular structure decreased, rod structure increased (arrow). M: mitochondria; N: nuclei.
实验发现,CCK-8实验中,未沉默组、沉默阴性组和沉默组随着METH浓度增加,细胞存活率均减小(P<0.05),表明METH对体外培养SH-SY5Y细胞具有毒性作用;且未沉默组和沉默阴性组细胞存活率减小趋势相近,表明沉默试剂对细胞无毒性作用或毒性作用微小,不足以降低细胞存活率,排除沉默试剂对细胞毒性的干扰;同时发现,2.0mmol·L-1METH诱导SH-SY5Y细胞24 h后,与未沉默组和沉默阴性组比较,沉默组对应细胞存活率明显提高(P<0.05),表明沉默Fis1基因可以减轻细胞损伤,提高细胞增殖能力。进一步研究发现,体外培养SH-SY5Y细胞经METH诱导24h后,未沉默组、沉默阴性组和沉默组组内的MMP水平随METH的浓度增高呈现降低趋势(P<0.05),但与未沉默组和沉默阴性组相同浓度相比,沉默组MMP水平呈现上升趋势(P<0.05),MMP得以恢复或接近正常水平,表明沉默Fis1基因对稳定MMP水平起到重要作用。透射电镜下观察见对照组线粒体多呈现棒状结构,线粒体内外膜结构良好,线粒体嵴清晰、正常;未沉默组和沉默阴性组线粒体多为小球状结构,部分空泡化,并再次观察到自噬现象,和前期实验现象基本一致[13];沉默组中个别棒状结构的线粒体内外膜保持良好,线粒体嵴清晰可见,虽然与未沉默组和沉默阴性组比较,统计球状小泡结构/棒状结构(A/B)无明显统计学意义,但A/B值下降仍很明显;这也部分表明沉默Fis1基因可以抑制Fis1蛋白表达,从而可能减弱线粒体过度分裂,线粒体损伤程度得以减轻。沉默Fis1基因,Fis1蛋白表达水平下调,透射电镜下观察线粒体超微结构部分改善,MMP水平上升,细胞增殖能力增强。我们推测,沉默Fis1基因抑制Fis1蛋白表达后,线粒体分裂功能下降,稳定线粒体膜结构,提高MMP水平,降低METH对体外培养SH-SY5Y细胞的神经毒性作用,可恢复细胞增殖功能。
综上所述,沉默Fis1基因,可下调Fis1蛋白表达,可降低线粒体分裂水平和线粒体膜损伤,部分恢复SH-SY5Y细胞增殖能力。线粒体功能紊乱可能是METH诱导体外培养SH-SY5Y细胞神经毒性的重要机制之一,Fis1可能在METH诱导体外培养SH-SY5Y细胞线粒体形态与功能紊乱中起关键作用。