地中海贫血和G6PD缺乏症联合检测在产前检查中的应用效果评价
欧阳碧微 陈武玲
[摘要] 目的 探讨地中海贫血和葡萄糖6-磷酸葡萄糖脱氢酶(G6PD)缺乏症联合检测在产前检查中的应用效果。方法 选择2017年3月~2018年3月在本院待产的孕妇200例,对所有孕妇在产前检查中进行地中海贫血和G6PD缺乏症联合检测。观察记录孕妇的地中海贫血和G6PD缺乏症检出率及对检查工作的满意度。 结果 200例研究对象中,共检出地中海贫血22例(11.00%),檢出G6PD 16例(8.00%),筛查准确率高。22例地中海贫血中,α-地中海贫血12例(6.00%)、β-地中海贫血6例(3.00%)、αβ复合型地中海贫血4例(2.00%);16例G6PD中,单纯G6PD 12例(6.00%),G6PD合并地中海贫血4例(2.00%);根据结果显示,研究对象对检查工作的满意度高,总满意度为98.00%。 结论 在产前检查的过程中,加入地中海贫血和G6PD缺乏症检测项目,能够及时检出孕妇有无地中海贫血和G6PD缺乏症,做好预后工作,并且孕妇对于检查工作的满意度也较高,值得推广。
[关键词] 地中海贫血;G6PD缺乏症;产前检查;应用效果
[中图分类号] R714.5;R440 [文献标识码] B [文章编号] 1673-9701(2019)26-0130-03
[Abstract] Objective To investigate the application effect of combined detection of thalassemia and glucose 6-phosphate glucose dehydrogenase(G6PD) deficiency in prenatal examination. Methods A total of 200 pregnant women who delivered in our hospital from March 2017 to March 2018 were enrolled. All pregnant women were tested for thalassemia and G6PD deficiency in prenatal examinations. The detection rate of thalassemia and G6PD deficiency in pregnant women and satisfaction with the examination were observed. Results Of the 200 subjects, 22 (11.00%) of thalassemia and 16 cases(8.00%) of G6PD were detected. The screening accuracy was high. Among the 22 cases of thalassemia, 12 cases (6.00%) of α-thalassemia, 6 cases (3.00%) of β-thalassemia, 4 cases (2.00%) of αβ complex thalassemia were detected. In 16 cases of G6PD, there were 16 cases of G6PD(6.00%), and 4 cases of G6PD combined with thalassemia(2.00%). According to the results, the subject was highly satisfied with the examination work, and the total satisfaction was 98.00%. Conclusion In the process of prenatal examination, the thalassemia and G6PD deficiency test program can be used to detect the presence of thalassemia and G6PD deficiency in pregnant women timely, to make prognosis work, and the satisfaction of pregnant women is higher. It is worth promoting.
[Key words] Thalassemia; G6PD deficiency; Prenatal examination; Application effect
产前检查的意义在于通过产检为孕妇进行全面的检测,帮助孕妇建立妊娠保健手册,为孕妇确定基本的孕周、预产期等情况,让孕妇在孕期更加有规划。产前检查的工作不仅能了解孕妇的身体状况,是否适宜妊娠,在一定程度上也能提升优生率[1]。地中海贫血患者非常痛苦,给家庭和社会带来的负担非常大,目前没有药物可以治疗地中海贫血,重度地贫患者基本上都是靠输血疗法进行治疗,输血本身就是无底洞,而且目前全国范围内的血荒更是导致很多血站不愿意把血液给地贫患者输送,因此现在整个地贫患者的治疗成为一个社会性的大问题,并且长期输血会造成铁过载现象,还需要临床上药物治疗[2]。地贫是一种隐性基因遗传病,完全可以通过孕期检查出来,多数人只是携带地贫基因而不表现出任何贫血症状,我们称之为地贫基因携带者。而在对孕妇进行产前检查过程中,一定要注意分析孕妇的地中海贫血和葡萄糖6-磷酸葡萄糖脱氢酶(G6PD)缺乏症检测情况,避免地中海贫血遗传给胎儿,保障胎儿的健康发育[3]。本次研究对比分析地中海贫血和G6PD缺乏症联合检测在产前检查中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年3月~2018年3月在我院待产的孕妇200例,其中初产妇140例,经产妇60例;年龄21~38岁,平均(30.0±3.9)岁。对所有孕妇进行地贫初筛,空腹抽取静脉血2 mL于EDTA.K2抗凝管内,混匀充分后及时送检。纳入标准:待产孕妇;无妊娠糖尿病者;知情同意者。排除标准:精神疾病或既往精神疾病史以及拒絕参与本次实验者。
1.2 方法
在常规产前检查的基础上,进行地中海贫血和G6PD缺乏症联合检测[4]。
地中海贫血检查流程:①应用全自动血液分析仪进行血液学检测,特点是小细胞低色素性贫血,可以初步筛查出地中海贫血患者;检测血红蛋白(Hb)、平均红细胞体积(MCV)、平均红细胞血红蛋白量(MCH)等,MCV≤82 fl和/或MCH≤26 pg为初筛阳性。②对孕妇进行血红蛋白电泳分析,地贫初筛阳性的血样,应用全自动毛细管电泳仪进行血红蛋白电泳分析,根据电泳结果(HbA2<2.5%判为α地贫,HbA2>3.5%为β地贫)初判为α或β地中海贫血。③地贫基因检测,根据电泳结果,采用单管多重跨越断裂点Gap-PCR+导流杂交技术进行相应的地贫基因检测,主要检测α地中海贫血常见的3种缺失型(--SEA、-α3.7、-α4.2)和3种非缺失型(αCS、αQS和αWS)基因型,β常见的17种点突变基因型(CD41-42、CD71-72、CD17、-28、CD26、IVS-Ⅱ-654、IVS-Ⅰ-1、IVS-Ⅰ-5、CD43、CD31、CD27/28、-32、-29、CD30、CD14-15、CAP和Int)。④G6PD活性测定,应用全自动生化分析仪,采用酶速率1300 U/L为G6PD缺乏。
1.3观察指标
记录两组地中海贫血和G6PD缺乏症检出病例,统计总检出率;在检查完成后,采用我院自制的满意度调查表,对所有孕妇进行调查,满意度分为满意、一般、不满意三个项目,共涉及检测方法、检测服务、检测结果三个项目,评价标准如下:满意:检测对象对于检测方法、检测服务均十分满意,或检测结果精准;一般:检测对象对于检测方法、检测服务较为满意,或检测结果准确;不满意:检测对象对于检测方法、检测服务不满意,或检测结果不准确。满意+一般=总满意度。
1.4 统计学方法
采用SPSS19.0统计学软件进行数据处理,计量资料以(x±s)表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 检验结果及具体类型分析
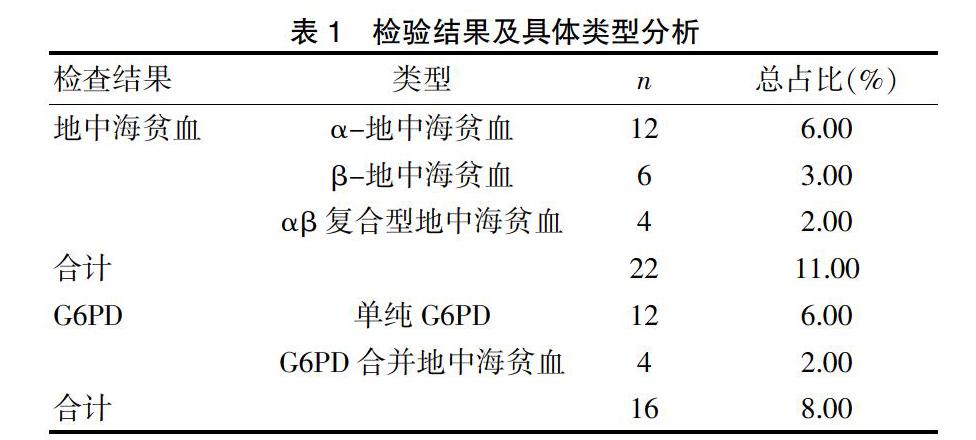
根据统计,200例研究对象中共检出地中海贫血22例(11.00%),检出G6PD 16例(8.00%),筛查准确率高。22例地中海贫血中,α-地中海贫血12例(6.00%)、β-地中海贫血6例(3.00%)、αβ复合型地中海贫血4例(2.00%);16例G6PD中,单纯G6PD 12例(6.00%),G6PD合并地中海贫血4例(2.00%)。见表1。
2.2 满意度分析
200例研究对象中,150例(75.00%)表示满意,46例(23.00%)表示一般,仅有4例(2.00%)对检查工作不满意,总满意度为98.00%,观察对象对检查工作的满意度高。
3 讨论
地中海贫血于1925年由Cooley和Lee首先描述,最早发现于地中海地区的人群,因此命名“地中海贫血”,又被称为海洋性贫血或者珠蛋白生成障碍性贫血。α-地中海贫血基因是位于16号染色体的16p13.3位点,主要相关的是HBA1和HBA2基因,这两个基因完全一样,均编码血红蛋白α链,即一对16号染色体共有4个编码α链的HBA基因,90%的α-地中海贫血由于等位基因的缺失引起,10%由点突变或其他突变引起;β-地中海贫血是位于11号染色体11p15.3位点,主要相关的是HBB基因,90%的β-地中海贫血由于点突变引起,其余部分可能由较大片段缺失或重复引起。地中海贫血属于遗传性的血液疾病,是产前检查中的一项重要筛查内容。患有地中海贫血的患儿皮肤出现斑状,颜色暗沉,肝脾日渐肿大,以脾大明显,可达盆腔[5]。由于肝脾的增大将严重影响患儿肝、胰腺等其他的器官发育,一旦器官损害就会引起心力、肝纤维化及肝功能衰竭,进而会造成患儿死亡[6]。轻症的地中海贫血一般情况下不会有生命危险。但因地贫携带者会反映出小红细胞和平均红细胞内血红蛋白含量偏低,影响其生活质量,尤其是氧负荷运动的能力(如登山、跑步、打球等剧烈运动),会因红细胞的携氧能力差而比正常人群受限。
目前世界上还没有研究出成熟的基因治疗方法,骨髓移植是目前唯一可能治愈中重度地贫的方法,但仅少部分能配型成功,且治疗费用非常昂贵[7-8]。地中海贫血可分为轻型、重型α-地贫和重型β-地贫:轻型一般无症状,重型α-地贫在怀孕约20周后,出现胎儿肝脾肿大、腹水、胸水、全身皮肤水肿。多胎死宮内或者出生后夭亡,医学上称为“巴氏水肿胎”。孕妇也可能出现高血压、全身浮肿、蛋白尿、产后大出血等危险情况,即“镜像综合征”危及生命。重型β-地贫一般在半岁后出现严重的进行性贫血和全身症状,靠定期输血维持生命,需要长期专科治疗,常导致儿童过早夭折。携带地贫基因的人,一般没有明显贫血表现,但是其下一代是地贫患儿的几率很高。临床根据病情严重程度将β地贫分为轻型、中间型和重型,轻型者属于轻度贫血,一般无症状;中间型属于中度贫血,多出现于幼童时期,但严重程度不及重型;重型者呈进行性溶血性贫血,对患儿生命和生存质量造成严重威胁。重型地贫对患儿健康和家庭的危害巨大,地贫筛查、诊断和干预是避免这种危害的最有效手段。地贫的遗传与性别无关,夫妇双方或一方有地贫基因携带,均有可能遗传给孩子,如果夫妇双方均为地中海贫血携带者,就需在孕期进行产前诊断,遵从医师的指导,通过绒毛抽取、羊膜腔穿刺或者脐静脉穿刺术采集胎儿标本,获得胎儿遗传物质(DNA),进行基因诊断。
G6PD缺乏癥也被称为蚕豆症,红细胞葡萄糖-6-磷酸脱氢酶缺乏症是一种遗传性溶血性疾病,是遗传性葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症最常见的一种遗传性酶缺乏病,是无法治愈的,主要以预防溶血为主,患儿终身不能进食蚕豆,禁服氧化特性的药物,避免引发溶血,病情严重的会导致死亡。调查发现,我国G6PD致病性变异超过30种,包括:c.95A>G(p.His32Arg)、c.392G>T(p.Gly131Val)、c.487G>A(p.Gly163Ser)、c.493A>G(p.Asn165Asp)、c.592C>T(p.Arg198Cys)、c.1024C>T(p.Leu342Phe)、c.1360C>T(p.Arg454Cys)、c.1376G>T(p.Arg459Leu)、c.1388G>A(p.Arg463His)[9-10]。G6PD缺乏症主要是由G6PD基因突变引起,导致该酶活性降低,红细胞不能抵抗氧化损伤而遭受破坏,继而引起溶血性贫血。不影响正常的生长发育,也无特别的可控药物,应注意禁食珍珠末、金银花、川莲、牛黄、腊梅花、熊胆、保婴丹。不要在蚕豆开花、结果或收获季节去蚕豆地,避免直接或间接接触而导致溶血情况发生[11-12]。根据临床研究发现,当G6PD酶活性减低,会导致还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)减少,进而引发患者体内的高铁血红素产生,且珠蛋白也会因此而发生变性的情况,在体内形成海因小体,红细胞膜也会发生过氧化损伤,不利于红细胞健康,通透性降低,抑制产生人体所需的还原物质,逐渐破坏红细胞,导致溶血发生[13-14]。在遗传方面,病因本症是一种X连锁不完全显性遗传,突变基因位于X染色体上,患者男性多于女性(比例约7:1)。女性的遗传表现比较复杂,杂合子女性G-6-PD活性偏低,但无溶血;纯合子女性可以发病,但很少见[15]。控制G-6-PD的基因呈复杂的多态性,可形成多种G6PD缺乏症的变异型。本次实验数据结果提示,在产前检查中进行地中海贫血及G6PD缺乏症的筛查,对于发现产妇有无地中海贫血和G6PD缺乏症,保障新生儿健康具有十分积极的意义。
综上所述,在产前检查过程中,进行地中海贫血和G6PD缺乏症联合检测,能够及时检出产妇有无地中海贫血和G6PD缺乏症,提前做好预后工作,有助于降低新生儿出生缺陷,提高我国人口素质,产妇对于检查工作的满意度也较高,值得推广。
[参考文献]
[1] 林广城,何英,谭燕清,等. 地中海贫血和G6PD缺乏症联合检测在产前检查中的应用价值[J]. 国际检验医学杂志,2017,38(9):1281-1282.
[2] 王添章,张利红,庞艳,等. β地中海贫血合并G6PD缺乏症患儿珠蛋白基因突变类型分析[J]. 热带医学杂志,2018,2(4):371-372.
[3] 周玉球,商璇,尹保民,等. 1998-2010年珠海市地中海贫血大规模人群的遗传筛查和产前诊断结果分析[J]. 中华妇产科杂志,2017,47(2):90-95.
[4] 刘海花,胡萍,邹红萍,等. 地中海贫血筛查在产前检查中的临床应用研究[J]. 临床医药实践,2016,25(9):646-648.
[5] 司徒文慈,阙贵珍,胡映红,等. MCV、RDW和RBC脆性在产前筛查地中海贫血中的价值[J]. 实用医学杂志,2017,27(16):2976-2977.
[6] 王晓忠,曾学辉,占葆娥,等. MCV和RBC脆性及血红蛋白电泳在产前筛查地中海贫血的价值[J]. 中国实验诊断学,2018,13(6):761-763.
[7] 赖金船. 广东省广州市增城区产前检查人群地中海贫血筛查结果分析[J]. 实用医技杂志,2016,23(3):260-262.
[8] 徐炳燕,潘华梅,利少玲. 5446例新生儿遗传代谢疾病筛查结果分析[J]. 现代诊断与治疗,2018,29(4):559-561.
[9] 叶丽花,潘慧娟,胡君燕,等. 920例地中海贫血基因突变类型分析[J]. 中国实验血液学杂志,2019,27(2):545-548.
[10] Benmansour I,Moradkhani K,Moumni I,et al. Two new class III G6PD variants[G6PD Tunis(c.920A>C:P.307Gln>Pro)and G6PD Nefza (c.968T>C:P.323 Leu>Pro)] and overview of the spectrum of mutations in Tunisia[J]. Blood cells mole Dis,2013,50(2):110-114.
[11] 敖东,李梅桂. 地中海贫血合并G6PD缺乏症G6PD活性的实验探究[J]. 中外医学研究,2015,13(3):9-10.
[12] 陈嵘,陈桂兰,屈艳霞,等. G6PD缺乏症合并地中海贫血患者G6PD活性和基因突变类型分析[J]. 中国优生与遗传杂志,2015,23(6):26-27,11.
[13] 韩璐好. 新疆少数民族G6PD缺乏症及地中海贫血分子遗传学研究[D]. 中山大学,2016.
[14] 梅敏. 汕头市龙湖地区育龄男女地中海贫血以及G6PD缺乏症发病率流行病学调查[J]. 黑龙江医学,2015, 39(7):848-849.
[15] Sirdah M,Reading NS,Perkins SL,et al. Hemolysis and Mediterranean G6PD mutation(c.563 C>T)and c.1311 C>gt;T polymorphism among palestinians at Gaza Strip[J].Blood cells Dis,2012,48(4):203-208.
(收稿日期:2019-05-23)

