前列腺慢性炎症与前列腺癌的关系
曾进 陈忠
前列腺癌是欧美等西方发达国家最常见的男性恶性肿瘤之一,美国每年前列腺癌的发病率和死亡率都位居前列,每年约3万人死于前列腺癌。亚洲前列腺癌的发病率远远低于欧美国家,但近年来呈现上升趋势,我国前列腺癌的发病率也有逐年增加的趋势[1]。前列腺炎为青壮年男性常见慢性疾病,有文献报道前列腺炎是我国男性前列腺癌发病的危险因素[2-3],首次活检为慢性前列腺炎患者是再次活检为前列腺腺癌的高风险因素[4]。然而,前列腺的慢性炎症与前列腺癌之间的因果关系,迄今为止尚未明确,炎症的致癌机制尚有待进一步研究验证。
近年来研究表明,良性前列腺增生和前列腺癌标本中慢性炎症是常见的组织学特征,且不论是去势抵抗型前列腺癌还是非去势抵抗型前列腺癌,如果患者有更高程度的炎症,他们就可能有更高的Gleason评分,提示前列腺长期慢性炎症的不良刺激是诱发前列腺癌发生潜在的高危启动因素和促进因素[5]。De Marzo等[6]认为,前列腺癌的慢性炎症可能是在许多因素的共同作用下形成的,有些因素特异性针对前列腺,其中有些因素具有靶向前列腺的能力,感染性因素和饮食因素可能就是互相联合特异性靶向作用于前列腺而致癌的。通常,前列腺的慢性炎症可能造成局部的细胞免疫反应和肿瘤监视调控异常,细胞因子分泌增多,并诱发基质细胞、上皮细胞增殖性反应或细胞变异而导致DNA损伤向突变方向转化和/或基因组不稳定,其中的某些突变可能会赋予细胞生长和抗凋亡的生物学特性[1,5-6]。因此,炎症有可能是肿瘤发生的一种遗传毒性的始动因素或细胞毒性的促进因素(图1)。并且,遗传流行病学提示前列腺癌高危基因也是炎症反应的调控基因。炎症细胞能产生导致 DNA 损害的氧化物,并分泌一些传导信号的细胞因子,这些细胞因子对周围细胞的调节非常重要,能促进周边细胞增殖。换言之,当存在氧化应激时,增生性炎症萎缩(proliferative inflammatory atrophy, PIA)、前列腺上皮内瘤(prostatic intraepithelial neoplasia,PIN) 和炎症细胞混杂处存在遗传学不稳定性和失控的细胞分裂,形成癌症生成的第一步。研究发现,生长分化因子(growth and differentiation factor, GDF)-15具有调节炎症的作用,在健康的前列腺组织中很常见,但在慢性炎症的前列腺标本中则很少见。因此,GDF-15可能在炎症的调节中起开关功能,对前列腺具有一定的保护作用[7-8]。如果 GDF-15 受到抑制,就会产生慢性炎症。此外,GDF-15 也可能抑制某些炎症细胞产生的促肿瘤因子,可能对预防前列腺癌有帮助[7]。

图1 慢性炎症与肿瘤的相关性示意图
通常,前列腺癌患者组织中的炎症现象较为常见,约占86%;在侵袭性更强的高危前列腺癌患者中则占88%,说明炎症与前列腺癌之间的确有一定的关系。随着炎症水平的增高,患前列腺癌的风险亦增加,尤其是高危前列腺癌。镜下观,前列腺癌标本中通常有3种细胞[6]:①癌细胞;②癌前细胞;③皱缩、枯萎的细胞,细胞分裂迅速,即PIA,该现象在前列腺炎症中常见,且在前列腺癌的周围前列腺组织中更为普遍。文献报道[1,5-7],PIA是一种增生性病变,可能是慢性炎症致癌的早期病变基础,是导致前列腺癌发生的危险因素。虽然PIA表面看上去皱缩不堪,但PIA 损害中细胞的增殖速度几乎与癌细胞一致,有时 PIA 细胞可与来自PIN的异常细胞相融合。同时,PIA 周围长期存在慢性炎症,似乎是损害产生引起前列腺癌的原因(图2)。 研究证实,前列腺癌和炎症的存在呈正相关,尤其是恶性程度高的患者,相关性更高。总之,炎症只是最初的一种表现,然后导致一系列损害的发生。PIA也可直接发展成前列腺癌,或经由高分级PIN间接进展成为癌[9-11]。一般认为,高级别PIN是前列腺癌的癌前病变[1,9-10]:①在含有前列腺癌的前列腺中,高级别PIN病灶的大小及数目均比无前列腺癌的前列腺中的高级别PIN要更大、更多;②高级别PIN与前列腺癌均易发生于前列腺的外周带,且绝大多数是多病灶性,二者的生物学标记和分子生物学改变也相近。但是,高级别PIN的出现并不代表前列腺癌将会发生。低级别前列腺癌,尤其是前列腺移行区的癌与高级别PIN并无相关性。
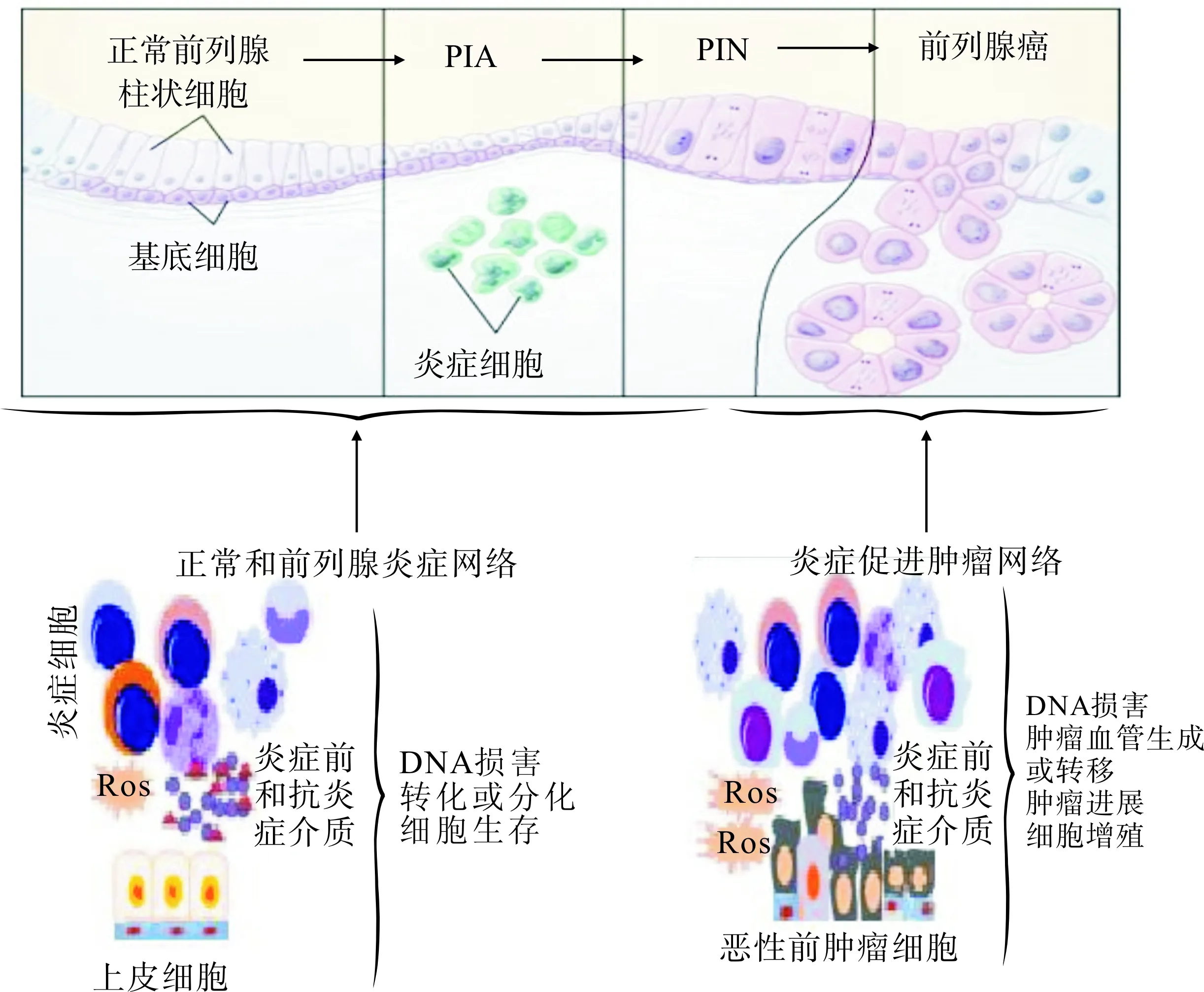
图2 PIA与前列腺癌的相关性示意图
临床和流行病学研究已经证实,慢性炎症是导致肿瘤发生和进展确切的因素之一,在启动、维持、促进肿瘤生长中发挥重要的作用。持续或低强度的炎症刺激使靶组织处于长期或过度反应而反复修复时,炎症表现为“非可控性”。通常,在肿瘤的发生过程中,免疫系统、肿瘤干细胞、基质细胞、基质微环境、肿瘤微环境和炎性细胞及其炎症微环境等形成了复杂的调控网络,通过这些路径,可以释放细胞炎症因子和重要的介质,它们对肿瘤细胞增殖和维持炎症同样重要(图3)[12]。然而,一旦肿瘤形成,则按照自己的规律进展。文献报道,炎症蛋白能够有效地促使良性细胞不发生扩散,在阻止其转变为恶性细胞过程中发挥重要作用。但并不是所有的炎症细胞都具有抗癌作用,只有部分炎症细胞能阻止癌前损害蔓延。巨噬细胞抑制细胞因子-1通过调节巨噬细胞活性参与炎症反应的重要过程。在一定的条件下,定位于染色体 19p13.1的炎症相关基因巨噬细胞抑制细胞因子-1发生突变有可能导致前列腺癌的发生[13-14]。
持续存在的炎症细胞及各种因子能将炎症相关性肿瘤微环境转化为免疫抑制微环境,从而促进肿瘤的发生、进展。通常,炎症细胞的浸润是加速癌变的充分条件,炎症微环境是肿瘤发生的必要条件。文献报道[15-16],炎症反应相关基因的遗传多态性变异与 “散发性”前列腺癌的病理发生有关。定位于8号染色体的RNASEL 基因突变和 MSR1基因突变可引起PIA, 5%~10%的PIA病变中有GSTP1基因启动子和CpG岛甲基化,进而导致PIN发展为前列腺癌。Toll样受体(TLRs)基因等参与多种信号传导通路复杂的调控机制,ROS、TNFɑ、TNFR、EMT、IL-5、IL-6、IL-7、IL-8、IL-15、IL-17、趋化因子CCL2、CXCL12、转录因子NF-κB、HIF-1α和STAT3激活等参与构成肿瘤微环境,在慢性炎症演变为肿瘤的过程中发挥作用[5、11、17-19]。炎症反应相关基因多态性TLR 4基因变异使得患前列腺癌的发病风险增加26%,TLR基因簇(TLR10-TLR1-TLR6)则可使前列腺癌的发病风险下降45%[15]。一般认为,浸润炎症细胞持续产生的ROS 是癌变的主要原因。一定条件下,ROS可引起DNA损伤、癌基因激活以及基因突变的积累,进而导致肿瘤发生。此外,持续性的炎症微环境可以加速表观遗传学的改变,导致炎症相关性肿瘤和前列腺癌的发生、进展、浸润和转移[7,17]。研究发现,前列腺癌组织中除肿瘤细胞外还存在多种大量炎性细胞,如肥大细胞、巨噬细胞、中性粒细胞等,这些炎性细胞可分泌多种细胞因子,促进炎性细胞聚集,而大量炎性细胞聚集后也可分泌蛋白溶解酶和细胞因子,这些细胞因子通过多种信号通路可刺激前列腺癌细胞生长、血管和淋巴管生成及肿瘤的浸润和转移[20-21]。
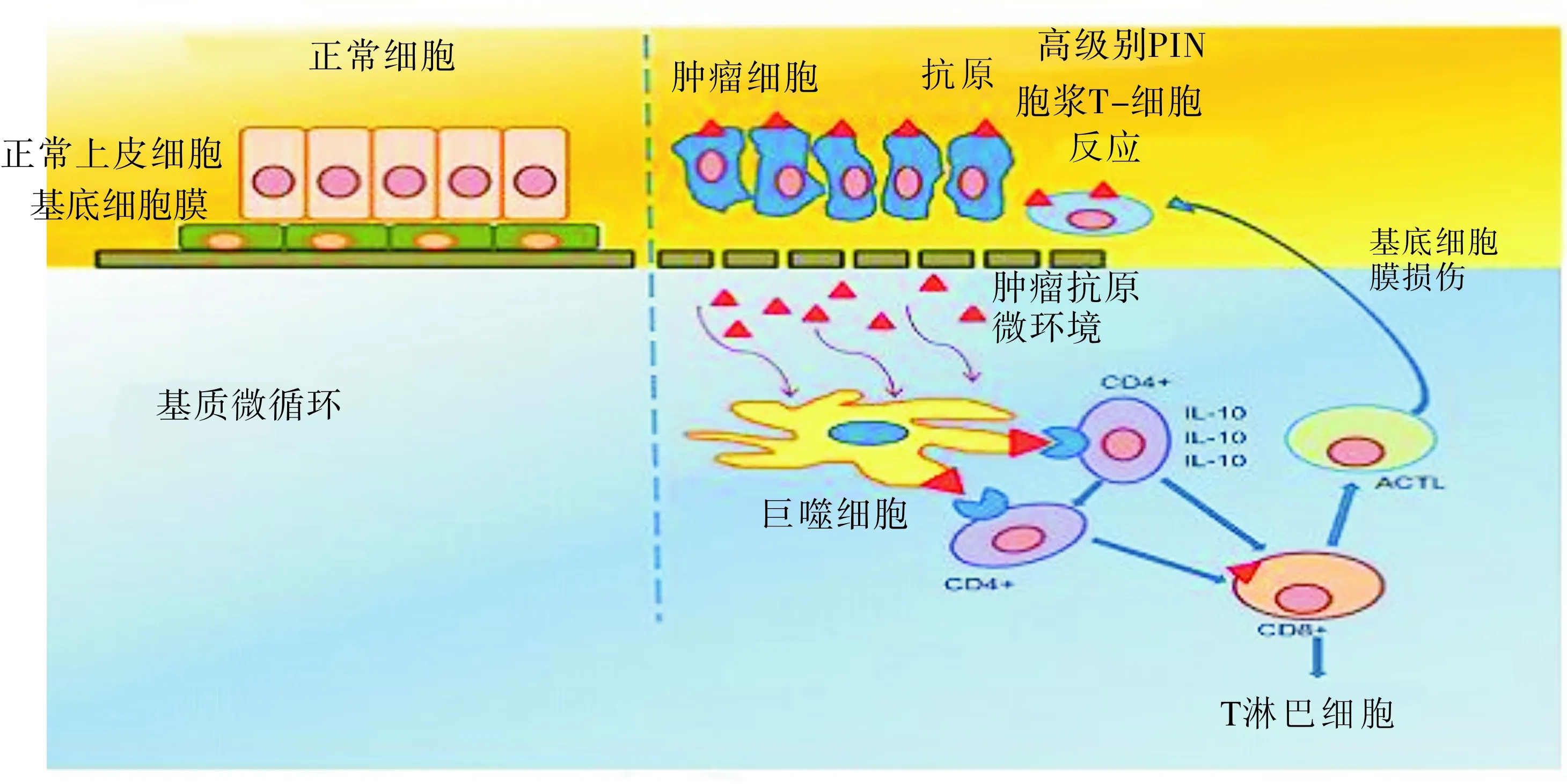
图3 前列腺癌中潜在的细胞信号传导途径异常改变炎症发展示意图
Mishra等[17]认为长期慢性炎症刺激影响癌症发生的可能机制为:①细胞损伤、DNA损害和基因组损害;②触发细胞无限增殖;③复杂的细胞因子组合促进细胞复制、血管生成和组织修复。然而,前列腺癌的发生是一个长期、多因素形成的分阶段的过程,近年来的分子遗传学研究从癌基因和肿瘤抑制基因的角度为此提供了更加有力的证明,单个基因的改变并不能造成细胞的完全恶性转化,而是需要多个基因的突变,包括几个癌基因的突变和两个或更多肿瘤抑制基因的失活、细胞凋亡调节因子和DNA修复基因的改变,关键性的步骤是癌基因突变以及肿瘤抑制基因失活。临床研究发现,前列腺慢性炎症→PIA→PIN→前列腺癌与炎症相关基因遗传多态性有关,其过程中发生了多个步骤的多种癌基因突变和肿瘤抑制基因的失活[1,15,21]。
若能知道癌症的致癌机制,就有可能采取一定的措施积极预防该癌症的发生。进一步的研究如果能证实感染是前列腺癌发病的原因之一,那么关于前列腺慢性炎症新颖的研究策略对阐明前列腺癌发生的机制具有重要意义,通过靶向控制前列腺炎症过程有助于预防前列腺癌的发生和进展[21]。
值得注意的是,迄今为止全世界范围内的文献报道中还没有发现慢性前列腺炎能够导致前列腺癌发生的直接证据,流行病学调查尚未发现慢性前列腺炎患者人群中前列腺癌的发病率高于普通人群。而且,流行病学的研究很难重复证实慢性前列腺炎与前列腺癌的发生有必然的联系,前列腺慢性炎症与前列腺癌的关系还需进一步关注及研究。

