红花檵木LcCHI基因的克隆、表达分析及转化研究
荣朵艳,张 翔,虢雅洁,王菊凤,潘 婷,杨 港,张邦跃
(1.湖南工业大学 生命科学与化学学院,湖南株洲 412007;2.百合种质资源创新与深加工湖南省工程研究中心,湖南株洲 412007;3.生物医用纳米材料与器件湖南省重点实验室,湖南株洲 412007)
红花檵木(Loropetalumchinensevar.rubrum)为金缕梅科、檵木属檵木的变种,是具中国特色的观花观叶植物,其花、叶中均可合成花青苷物质而显红色。红花檵木易于繁殖、耐修剪,同时具有较强的适应性和抗逆性,是中国南方很多省园林绿化常用的彩叶植物之一[1]。红花檵木的红色叶片具有较高的观赏价值,但中国南方地区夏季持续高温会导致其叶片颜色由红变绿,观赏价值严重降低[2]。目前,对红花檵木叶色变化的机制开展了一些研究,高温会引起红花檵木叶片花青苷物质含量的下降,高温和强光照或者高温和高湿度协同作用的胁迫条件会加快花青苷的消失,而轻度干旱有利于花青苷物质的稳定[2-5]。然而,对于红花檵木中花青苷物质合成的分子机制目前还不清楚,花青苷合成途径基因目前只有LcCHS基因得到克隆[6]。因此,开展红花檵木花青苷形成分子机制的研究,对于红花檵木的叶色育种有重要的意义。
花青苷物质是植物产生的一类重要的类黄酮物质,其生物合成过程起始于苯丙氨酸途径,有多种酶类参与催化过程,其中查尔酮异构酶(Chalcone isomerase,CHI)直接催化查尔酮形成二氢黄酮,是花青苷物质合成途径的第2个限速酶,对于包括花青苷在内的多种类黄酮物质的积累都有重要作用。目前,查尔酮异构酶基因在许多观赏植物中已经被克隆,包括矮牵牛、彩叶草、紫丁香、红掌、康乃馨等观赏植物[7-11]。
为了探究红花檵木叶片花青苷形成的分子机制,作者利用转录组测序数据和RT-PCR技术,从红花檵木中克隆到LcCHI的cDNA序列,获得基因的开放阅读框(Open reading frame,ORF),利用生物信息学的方法对LcCHI基因编码的氨基酸同源性以及结构和功能进行分析,并采用实时荧光定量PCR技术对该基因在不同组织材料中的表达进行分析。同时构建pLcCHI-SUPER1300过表达载体,并在拟南芥中异源表达,获得转基因植株,这为进一步对该基因在红花檵木花青苷生物合成中的功能研究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 试材为生长健壮的3 a生红花檵木扦插苗,于湖南工业大学校区苗圃中栽培。采集植株成熟叶或嫩叶,用液氮速冻, -80 ℃冰箱中保存,备用。于2019年3月下旬取得用于实时荧光定量PCR分析的不同组织材料(包括根、茎、成熟叶、嫩叶和花)。其中,根为新生的红色嫩根,茎和嫩叶均为春季新抽材料,成熟叶为2018年秋末抽出的叶片,花取披针形花瓣。拟南芥野生型材料哥伦比亚-0生态型(Columbia-0,Col-0)种植于营养土(腐殖土∶蛭石∶珍珠岩= 3∶1∶1)中,置于光照培养箱中生长,生长条件为:16 h光照,8 h黑暗,湿度为70%。
1.1.2 主要试剂 多糖多酚植物总RNA快速提取试剂盒购于北京艾德莱生物科技有限公司。Super M-MuLV逆转录酶、RNase Inhibitor、DH5α感受态、质粒抽提试剂盒、PCR产物纯化回收试剂盒、PCR MIX、限制性内切酶等购于生工生物工程上海有限公司。PrimeSTAR GXL高保真DNA聚合酶购于宝日医生物技术有限公司。FastStart Essential DNA Green Master试剂购自罗氏应用科学部。无缝连接试剂盒购于南京诺唯赞生物科技有限公司。农杆菌AGL0和过表达质粒pSUPER1300为生物医用纳米材料与器件湖南省重点实验室保存。其他常规试剂均为国产分析纯试剂。引物合成及测序工作均由华大基因完成。
1.2 试验方法
1.2.1 总RNA提取及cDNA第1链的合成 使用RNA提取试剂盒,提取红花檵木叶片的RNA,并用10 g/L琼脂糖凝胶电泳检测RNA的质量。利用Super M-MuLV逆转录酶合成 cDNA第1链,反应体系为20.0 μL:先加入8.0 μL RNA和1.0 μL Oligo (dT)18引物,再加入4.0 μL 5×RT 缓冲液、4.0 μL dNTP Mixture(2.5 mmol/L)、0.5 μL RNase Inhibitor和1.0 μL Super M-MuLV,最后用DEPC处理水加至20.0 μL。反应条件为:42 ℃ 50 min,65 ℃ 15 min,产物用于进一步的PCR扩增。
1.2.2 红花檵木LcCHI基因的克隆 利用已经完成的红花檵木转录组测序结果,从中筛选到1个CHI同源基因。经分析红花檵木LcCHI的cDNA序列中包含有完整的开放阅读框ORF,设计ORF上、下游区域特异引物CHI-LP和CHI-RP(表1),以cDNA为模板进行PCR扩增。PCR扩增体系为25.0 μL:2×PCR MIX 12.5 μL,上、下游引物各0.7 μL,cDNA 模板0.3 μL,ddH2O补足至25.0 μL。扩增程序为:94 ℃ 3 min;94 ℃ 30 s,51 ℃ 30 s,72 ℃ 1 min,35个循环反应; 72 ℃ 2 min。扩增产物经电泳检测正确后直接送测序(测序引物为CHI-LP和CHI-RP),以确定CHI的cDNA序列及编码框序列。
1.2.3 红花檵木LcCHI氨基酸同源性分析及功能预测 使用DNAMAN 6.0软件对LcCHI的cDNA序列进行分析,预测该基因编码的氨基酸序列;利用NCBI网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)的BLASTP对该基因编码的氨基酸同源序列进行搜索,并下载同源性氨基酸序列。利用DNAMAN 6.0软件对氨基酸序列进行多重比对,利用MEGA 6软件和非加权组平均法(UPGMA)构建系统进化树;使用NCBI网站的在线软件CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对LcCHI基因编码氨基酸的保守结构域进行分析;利用在线软件SWISS-MODEL(https://swissmodel. expasy.org/)对LcCHI蛋白的三级结构进行预测。

1.2.5 红花檵木LcCHI过表达载体构建及转化拟南芥 根据LcCHI的cDNA片段测序结果,确定了LcCHI基因的ORF完整序列。利用Primer premier 5.0软件设计能够扩增出红花檵木LcCHI基因的ORF引物CHI-ATG和CHI-TAG,以cDNA为模板进行PCR扩增。PCR扩增体系为25.0 μL:5×GXL buffer 5.0 μL,dNTP Mixture (2.5 mmol each) 2.0 μL,上、下游引物各0.7 μL,cDNA模板0.3 μL,PrimeSTAR GXL DNA聚合酶0.5 μL,ddH2O补足至25.0 μL。扩增程序为:94 ℃ 2 min;98 ℃ 10 s,55 ℃ 15 s,68 ℃ 1 min,共35个循环反应。PCR扩增产物用10 g/L琼脂糖凝胶电泳检测,产物胶回收后用无缝克隆酶连接到过表达载体pSUPER1300上,转化DH5α感受态,阳性菌经PCR鉴定后送测序鉴定。

表1 本研究所用引物Table 1 Primers used in this study
注:小写碱基为表达载体末端同源序列,用于构建重组载体;大写碱基为基因特异引物序列。
Note:Lower-case indicates bases homologous to vector ends in order to make the recombinant vector;upper-case means gene specific primers.
提取大肠杆菌阳性菌的pLcCHI-SUPER1300重组质粒,转化到农杆菌感受态AGL0中,并利用农杆菌介导的花序侵染法转化拟南芥。转基因种子在潮霉素质量浓度为25 mg/L的MS培养基上进行筛选,阳性苗转移到营养土中继续生长。待转基因植株生长5周后剪取莲座叶,分别用TRIzon法和SDS法提取叶片的RNA和DNA,RNA进一步反转录成第1链cDNA。分别以转基因植株的cDNA和DNA为模板,用ORF特异引物CHI-ATG和CHI-TAG进行转基因阳性苗的鉴定。半定量RT-PCR检测LcCHI基因的表达时选择AtACTIN8为拟南芥的内参基因(引物序列见表1)。
2 结果和分析
2.1 红花檵木LcCHI基因cDNA序列的克隆
利用红花檵木叶片转录组数据库,从中筛选出1个查尔酮异构酶(Chalcone isomerase,CHI)同源基因,命名为LcCHI。对LcCHI序列片段进行分析,发现该序列片段包含完整的ORF序列。从红花檵木成熟叶片中提取总RNA,琼脂糖凝胶电泳检测RNA质量(图1-A),利用逆转录酶合成第1链cDNA。设计CHI-LP和CHI-RP引物,以cDNA为模板,扩增出约800 bp的cDNA片段(图1-B),该片段包含LcCHI完整ORF序列,PCR产物直接送测序,确定LcCHI的ORF序列。结果表明,红花檵木LcCHI基因的ORF总长度为657 bp,编码218个氨基酸残基(图2)。
2.2 红花檵木LcCHI基因编码的氨基酸序列分析
2.2.1LcCHI多重比对及保守结构域 利用DNAMAN 6.0软件,对红花檵木LcCHI和来源于玫瑰RrCHI(AKT71851.1)、月季RcCHI(XP_024176829.1)、茶树CsCHI(ASU87415.1)、美洲葡萄VlCHI(ACS36662.1)和樱桃李PcCHI(AKV89240.1)的氨基酸序列进行同源性分析。结果显示,红花檵木LcCHI与其他植物CHI氨基酸序列高度保守,氨基酸一致性均超过75%(图3)。通过与拟南芥AtCHI和紫花苜蓿MsCHI氨基酸序列中催化位点的比对分析[12-13],发现5个氨基酸残基Arg(38)、Thr(46)、Tyr(108)、Asn(115)和Ser(192)执行LcCHI酶的催化活性(图3)。利用NCBI的在线软件CD-Search对红花檵木LcCHI进行保守结构域分析,结果表明红花檵木LcCHI属于查尔酮_3超家族成员,编码典型的查尔酮-黄烷酮异构酶(图4)。

A.总RNA Total RNA;B.CHI-LP和CHI-RP扩增的cDNA片段 cDNA sequence amplificated by using CHI-LP and CHI-RP primer pairs
图1LcCHI的cDNA序列扩增
Fig.1 Sequence amplification ofLcCHIgene

粗体下划线分别表示起始密码子和终止密码子 Underline in bold indicates initial codon and stop codon respectively
图2LcCHI的核苷酸及其氨基酸序列
Fig.2 Nucleotide and amino acid sequences ofLcCHIgene

★.酶催化残基 Enzyme catalytic residues;Lc.红花檵木Loropetalumchinensevar.rubrum;Rr.玫瑰Rosarugosa;Rc.月季Rosachinensis;Cs.茶树Camelliasinensis;Vl.美洲葡萄Vitislabrusca;Pc.樱桃李Prunuscerasifera
图3 LcCHI多重比对分析
Fig.3 Multiple alignment analysis of LcCHI

图4 LcCHI保守结构域分析Fig.4 Conserved domain analysis of LcCHI
2.2.2 LcCHI系统进化树分析 为更加明确红花檵木LcCHI氨基酸序列与其他植物中CHI氨基酸序列的进化关系,利用MEGA 6软件对来源于红花檵木LcCHI、玫瑰RrCHI、月季RcCHI、茶树CsCHI、美洲葡萄VlCHI、樱桃李PcCHI、橄榄CaCHI(AEO36936.1)、龙眼DlCHI(AEO36980.1)、美洲葡萄VlCHI(ACS36662.1)、牡丹PsCHI(AEK70330.1)、芍药PlCHI(AEK32592.1)、烟草NtCHI(NP_001312216.1)、矮牵牛PhCHI(CAA32730.1)、拟南芥AtCHI(CAB94991.1)、水稻OsCHI(AAM13448.1)和玉米ZmCHI(NP_001144002.2)进行系统进化树构建。结果如图5所示,红花檵木LcCHI氨基酸序列与玫瑰、月季和樱桃李等木本植物的亲缘性较近,而与烟草、拟南芥、水稻等草本植物的亲缘性较远。

Rr.玫瑰Rosarugosa;Rc.月季Rosachinensis;Pc.樱桃李Prunuscerasifera;Lc.红花檵木Loropetalumchinensevar.rubrum;Ca.橄榄Canariumalbum;Dl.龙眼Dimocarpuslongan;Cs.茶树Camelliasinensis;Ps.牡丹Paeoniasuffruticosa;Pl.芍药Paeonialactiflora;Vl.美洲葡萄Vitislabrusca;Nt.烟草Nicotianatabacum;Ph.矮牵牛Petuniaxhybrida;At.拟南芥Arabidopsisthaliana;Os.水稻OryzasativaJaponica Group;Zm.玉米Zeamays
图5 LcCHI系统进化树分析
Fig.5 Phylogenetic tree analysis of LcCHI


图6 LcCHI蛋白的三级结构预测Fig.6 Tertiary structure prediction of LcCHI protein
2.3 LcCHI基因在不同组织中的表达分析
对LcCHI基因在红花檵木不同组织的表达分析结果表明(图7),LcCHI在根、茎、花、成熟叶和嫩叶中均有表达,但表达存在一定的差异性。其中根中表达量最高,嫩叶、茎、花中的表达量次之,成熟叶最低,为根中表达量的1/4。
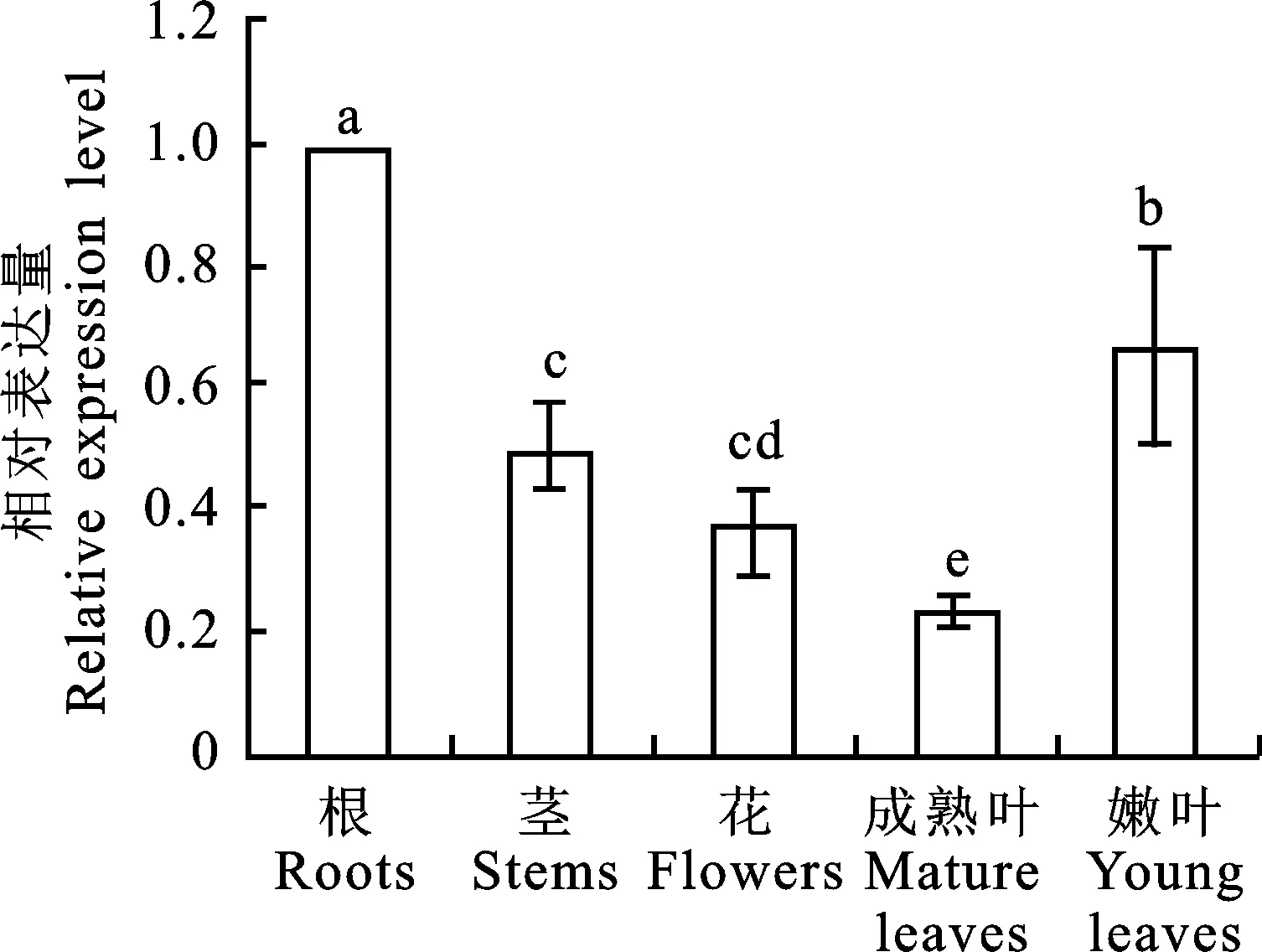
图7 不同组织中LcCHI基因的表达分析Fig.7 Relative expression of LcCHI gene in different tissues
2.4 LcCHI过表达载体构建及转化拟南芥
根据LcCHI基因的cDNA序列,设计特异引物CHI-ATG和CHI-TAG(表1,上、下游引物均包含约16 bp的载体片段),用高保真酶GXL扩增,琼脂糖凝胶电泳正确后胶回收,目的产物连接到已线性化的表达载体上,重组质粒转化大肠杆菌感受态,PCR扩增及XbaⅠ+PstⅠ质粒双酶切鉴定正确后送测序,确定过表达载体pLcCHI-SUPER1300构建成功(图8)。提取pLcCHI-SUPER1300质粒并转化到农杆菌感受态AGL0中,利用农杆菌介导的花序侵染法转化拟南芥。提取T1代转基因植株的DNA,PCR扩增LcCHI基因,在9个T1代植株中检测到7个阳性苗,确定T-DNA整合到拟南芥基因组中(图9-A)。以转基因植株的cDNA为模板、CHI-ATG和CHI-TAG为引物进行半定量RT-PCR扩增,拟南芥AtACTIN8基因为内参基因(引物序列见表1),结果显示受检测的4个T1代转基因株系中有LcCHI的表达,而野生型Col-0没有检测到LcCHI基因的表达(图9-B),表明红花檵木LcCHI基因在拟南芥中异源表达。在正常的生长条件下,转基因LcCHI的T1代植株并没有表现出明显的生长表型。

A.pLcCHI-SUPER1300载体示意图 Schematic diagram ofpLcCHI-SUPER1300;B.pLcCHI-SUPER1300的大肠杆菌PCR鉴定,Pos为质粒阳性对照,Ng为阴性对照,带1~4为大肠杆菌单克隆 PCR identification ofpLcCHI-SUPER1300 transferredEscherichiacoli, Pos is positive control of plasmid, Ng is negative control, bands 1 to 4 are clones ofEscherichiacoli;C.pLcCHI-SUPER1300质粒双酶切 Double digests ofpLcCHI-SUPER1300 plasmid
图8LcCHI过表达载体的构建
Fig.8 Construction ofLcCHIoverexpression vector
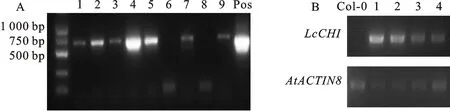
A.转基因株系DNA的PCR扩增,带1~9为T1代转基因植株,Pos为质粒阳性对照 PCR amplification of transgenic lines, bands 1 to 9 are transgenic plants, Pos is positive control of plasmid;B.转基因株系的半定量RT-PCR扩增,Col-0为阴性对照,带1~4为转基因株系,LcCHI和AtACTIN8基因扩增循环数为26个 Semi-quantitative RT-PCR amplification of transgenic lines forLcCHIandAtACTIN8with 26 cycles, Col-0 is negative control, bands 1-4 are transgenic lines
图9LcCHI转基因株系鉴定
Fig.9 Identification ofLcCHItransgenic lines
3 讨 论
花青苷是植物类黄酮次生代谢物质的一个分支途径,其在植物器官中的含量及种类与相应的器官颜色紧密相关[14]。植物花青苷的生物合成途径酶类已经得到深入的了解,其中前期关键合成酶类有查尔酮合成酶(Chalcone synthesis,CHS)、查尔酮异构酶CHI和黄烷酮-3-羟化酶(Flavanone-3-hydroxylase,F3H),后期关键酶主要有二氢黄酮醇-4-还原酶(Dihydroflavonol-4-reductase,DFR)、花青素合成酶(Anthocyanidin synthase,ANS)和UDPG-类黄酮葡萄糖转移酶(UDPG-flavonoid glucosyltransferase,UFGT),这些酶类活性的改变都可能引起相应器官中花青苷含量及颜色的变化[14-15]。
CHI是花青苷生物合成途径的第二个关键酶类,也是影响包括花青苷物质在内的多种类黄酮物质合成的限速酶。利用CHI酶活性缺失的材料,确定CHI基因在多种观赏植物花青苷生物合成过程中起重要作用。Miyahara等[11]的研究表明,康乃馨的一个CHI基因(Dca60979)的高表达与红色花的生成紧密相关,Dca60979基因转录提前终止导致花瓣积累查尔酮而形成橘黄色花。对翠菊和仙来客的黄色花形成机制研究发现,黄色花品种中查尔酮异构酶CHI的活性缺失,花青苷合成途径被阻断,花朵中积累查尔酮物质而显黄色[16-17]。利用转基因技术,研究人员也对CHI基因的功能进行分析。Nishihara等[18]利用RNAi技术对烟草中NtCHI基因功能进行分析,发现NtCHI表达的下调会引起花朵内包括花青苷在内的总黄酮物质含量的降低,同时花色变浅。将牡丹的PsCHI1基因转入烟草中,转基因材料中总黄酮醇和黄酮物质含量提升两倍,但是花瓣中花青苷物质的含量降低、花瓣颜色变淡[19]。在番茄中异源表达矮牵牛的PhCHI-A基因,转基因番茄的果皮和果肉中黄酮醇物质含量分别比对照材料增加78倍和21倍,提高了果实的营养价值[7]。在烟草中异源表达水母雪莲的SmCHI基因也可以提高总黄酮物质的含量[20]。在黄芩毛状根中过表达SbCHI合成酶基因可提高多种类黄酮物质含量,而抑制毛状根中SbCHI基因的表达会降低类黄酮物质产量[21]。因此,植物中CHI酶活性对于花青苷物质的合成是必须的,CHI酶活性的缺失或降低可用于培育淡颜色花卉品种;而CHI酶活性的增强除用于培育不同颜色的观赏植物新品种外,也可用于培育总黄酮类含量高的植物品种,提升其药用或食用价值。
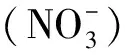
本研究还克隆了红花檵木LcCHI基因的ORF,并构建pLcCHI-SUPER1300过表达载体,在拟南芥中异源表达该基因并获得转基因植株。正常生长条件下,在多个LcCHI过表达T1代株系中并没有观察到明显的生长表型,也没有引起花青苷含量的累积,可能是因为转基因株系中合成其他的类黄酮物质(如黄酮醇、异黄酮、原花色素等)。LcCHI的过量表达对拟南芥中类黄酮物质积累的影响还需要进一步分析。在后面的研究中,将利用高效液相色谱[16]和DMACA法[22]对拟南芥转基因植株的黄酮醇、原花色素等类黄酮物质的累积进行分析,以获得LcCHI基因的生理学功能。为了确定LcCHI在红花檵木中的生物学功能,以后在建立起红花檵木遗传转化的基础上,将利用CRISPR/Cas9技术敲除该基因[23],从而进一步了解该基因在红花檵木生长发育及花青苷合成中的作用。

