吡格列酮在改善2 型糖尿病患者胰岛B 细胞 功能中的作用
黎妙仙
近年来,随着人们工作节奏加快和饮食结构变化,糖尿病的发病率呈逐年上升趋势,其中90%为2型糖尿病(T2DM),主要表现为高血糖伴胰岛素缺乏与抵抗。目前,常规西药治疗大多通过促进胰岛素分泌降低血糖,但无法改善胰岛素敏感性,保护胰岛功能,减慢病情进展[1]。有研究显示,吡格列酮辅助治疗T2DM 效果显著,可减轻胰岛素抵抗,降低血糖,调节血脂,延缓病情进展[2]。本研究就吡格列酮在改善T2DM 患者胰岛B 细胞功能中的作用进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2016年10月至2018年10月深圳市大鹏新区妇幼保健院收治的62 例T2DM 患者作为研究对象,随机分为试验组与对照组,各31 例。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。见表1。
1.2 纳入及排除标准
纳入标准:初发型T2DM;符合美国糖尿病学会2016年制定的T2DM 诊断标准[3];均签署了知情同意书且自主配合试验进行。排除标准:酮症酸中毒和高血糖高渗综合征等严重并发症;甲状腺疾病、肾上腺疾病或需使用糖皮质激素治疗等可影响试验结果的疾病;严重肝肾功能受损;妊娠或哺乳期。
1.3 治疗方法
对照组给予常规治疗,医护人员采用通俗语言向患者讲述T2DM 的发病机制、临床表现、治疗方法、注意事项等,叮嘱患者少食多餐,每天进行适量非剧烈运动;同时,口服盐酸二甲双胍缓释片(山东斯邦得制药有限公司,国药准字H20060230,500 mg/片),初始剂量为0.25 g/次,1 次/d,根据患者血糖水平调节二甲双胍使用剂量,最大剂量≤2 g/d。
试验组在对照组治疗基础上采用盐酸吡格列酮(四川迪康科技药业有限公司,国药准字H20052156,15 mg/片)治疗,1~2 片/次,1 次/d,最大剂量≤45 mg/d。两组患者均治疗4 个月。
1.4 观察指标
在治疗前及治疗结束后次日清晨抽取患者空腹肘静脉血并采用血糖测量仪测量空腹血糖(FPG), 用葡萄糖氧化酶法测量餐后2 h 血糖(2hPBG);通过全自动生化分析仪用酶法检测三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C);用酶联免疫吸附试验检测糖化血红蛋白(HbA1c);用稳态模型分析胰岛素抵抗指数(HOMA-IR)、胰岛B 细胞功能指数(HOMA-B)。
1.5 统计学分析
采用SPSS 21.0 统计软件进行数据分析,计量资料以±s表示,组间比较采用t检验,计数资料以百分率表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组HbA1c、FPG、2hPBG 比较
两组治疗前HbA1c、FPG、2hPBG 比较,差异无统计学意义(P>0.05);治疗后,两组HbA1c、FPG、2hPBG 均低于治疗前,且试验组HbA1c、FPG、2hPBG低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者HbA1c、FPG、2hPBG 比较(±s)

表2 两组患者HbA1c、FPG、2hPBG 比较(±s)
注:与本组治疗治前比较,aP<0.05;与对照组治疗后比较,bP<0.05
组别 例数 HbA1c(%) FPG(mmol/L) 2hPBG(mmol/L)对照组 31 治疗前 9.04±1.41 12.31±1.40 18.51±5.13 治疗后 6.45±0.73a 6.71±0.54a 9.24±0.92a 试验组 31 治疗前 9.01±1.02 12.46±1.24 18.35±5.25 治疗后 5.91±0.67ab 5.63±0.52ab 6.35±0.83ab
2.2 两组HOMA-IR、HOMA-B 比较
两组治疗前HOMA-IR、HOMA-B 比较,差异无统计学意义(P>0.05);治疗后,两组HOMA-IR、HOMA-B 均优于治疗前,且试验组均优于对照组,差异有统计学意义(P<0.05)。见表3。
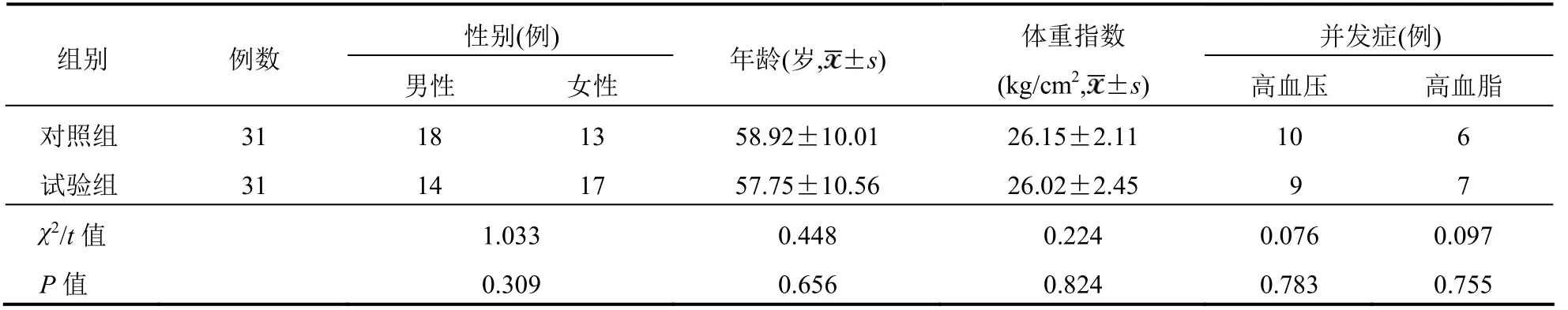
表1 两组患者一般资料比较
表3 两组患者HOMA-IR、HOMA-B 比较(±s)
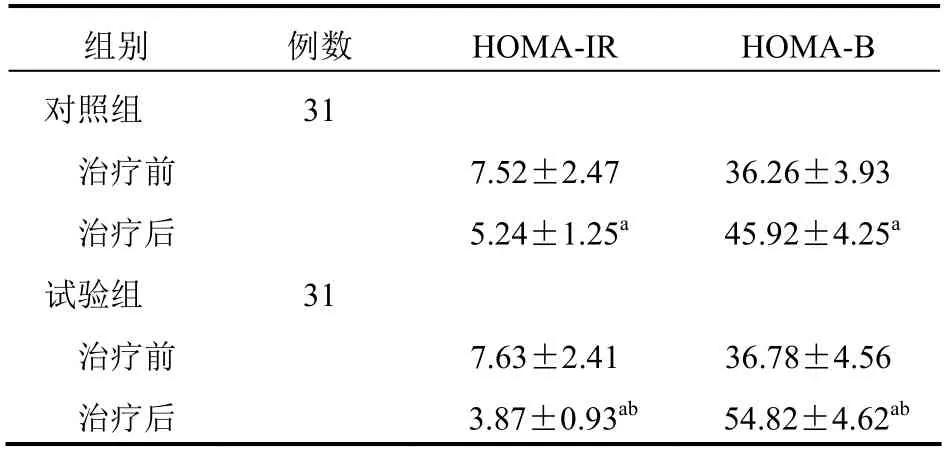
表3 两组患者HOMA-IR、HOMA-B 比较(±s)
注:与本组治疗治前比较,aP<0.05;与对照组治疗后比较,bP<0.05
组别 例数 HOMA-IR HOMA-B 对照组 31 治疗前 7.52±2.47 36.26±3.93 治疗后 5.24±1.25a 45.92±4.25a 试验组 31 治疗前 7.63±2.41 36.78±4.56 治疗后 3.87±0.93ab 54.82±4.62ab
2.3 两组TG、TC、LDL-C、HDL-C 比较
两组治疗前TG、TC、LDL-C、HDL-C 比较,差异无统计学意义(P>0.05);治疗后,两组TG、TC、LDL-C、HDL-C 均优于治疗前,且试验组均优于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组患者TG、TC、LDL-C、HDL-C 比较(mmol/l,±s)
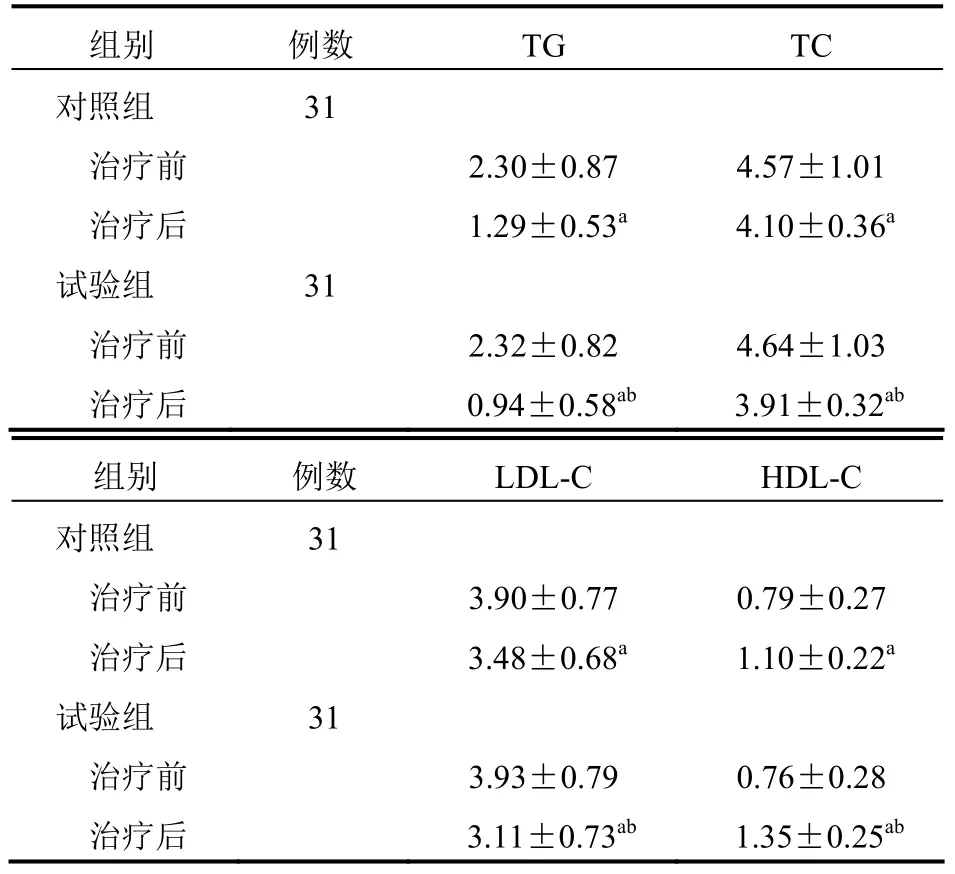
表4 两组患者TG、TC、LDL-C、HDL-C 比较(mmol/l,±s)
注:与本组治疗治前比较,aP<0.05;与对照组治疗后比较,bP<0.05
组别 例数 TG TC 对照组 31 治疗前 2.30±0.87 4.57±1.01 治疗后 1.29±0.53a 4.10±0.36a 试验组 31 治疗前 2.32±0.82 4.64±1.03 治疗后 0.94±0.58ab 3.91±0.32ab 组别 例数 LDL-C HDL-C 对照组 31 治疗前 3.90±0.77 0.79±0.27 治疗后 3.48±0.68a 1.10±0.22a 试验组 31 治疗前 3.93±0.79 0.76±0.28 治疗后 3.11±0.73ab 1.35±0.25ab
2.4 两组不良反应发生情况比较
两组不良反应发生率比较,差异无统计学意义(P>0.05)。见表5。
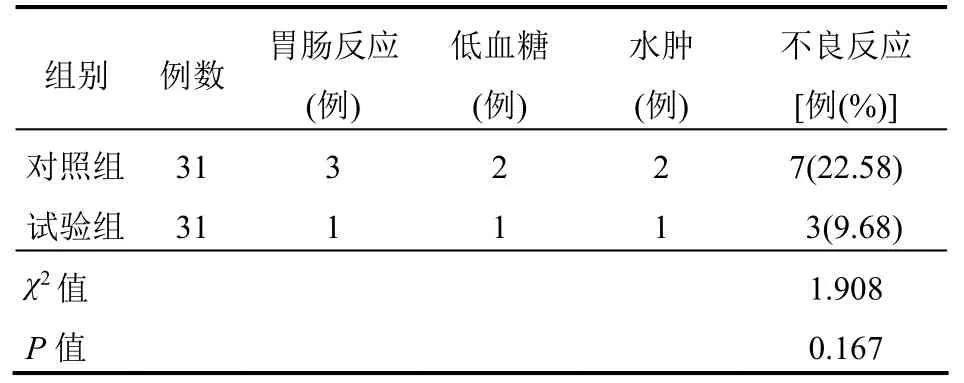
表5 两组患者不良反应发生情况比较
3 讨论
糖尿病是全球范围内常见疾病,已成为我国主要致死性疾病之一,且有低龄化趋势,其中大部分为T2DM,主要表现为“三多一少”且可伴随急慢性并发症,给患者及其家庭带来极大负担[4]。有研究指出,T2DM 病情进展主要与胰岛B 细胞功能逐渐丧失及胰岛素抵抗有关,故为获得更好治疗效果,应尽早减少胰岛B 细胞功能受损程度并减弱胰岛素抵抗现象[5-6]。目前,治疗T2DM 的口服药物以双胍类、胰岛素促分泌剂、α-葡萄糖苷酶抑制剂(AGI)、噻唑烷二酮类(TZDs)等为主,胰岛素促分泌剂主要通过促进胰岛素分泌而降低血糖,可增加胰岛负担,进一步损伤胰岛功能,最终只能依靠胰岛素制剂进行治疗[7];AGI 主要是降低餐后血糖,无法改善机体胰岛素抵抗现象;二甲双胍作为治疗T2DM 的一线药物,可增加机体胰岛素敏感性;而吡格列酮属于TZDs,是一种胰岛素增敏剂,亦可增加机体组织对胰岛素的敏感性。莫诗瑶[8]的研究显示,吡格列酮在改善胰岛B 细胞功能方面效果更佳,但相关报道较少,故为了进一步验证其报道准确度,故对此进行了相关研究。
试验组血糖水平的改善程度大于对照组,说明吡格列酮可辅助控制血糖水平,这与臧永军等[9]的研究结果一致。二甲双胍可通过抑制肝糖原输出而改善血糖水平,而吡格列酮则是通过兴奋过氧化物酶小体生长因子活化受体-γ(PPAR-γ),调节控制血糖及血脂的相关基因转录进而增加脂肪组织对葡萄糖的利用,间接减少肝糖输出及增加肌肉组织利用葡萄糖,间接降低血糖;上调胰岛细胞沉默调节蛋白 1(sirtuin type 1, SIRT1)表达,促进线粒体脱偶连蛋白 2(uncoupling protein 2, UCP2)表达,促使胰岛素正常分泌,两者联合应用效果更佳[10]。
试验组血脂水平改善程度优于对照组,可能是因吡格列酮与PPAR-γ受体结合,促进分解代谢基因激活蛋白分泌,下调肿瘤坏死因子-α(TNF-α)、瘦素等脂源性细胞因子水平,促使能量消耗增加,进而降低TC、TG、LDL-C 并升高HDL-C,改善胰岛素抵抗,同时因为血糖降低,血脂情况也会相应改善,两者相辅相成[11-12]。
试验组HOMA-IR、HOMA-B 改善程度优于对照组,说明吡格列酮可改善胰岛功能,增加胰岛素敏感性,这可能是因为吡格列酮兴奋包括PPAR-γ在内的各受体,导致胰岛素分泌增多并抑制胰岛素分解进而保护胰岛B 细胞,同时通过减弱脂肪细胞等对胰岛素的抵抗而避免胰岛B 细胞凋亡,最终使胰岛素分泌增加且胰岛素抵抗现象改善[13]。两组不良反应发生率比较差异无统计学意义,说明吡格列酮并不明显增加并发症发生率。由于本研究样本量较少,且不可避免地存在不同程度的主观及客观误差,无法保证试验结果的完全正确性。
综上所述,吡格列酮可辅助医治T2DM,增加患者胰岛B 细胞敏感性。

