绵羊BMPR1B 基因真核表达及产物互作蛋白的鉴定
贾建磊 陈倩 靳继鹏 袁赞 张利平
(1. 青海大学农牧学院,西宁 810016;2. 甘肃农业大学动物科学技术学院,兰州 730070)
卵泡发生是母羊卵巢功能的基础,包括受精过程中成熟卵母细胞的产生及维持母羊发情周期所需要的生殖激素的生成[1]。骨形态发生蛋白受体1B 基 因(Bone morphogenetic protein receptor 1B,BMPR1B)属于转化生长因子β 超家族,在许多组织和器官中通过调节细胞分化、增殖等生理过程对哺乳动物胚胎发育、胎儿出生后发育及激素释放等起重要作用[2]。绵羊BMPR1B基因第8 外显子(A746G)发生突变,突变体BB 个体卵巢部分功能丧失,使得此受体对配体GDF5和BMP4不敏感,从而高剂量的GDF5便抑制了孕胴的分泌,使排卵率增加,产仔数增加。近几年来,大量研究表明,BMPR1B基因是Booroola Merino 羊、剑桥羊以及我国小尾寒羊和湖羊的多胎主效基因[3-4]。
BMPR1B 蛋白是一种信号转导蛋白,在绵羊卵巢内广泛的表达(包括颗粒细胞、卵母细胞和卵泡膜细胞)[5]。BMPR1B具有同丝氨酸/苏氨酸蛋白激酶受体结构类似的信号传递机制,其主要功能是参与哺乳动物卵巢卵泡发育、动物的胚胎发育、骨组织形成、癌细胞的生长及大脑组织恢复等[8-10]。BMPR1B 蛋白包含3 部分:N 末端胞外配体结合域、单跨膜区域和C 末端丝氨酸/苏氨酸激酶结构域(GS)。BMPR1B基因编码区第746 位点A →G 的突变,使受体胞内激酶区第249 位氨基酸由谷氨酰胺变为精氨酸,突变后的BMPR1B 蛋白与配体结合时,BMPR-IIB 可将BMPR1B 蛋白的GS 结构域磷酸化,由于磷酸化的存在,增强了GS 结构域对于I 型受体信号传导。同时,GS 结构域中的磷酸化位点被II 型受体磷酸化,阻止I 型受体的磷酸化,导致下游级联的激活并使部分受体失活。进而使配体GDF5 和BMP4 对类固醇生成的抑制作用减弱,改变SMADs的表达和磷酸化的状态,促进FSH 诱导雌激素的合成,抑制孕酮的合成与分泌,结果使携带BB 突变体的母羊颗粒细胞加快分化,促使卵泡成熟速度加速,引起突变型母羊排卵数增加,被称为FecB突变[11]。据报道,BMPR1B基因是绵羊高繁殖力的主效基因和控制绵羊繁殖性能遗传的重要候选基因[8]。
随着后基因组学时代的到来,蛋白质组学、转录组学、代谢组学、生物信息学等方面的研究在功能基因和分子生物学上展现出前所未有的优势。目前为止,BMPR1B基因研究的主要集中在运用分子遗传学和DNA 分子遗传标记(MAS)技术探索其多态性与绵羊产羔数关联性,蛋白质为生物功能的执行者,为了探究BMPR1B及其相互作用蛋白的假定生物学功能,预测BMPR1B及其相互作用蛋白的作用通路,揭示了BMPR1B及其互作蛋白和绵羊产羔数的生物学功能联系。本研究通过构建BMPR1B基因真核表达体系并表征BMPR1B 蛋白质,通过生物信息学分析并预测BMPR1B 蛋白及其相互作用蛋白在绵羊卵巢卵母细胞发育及排卵的作用通路。从蛋白质角度进行BMPR1B对绵羊产羔性状作用通路进行研究,旨为进一步研究了BMPR1B作为绵羊产羔性状主要基因的生物学功能和特异性诊断试剂的开发奠定技术基础。
1 材料与方法
1.1 材料
试验所有程序均按照青海大学动物福利及动物伦理指南进行。2018 年3-5 月购自青海省海东市乐都金元牧业有限公司6 只成年健康经产且有产羔记录的小尾寒羊经颈动脉放血屠宰后采集卵巢,剥离卵巢表面韧带及脂肪后,无菌水冲洗立即置于液氮中带回实验室,-80℃保存。
1.2 方法
1.2.1BMPR1B基因的PCR 扩增及克隆 根据GenBank 上提交的BMPR1B全基因mRNA 的碱基序列(登录号:NM_001009431.1),运用Primer Prim 5.0设计BMPR1B基因编码区PCR 引物。F:5′-CCGCT CGAGAACATGCTTTTGCGAAGTTCAG-3′,R:5′-CGC GGATCCCAGAGCTTAATGTCCGGGACT-3′,扩增片段大小:1 509 bp,划线部分为酶切位点(上游为XhoI,下游为BamH I)。
卵巢总RNA 提取后反转录为cDNA,并进行PCR 扩增(扩增条件:94℃变性4 min;94℃ 40 s,60℃ 40 s,72℃ 110 s,35 个 循 环;72℃ 10 min)。PCR 产物用1%的琼脂糖凝胶电泳检测后使用凝胶回收试剂盒将目的条带进行凝胶回收。使用T4 DNA连接酶将纯化的PCR 产物连接到pMD19-T 中,4℃过夜。使用热休克方式在42℃将连接混合物转化到大肠杆菌DH5α 细胞中90 s,然后冰上孵育。将转化产物在含有50 mg/mL 氨苄青霉素的LB 琼脂上过夜培养。挑取白色斑点,转移至含有氨苄青霉素的LB 肉汤培养基中37℃过夜培养,进行菌液PCR,选择阳性克隆,送上海生工生物工程公司测序。使用酚-氯仿将转化产物pMD19-T-BMPR1B进行纯化,将提取的pcDNA3.1a 真核表达质粒载体和构建的pMD19-T-BMPR1B克隆载体用限制性内切酶BamH I 和XhoI 分别进行双酶切(双酶切体系:pcDNA3.1a 10 μL,pMD19-T-BMPR1B10 μL,BamH I 0.5 μL,XhoI 0.5 μL,10×K Buffer 2 μL,加无菌水至20 μL。37℃酶切4 h),2%的琼脂糖凝胶电泳检测酶切产物,凝胶回收空载体和目的基因片段。用T4 连接酶连接目的基因片段和空载体(连接体系:T4 DNA 连接酶 1 μL,空载体1 μL,目的基因片段10 μL,连接Buffer 2.5 μL,加无菌水至25 μL,16℃过夜连接)。将25 μL 连接产物加入100 μL 感受态大肠杆菌中,冰浴30 min;42℃热激45 s,再冰浴1 min;加入1 mL LB 培养基,37℃,170 r/min,摇床培养1 h,离心后取200 μL 菌液置于含有氨苄青霉素的LB 肉汤培养基中培养,过夜培养,挑取白色斑点,菌液PCR 检测阳性克隆,送生工生物工程公司(上海)进行测序。
1.2.2 重组靶基因的真核表达 使用Sf 9 细胞进行BMPR1B基因的蛋白质体外表达。将10 mL Sf9 昆虫细胞培养于含有10%胎牛血清的Grace’s 培养基中;取8×105个细胞加入六孔板中,室温静置20 min,使细胞贴壁;将20 μL 质粒DNA(20 μg)稀释于200 μL 胎牛血清Grace′s 培养基中,同时将100 μL 细胞转染试剂(QIAGEN)稀释于1 mL 胎牛血清Grace′s 培养基中,然后将稀释的质粒DNA 滴加到稀释的细胞转染试剂中并轻轻混合以避免沉淀,在室温下放置20 min 后将混合液加入到Sf 9 细胞中,并在28℃下在水平振荡器上以150 r/min 温育直至细胞“病变”(CPE)超过80%(达到最大靶蛋白表达,72 h-96 h),分别收集上清液和沉淀物,分离并纯化重组蛋白的纯化。
1.2.3 单克隆抗体的制备 抗BMPR1B单克隆抗体的制备由美国GenScript 公司完成。用体外表达的BMPR1B 蛋白免疫6 只Bal b/c 小鼠,每次免疫7 d,加强免疫后用间接ELISA 方法检测免血清效价,当效价大于1∶64 000,采用电融合方法进行细胞融合后筛选针对靶蛋白呈阳性融合细胞的上清液,将阳性母克隆细胞扩大培养,进行亚克隆筛选后进行BMPR1B单克隆抗体的制备,采用Protein A/G 亲和层析方法纯化。
1.2.4 母羊卵巢BMPR1B相互作用蛋白的鉴定 分别使用试剂盒免疫沉淀法和常规免疫沉淀法进行母羊卵巢BMPR1B相互作用蛋白的鉴定,每种方法进行3 次重复。单独表达空载体的Sf9 细胞用作阴性对照。对于试剂盒免疫沉淀法,按照说明是使用Mag sProtein A/G Co-Immunoprecipitation 试 剂 盒(BioCanal)富集母羊卵巢中的BMPR1B及其相互作用蛋白。对于常规免疫沉淀法,在4℃条件下,用500 μL 的0.5% NP40 裂解缓冲液裂解母羊卵巢30 min。将沉淀物在PBS 中洗涤2 次后4℃下用500 μL的1% NP40 裂解缓冲液裂解,并在水浴超声波仪中2 级超声处理4 个循环。将3 mg 总蛋白用于50 μg IgA 进行免疫沉淀。
1.2.5 蛋白质鉴定和生物信息学分析 MALDI-TOF/TOF 结合Mascot 数据库检索鉴定目的蛋白。实验组和对照组以上调和下调3.0 倍来鉴定差异蛋白质(P<0.05)。使用Uniprot 数据库结合BLAST2GO 软件进行差异蛋白质的功能注释和分类;使用KAAS平台进行通路分析(http:// www.genome.jp/kegg/mapper.html),同时通过Fisher 精确检验进行通路富集统计(P<0.05);使用Cytoscape 3.0 软件用于蛋白质-蛋白质相互作用网络分析。
2 结果
2.1 绵羊总RNA提取及PCR扩增
提取的小尾寒羊卵巢总RNA 结果见图1,提取的小尾寒羊卵巢总RNA 明显可见28S 与18S 两条带,提取效果较好,可直接用于反转录。反转录PCR 扩增BMPR1B基因编码区序列,结果见图2,扩增片段与目的片段大小一致(1 509 bp)且特异性良好,可直接进行下一步实验。
2.2 重组BMPR1B基因的真核表达
通过XhoI 和BamH I 限制酶消化DNA 质粒后结果表明,用XhoI 和BamH I 限制酶切割质粒pcDNA3.1a-BMPR1B发现两条带,在琼脂糖凝胶电泳上产生预期的DNA 片段(1 509 bp),而pMD19-T-NP 仅有一条带(未发现预期的DNA 片段)。证实BMPR1B基因成功连接到真核表达质粒pcDNA3.1a中,插入的DNA 的大小与PCR 产物相同(图3)。
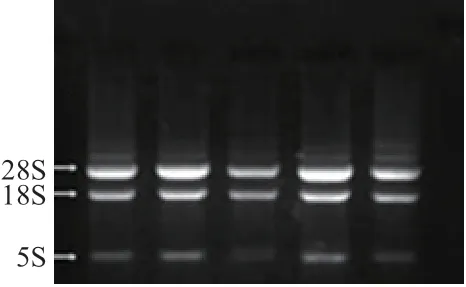
图1 绵羊卵巢总RNA 提取
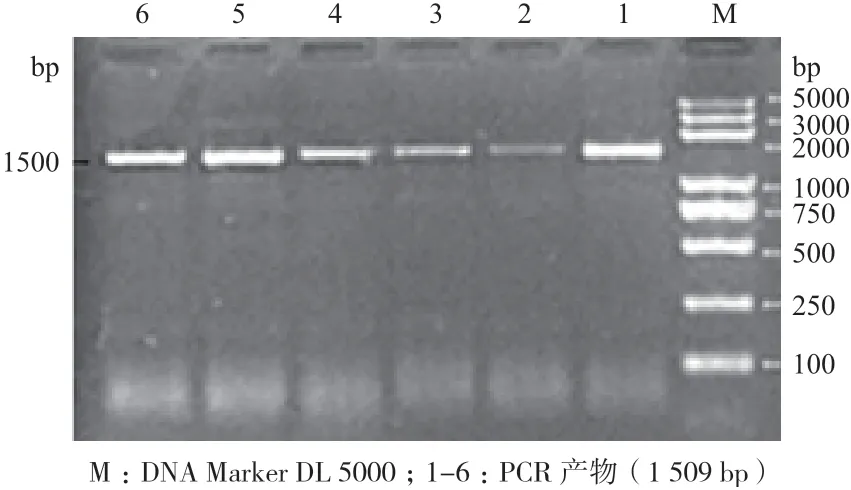
图2 绵羊BMPR-1B 基因PCR 结果
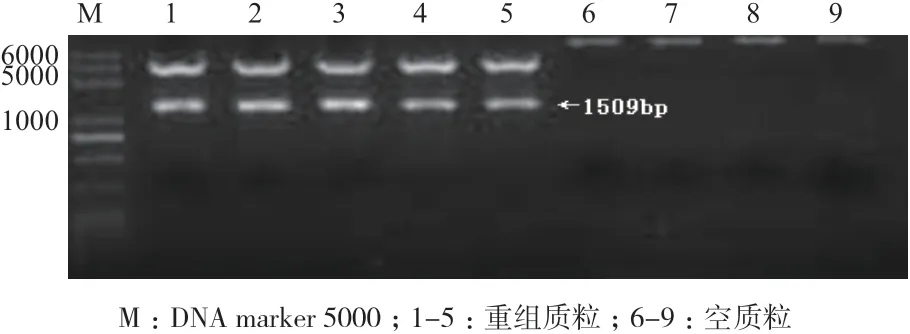
图3 用Xho I 和BamH I 酶消化的DNA 质粒琼脂糖电泳检测
2.3 抗BMPR1B单克隆抗体的产生
将重组真核质粒pcDNA3.1a-BMPR1B转染于Sf 9 昆虫细胞,28℃培养,经过3 次传代后,细胞出现明显的细胞病变效应(“CPE”),转染pcDNA3.1a-BMPR1B重组质粒24 h 后,结果显示pcDNA3.1a-BMPR1B转染组“CPE”荧光强度明显高于对照组(图4)。连续监测7 d后,表明转染后72 h-96 h之间“CPE”表达最高。
如图5 所示,重组蛋白条带主要出现在沉淀中,使用Ni-NTA Superflow 蛋白纯化试剂盒纯化重组蛋白(图6,图7)。当OD450nm的阳性/阴性(P/N)大于或等于2.1 时,判断血清抗体滴度。ELISA 结果显示通过4 次免疫获得高滴度(1∶32 000)的大鼠抗BMPR1B血清。
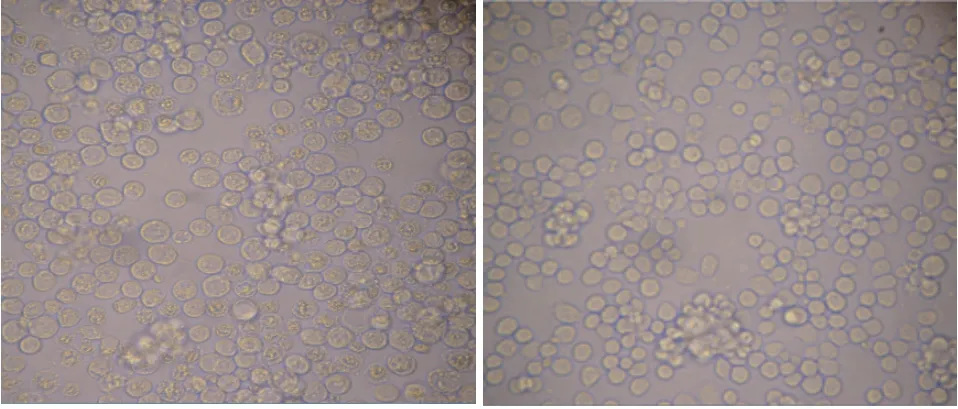
图4 转染重组质粒后的Sf 9 细胞(100×,左)和未转染重组质粒的Sf 9 细胞(100×,右)
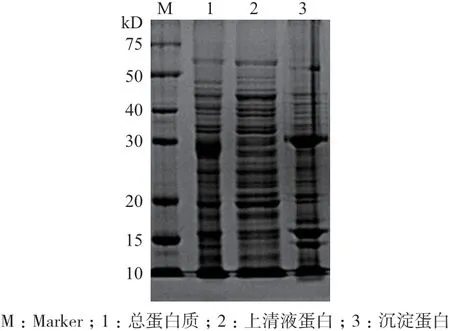
图5 体外表达蛋白的检测
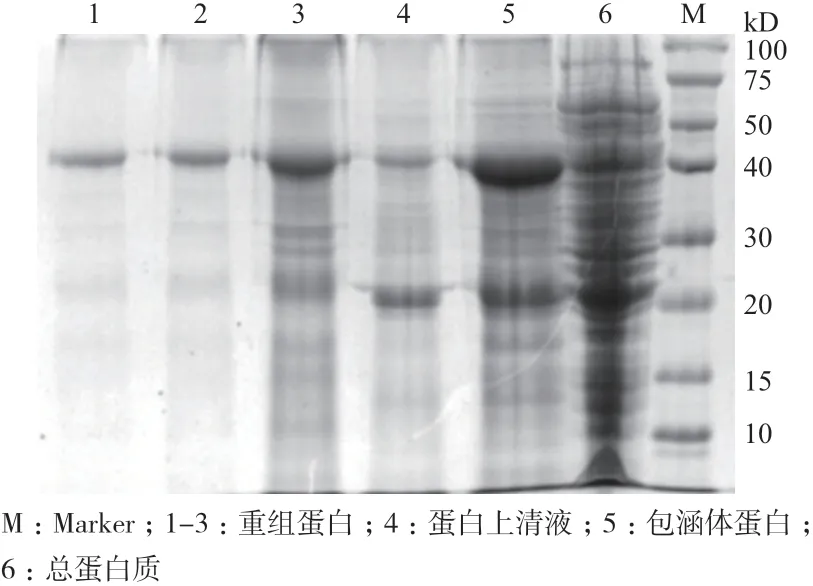
图6 重组蛋白的纯化
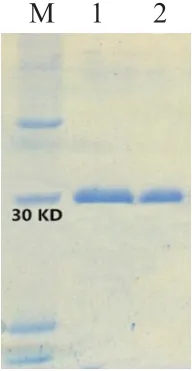
图7 BMPR1B 抗体Western Blotting 检测
2.4 绵羊卵巢BMPR1B相互作用蛋白的鉴定
绵羊卵巢BMPR1B相互作用蛋白结果表明,BMPR1B抗体可以有效地和特异性地从母羊卵巢提取物中沉淀相互作用蛋白。使用SDS-PAGE 电泳分离沉淀蛋白质(图8),结果表明,载有BMPR1B-IP(样品1-6)存在目标蛋白条带,空载体IP 不存在的目标蛋白条带(样品7 和8)。
常规方法和试剂盒法免疫共沉淀后目的条带进行胶内酶解,并通过MALDI-TOF/TOF 质谱进行鉴定,与Uniprot 数据库中Ovis aries 或Bos taurus 物种数据进行匹配,使用手动阈值法和概率预测算法来计算63 种差异蛋白质中与BMPR1B蛋白的关联性,表明共产生34 种目的差异蛋白,其中24 种差异蛋白在实验组(BMPR1B抗体CoIP)和对照组(空白抗体CoIP)中表达量差异3 倍或3 倍以上(表1)。
2.5 BMPR1B互作蛋白的验证
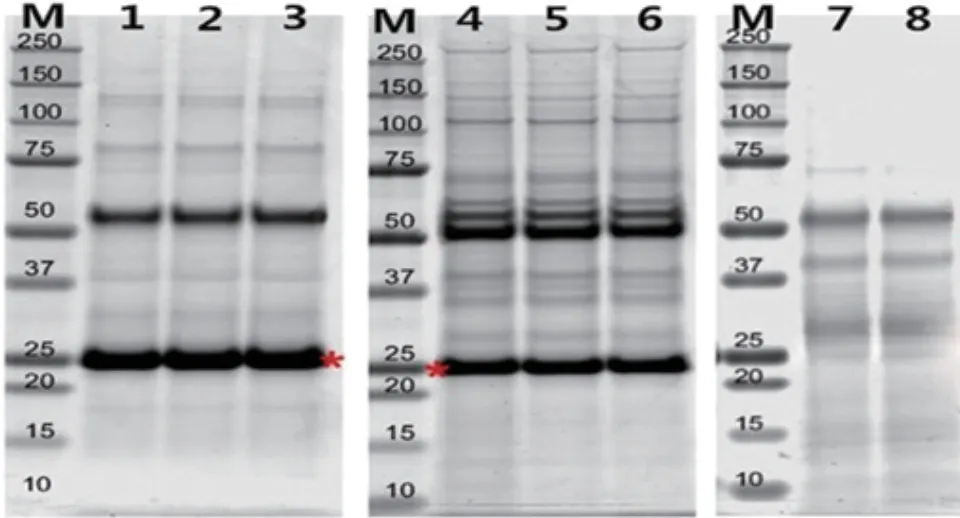
图8 BMPR1B 相互作用蛋白的鉴定
采用CoIP 试剂盒方法进行BMPR-1B 蛋白及相互作用蛋白免疫共沉淀,直接作用产物经洗脱纯化后用SDS-PAGE 凝胶电泳进行分离(图9),共分离6 个条带,经生物质谱鉴定与BMPR-IB 相互作用蛋白,共获5 种蛋白,分别为GDF5、BMP2、BMP4、RhoD 和HSP10。采用免疫印迹法(Western Blotting)验证BMPR-1B 蛋白与母羊卵巢提取物免疫共沉淀的复合蛋白(BMP2、BMP4、GDF5、GDF9、RhoD 和HSP10)的特异性相互作用(阳性和阴性验证,图10),表明所选候选蛋白与BMPR-1B 具有特异性相互作用。
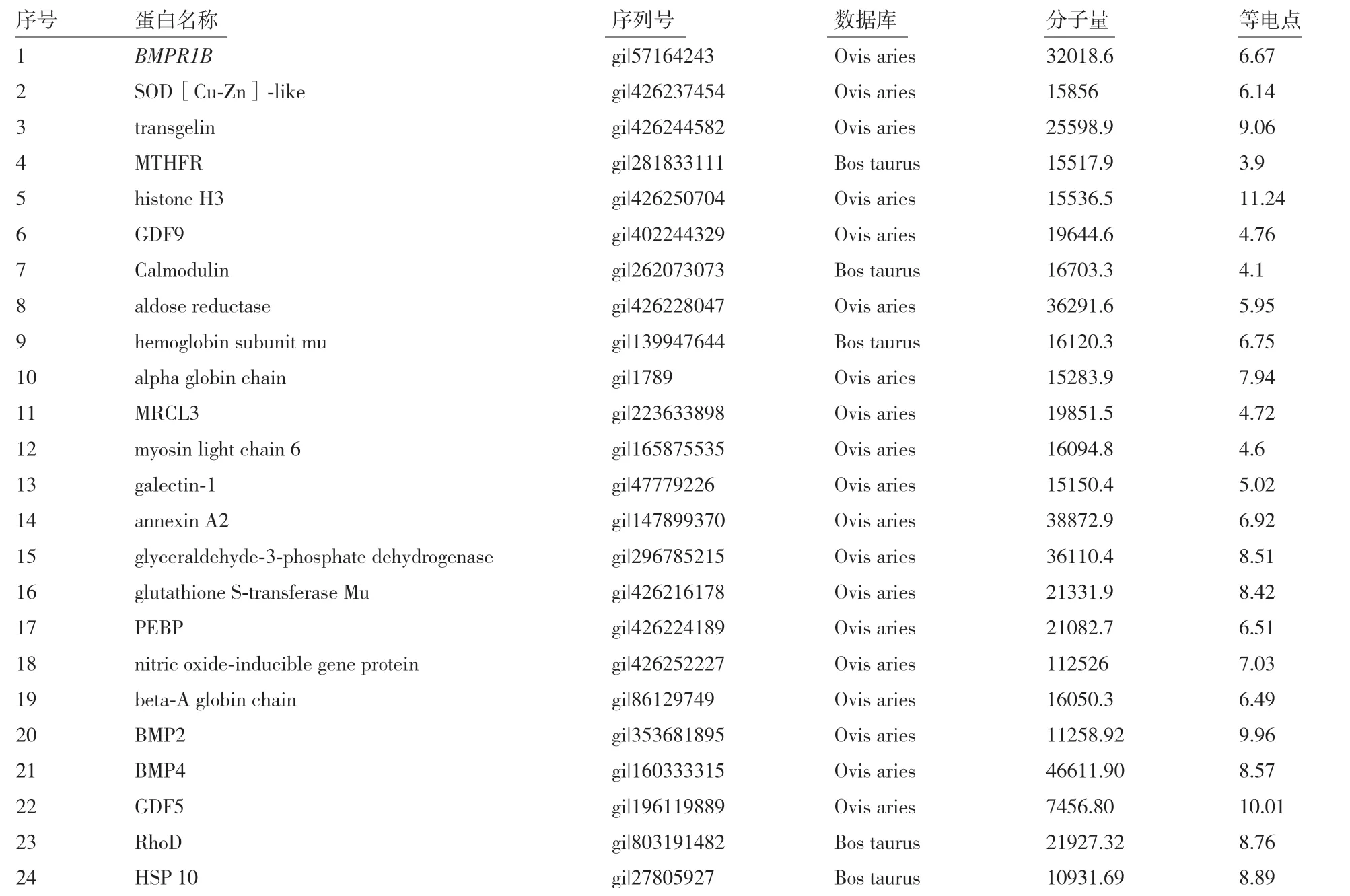
表1 CoIP-MS 鉴定BMPR1B 相互作用蛋白表
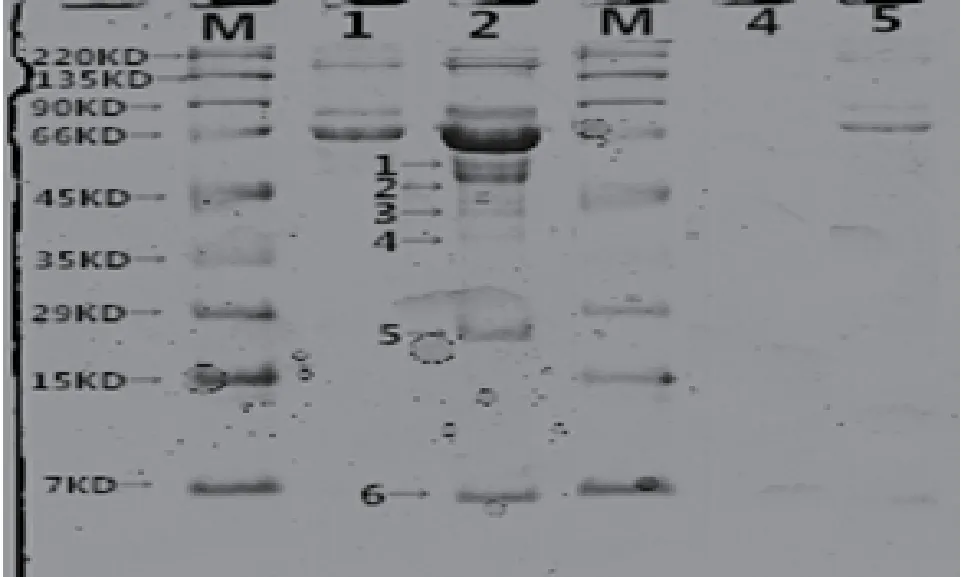
图9 BMPR1B 相互作用蛋白SDS-PAGE 电泳鉴定

图10 BMPR1B 相互作用蛋白正反向Western Blotting验证
2.6 GO及KEGG分析
为预测和鉴定与BMPR1B相互作用蛋白相关的生物学过程,我们通过基因本体论(Gene ontology,GO)方法对目的蛋白过程进行富集分析(图11)。分析结果表明差异蛋白主要参与的“生物过程”包括繁殖和细胞质翻译过程,其中繁殖过程包含两个方向:(1)与信号转导相关:如“TGF-β 信号通路”和“细胞因子-细胞因子受体相互作用”;(2)与发育相关:如“生物调节”,“细胞过程”,“生长”和“代谢过程”。细胞质翻译过程主要包括“下游处理”和“信号转导”。另外富集分析结果还包括与试验主题关联性较小的生物过程,如“色素沉积”和“免疫系统过程”。
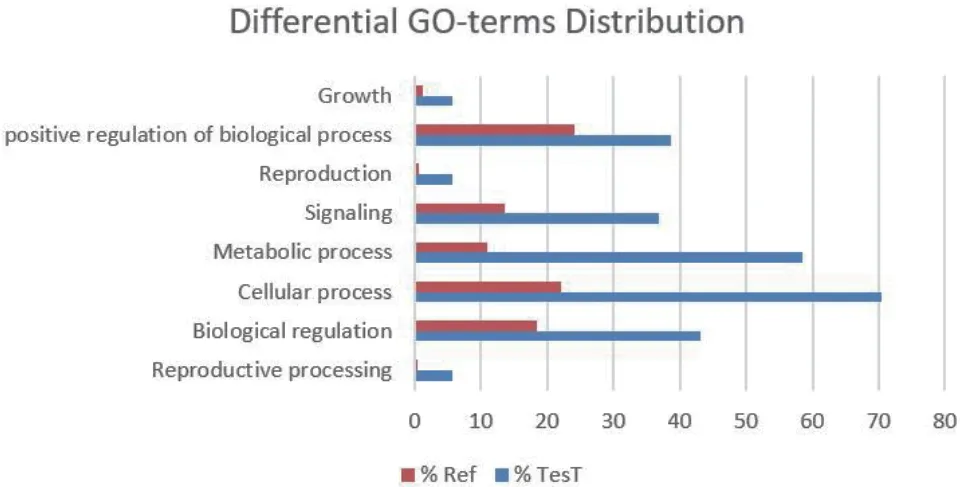
图12 BMPR1B 及其互作蛋白GO 条目富集分析
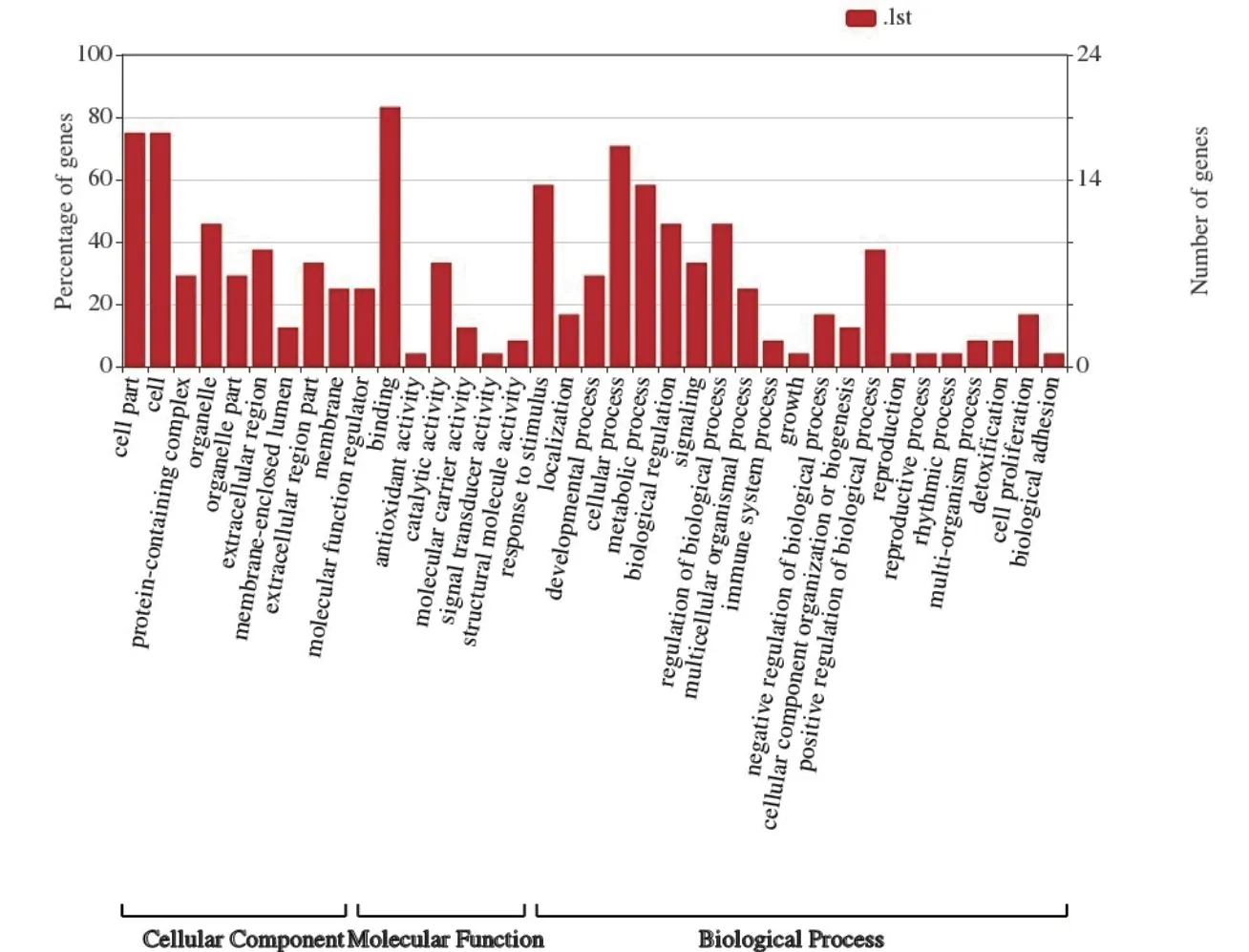
图11 BMPR1B 及其互作蛋白GO 分析
为进一步深入探讨GO 分析所确定的生物过程,根据质谱检测结果通过Fisher 精确检验获取显著富集条目(P<0.05),并将这些条目进行统计分析得到与绵羊繁殖性状显著相关联的生物过程(图12)。结果表明,BMPR1B及其互作蛋白主要在“正向生物调节”,“信号转导”,“细胞过程”和“生殖过程”过程呈现富集状态,其中“信号转导”和“生殖过程”过程的鉴定主要是因为BMPR1B相互作用蛋白质中存在TGF-β 家族蛋白质,如BMPs 等,“正向生物调节”和“细胞过程”过程的鉴定主要是因为BMPR1B相互作用蛋白质中存在起始和延伸因子,如BMP2 和BMP4。
使用KAAS 平台鉴定与BMPR1B相互作用蛋白相关KEGG 途径。结果表明,共鉴定到103 条代谢通路,运用Fisher 精确检验获取28 条显著富集通路(P<0.05),按评分和重叠百分比排名的前6 个途径分别为:“TGF-β 信号转导通路”,“卵巢类固醇生成通路”,“MAPK 信号转导通路”,“细胞因子-细胞因子受体相互作用”,“Hippo 信号转导通路”和 “信号通路调节干细胞的多能性”(图13-14)。KEGG 结果与GO 分析结果一致,进一步验证BMPR1B相互作用蛋白所涉及的各种生物学功能。
2.7 蛋白质-蛋白质相互作用通路预测分析
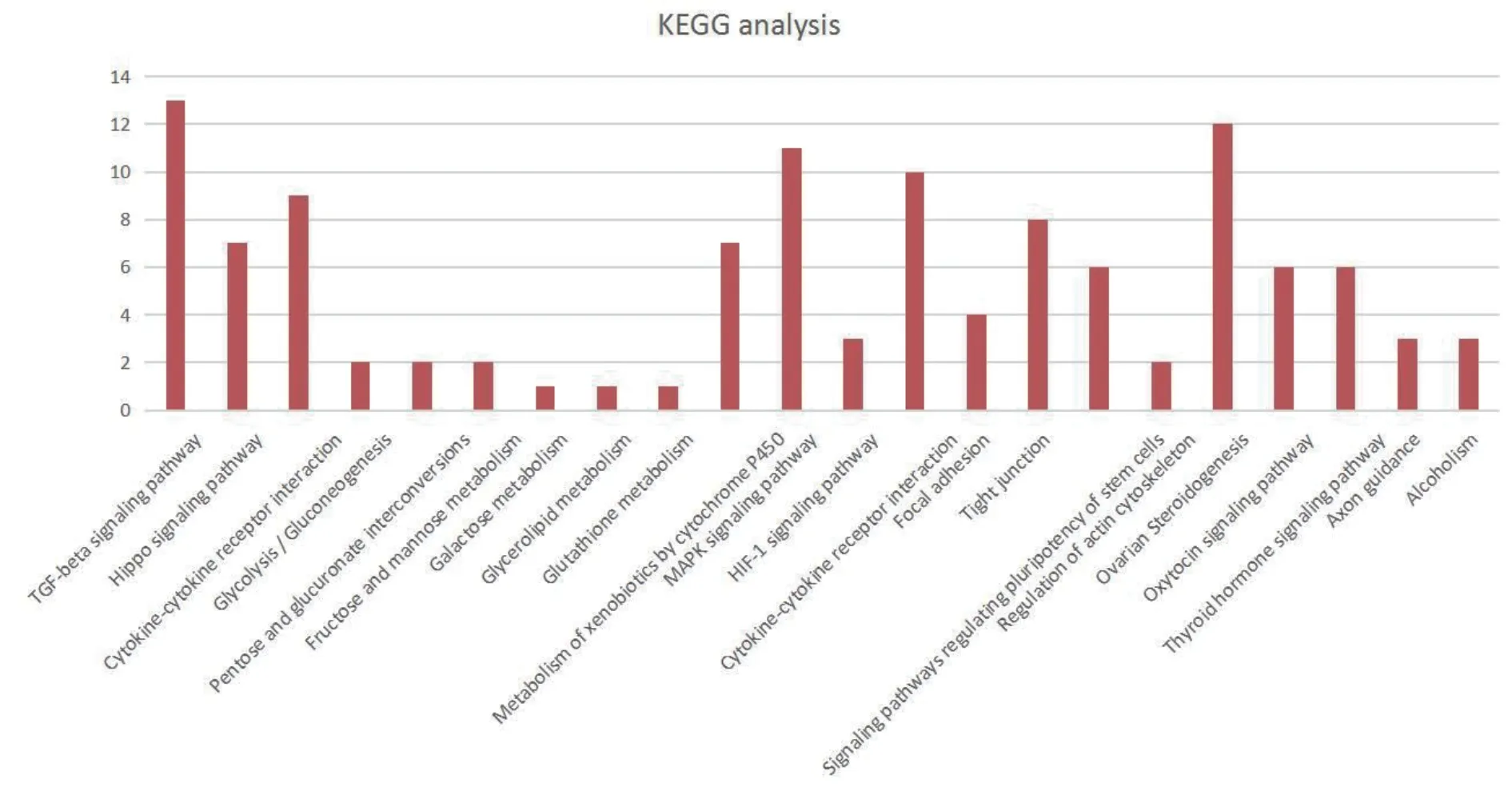
图13 BMPR1B 及其互作蛋白KEGG 分析
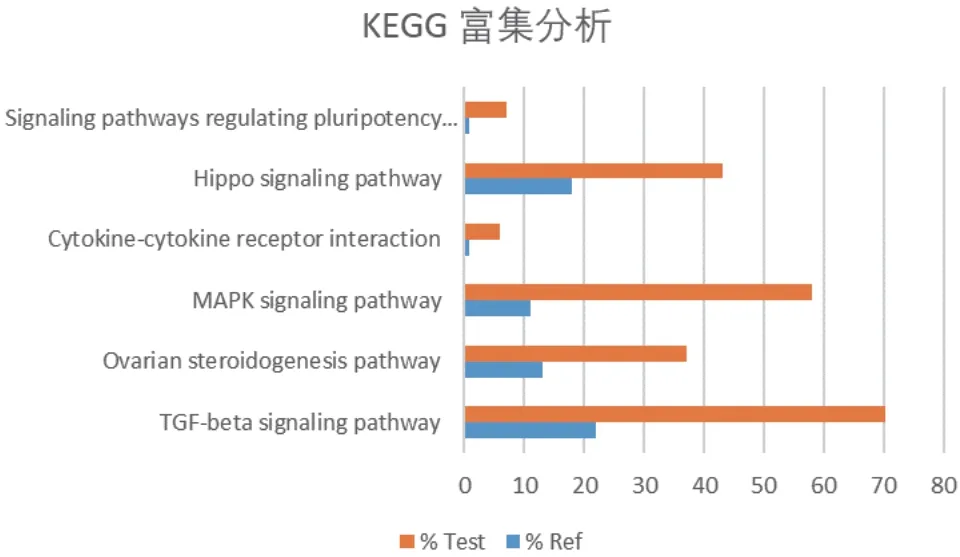
图14 BMPR1B 及其互作蛋白KEGG 富集分析
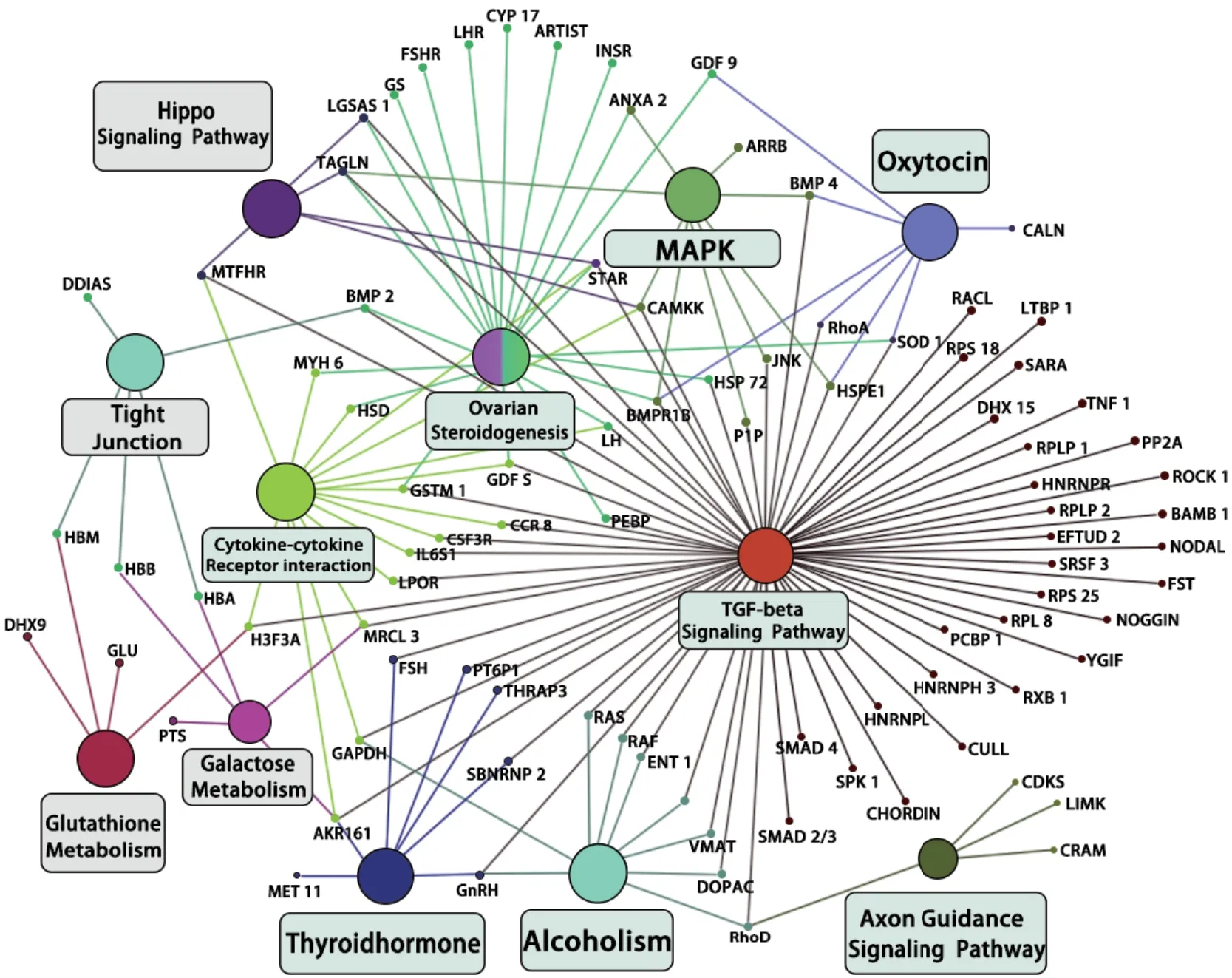
图15 蛋白质-蛋白质相互作用网络图
以试验筛选的24 种目的蛋白为基础,结合UniProt 数据库和KEGG 图谱,利用可视化软件Cytoscape 软件构建出蛋白质-蛋白质互作网(图15)。结果表明,TGF-β 信号通路、卵巢类固醇生成通路和MAPK 信号通路构成了一个复杂且紧密的交互网络,同时许多其他的信号通路也基于此交互网络与其他通路之间相互作用。基于互作结果,我们设计了BMPR1B调节绵羊卵母细胞的发育和排卵的代谢途径途径(图16),在该预测途径中最具交互作用的蛋白质与信号转导相关的,表明其在绵羊卵母细胞发育和排卵中具有重要作用。
3 讨论
绵羊卵巢卵母细胞的成熟和排卵主要是受促性腺激素的调节,即卵泡刺激素(FSH)和促黄体激素(LH),促性腺激素激素(FSH 和LH)的释放最初是由卵巢内各种因素的控制[7]。研究表明,BMPR1B基因在绵羊卵巢中广泛表达,包括颗粒细胞,卵母细胞,卵泡和黄体[12]。蛋白质在核糖体内合成后被转运到特定的细胞器中参与细胞的各种生命活动,有效地发挥功能[13]。BMPR1B蛋白作为一种跨膜蛋白,介导细胞与外界之间的信号传导,参与许多细胞功能(如构成各种信号分子、激素和其他底物的受体)和细胞膜内外物质交换、能量和信号的传递等[14]。本研究使用CoIP-MS 技术来鉴定BMPR1B 蛋白及其互作蛋白并深入了解其与母羊卵巢中相互作用蛋白的调节通路。与文献报道相同,Samds 是在绵羊产羔性状代谢通路中最突出的蛋白质家族。研究表明GDF5 和BMP4 是BMPR1B的天然配体,直接影响绵羊颗粒细胞分泌孕酮[15];BMP2 作用于卵巢、子宫,通过抑制cAMP 的释放以及孕酮、雌二醇和雄烯二酮激素的合成调节生殖内分泌系统,影响动物的繁殖性状[16];RhoD 蛋白在机体内参与MAPK 信号通路,通过各种生物和理化刺激被激活后参与细胞分化、细胞因子的产生和细胞凋亡等多种细胞生理过程[17];HSP10 通过直接或间接的方式参与细胞增殖凋亡、炎性免疫反应、生殖等过程[18]。
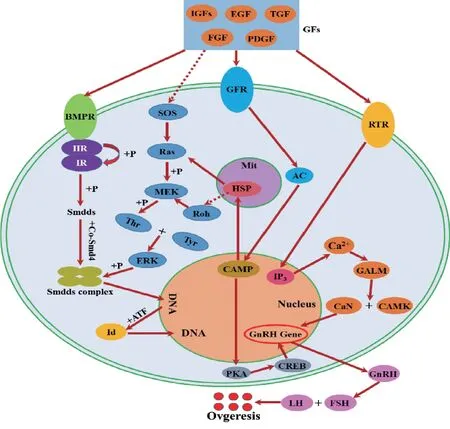
图16 绵羊卵母细胞发育和排卵过程预测通路图[24,27,32]
BMPs 参与多种细胞活动,如增殖,分化,迁移和凋亡[19]。卵母细胞的减数分裂成熟需要将未成熟的卵母细胞转化为完全成长的卵母细胞,这种卵母细胞存在于卵巢前卵泡中,进行受精准备,这一过程受垂体促性腺激素与各种自分泌和旁分泌的BMP家族的基因相互作用调节[20]。BMP 信号通路是调控胚胎和细胞发育的重要信号通路之一,与其他信号途径之间交互广泛:如MAPK 信号转导通路、细胞因子-细胞因子受体相互作用、TGF-β 信号转导通路、Hippo 信号转导通路 及Canonical Wnt/β-catenin通路等,同时BMP 信号通路还会对microRNA 基因表观遗传学、钙离子跨膜转运、卵母细胞减数分裂等有一定的调控[21-23]。
通过生物信息学分析结果和文献报道,我们推断目的蛋白主要通过细胞内信号转导途径(Smads蛋白途径、p38-MAPK 途径)和细胞外信号转导途径(Erk-MAP 激酶途径)对绵羊产羔性状进行调控:(1)Smads 蛋白途径[24-26]:原始卵泡的发育启动不依赖于垂体促性腺激素,而受卵巢中自分泌/或旁分泌因子(细胞因子)的调控,BMPR1B 蛋白的183-205 个氨基酸之间存在跨膜区,为苏氨酸-丝氨酸激酶受体,当卵巢中的自分泌/或旁分泌因子(如胰岛素样生长因子IGFs)与此受体结合后细胞内BMP 家族Ⅱ型受体通过磷酸化Ⅰ型受体的GS 区域,使胞质内一系列Smads 蛋白磷酸化,被激活的Smads 结合共用型的Co-Smad4 共同形成Smads 蛋白复合物,然后转入细胞核内,促进DNA 的合成,进而通过募集转录辅激活因子或其它因子与BMP4和GDF5下游靶基因的启动子相结合,调节下游靶基因的转录,进而调控卵泡的发生。Smads 蛋白家族目前已证实有8 种不同的Smads 蛋白,Smad6 和Smad7 由BMP-2 蛋白激活。(2) p38-MAPK 途径[27-30]:p38-MAPK 是MAPK 家族重要的丝氨酸/酪氨酸激酶,可磷酸化丝氨酸/酪氨酸残基,在炎症、细胞应激、凋亡、细胞周期和生长等多种生理过程中起重要作用。在动物的繁殖中,p38-MAPK 途径磷酸化HSP 10,同时在LH 作用下,使卵泡细胞以及卵泡与卵母细胞间的缝隙连接中断,导致卵母细胞中cAMP 水平下降,同时钙离子结合钙调蛋白通过p38-MAPK 调控途径来将GnRH 传递信号作用到下游蛋白酪氨酸激酶受体结合位点,实现对动物繁殖性状的调控。Ling 等[26]通过构建小鼠HSP10基因siRNA 和超表达重组腺病毒载体及体外培养小鼠卵巢颗粒细胞发现,HSP10 参与卵巢颗粒细胞凋亡的调节,进而可能影响卵泡及卵母细胞的发育成熟。研究发现,HSP 10 在PCOS 患者间质细胞中表达量降低,从而降低其抗凋亡作用,抑制卵泡的发育成熟,而在卵泡膜细胞中表达量升高,从而激活IGF-1通路,引起高雄激素血症,抑制卵泡的发育成熟[31]。(3)Erk-MAP 激酶途径[32]:由细胞外刺激因子(如生长分化因子、细胞因子、Rho 家族)作用,活化MEK,使其Tyr 和Thr 残基磷酸化,从而激活ErK途径,磷酸化下游底物。Rho 蛋白家族作为Erk-MAP 激酶途径的关键分子,在胞内信号转导中发挥桥梁作用,RhoD 蛋白在机体内参与MAPK 信号通路,通过各种生物和理化刺激被激活后参与细胞分化、细胞因子的产生和细胞凋亡等多种细胞生理过程[33],当RhoD 高表达时,可以快速激活MAPK 通路,升高底物c-fos 和c-jun 的磷酸化水平,与此同时,BMP 的下游传导介质Smad1 和Smad5 也出现表达增加,从而诱导卵母细胞的分化,调控卵泡的发生[34]。
4 结论
BMPR1B 蛋白与绵羊产羔性状途径中Smads 家族蛋白具有交互作用,在绵羊卵母细胞发育和排卵中具有重要作用。本试验通过构建BMPR1B基因真核表达体系并产生单克隆抗体,利用CoIP-MS 技术鉴定母羊卵巢提取物中与BMPR1B特异性相互作用的蛋白质,构建目的蛋白质互作网络,通过生物信息学分析并预测BMPR1B 蛋白及其相互作用蛋白在绵羊卵巢卵母细胞发育及排卵的作用通路。母羊卵巢提取物中23 种蛋白质与BMPR1B 蛋白具有关联性,其中6 种目的蛋白(BMP2、BMP4、GDF5、GDF9、RhoD 和HSP10) 与BMPR1B具 有特异性相互作用,通过生物信息学分析表明目的蛋白在TGF-β 信号转导通路、卵巢类固醇生成通路和MAPK 信号转导通路构成复杂且紧密的交互网络,基于互作结果设计BMPR1B 蛋白调节绵羊卵母细胞的发育和排卵的代谢途径。BMPR1B 蛋白与绵羊产羔性状途径中Smads 家族蛋白具有交互作用,在绵羊卵母细胞发育和排卵中具有重要作用。进一步研究BMPR1B基因的生物学功能和研究BMPR1B基因作为绵羊高繁主效基因的机理和分子调控机制奠定了基础。

