不同放射治疗分割方式对脑转移瘤患者放疗后的影响
徐雄健,程祖胜,王 亮,冯江峰,张群峰
(1.浙江省绍兴市第七人民医院放射科 312000;2.绍兴文理学院附属医院放射科,绍兴 312000;3.浙江省绍兴市人民医院放射科 312000;4.浙江省湖州市吴兴区中西医结合医院放射科 313000)
脑转移瘤是一种常见的颅内肿瘤,多数是由肺癌、乳腺癌、黑色素瘤等原发性恶性肿瘤转移而来,临床上表现为头痛头晕、呕吐等颅内高压症状,部分可表现为癫痫发作等精神障碍,经过治疗后,大多数存在预后不良的现象,导致脑转移瘤的病死率居高不下[1]。近年来,随着治疗技术的不断发展,大大提高了脑转移瘤患者的生存期。局部治疗主要是以全脑放射治疗为主,立体定向放射外科可对肿瘤周围脑组织保护相对较好,可延长患者的中位生存时间,但多数患者会出现不同程度的脑损伤,影响正常的放疗计划,且由于患者不耐受,造成放疗被迫中断的现象越来越普遍,直接影响了患者的放疗效果及生存时间。有学者认为小剂量的放射剂量能够减少放射造成的脑损伤,且对患者的影响较小,易坚持[2-4]。因此,本文通过对脑转移瘤患者实施不同放射治疗分割方式,探讨其临床疗效及精神障碍发生情况,以期为脑转移瘤患者的治疗提供一种较为有效的方式。
1 资料与方法
1.1 一般资料 选择2015年7月至2017年1月某院脑转移瘤患者60例为研究对象,所有患者均符合如下标准:(1)所有患者均经影像学证实为脑转移瘤,原发性恶性肿瘤均为肺癌;(2)病灶呈多发性(>3个),瘤体直径小于4 cm;(3)预计生存期大于3个月;(4)无精神障碍病史;(5)未合并其他高血压、糖尿病及脑血管疾病等全身性疾病;(6)患者及家属自愿参与本次研究,并签署知情同意书。本次研究经医院伦理委员会批准后实施。
60例脑转移瘤患者按照随机数字表法分为甲组和乙组,每组30例。两组基本临床资料比较,差异无统计学意义(P>0.05)。见表1。

表1 两组患者的临床资料比较
1.2 方法 患者入院后,行颅脑CT或MRI检查,CT扫描显示脑内多发异常密度影,边界多较为清晰,大病灶者可有低密度坏死区或高密度出血灶,周围有较严重水肿,增强后实体部分明显强化。MRI检查在T1加权上多呈低信号,T2加权上多呈高信号。增强后的形态变化与CT增强所见大致相仿。定位肿瘤部位,勾画靶区,GTV(CT或MRI检查T1增强上显示的可见肿瘤)、CTV(全脑)、PTV(CTV+0.5 cm)。海马的勾画:在MRI的T1加权轴位序列上勾画海马,主要勾画颞角内侧的T1低信号区,自侧脑室颞角的新月形成部作为尾侧勾画的起始部位,在脑脊液低信号内侧勾画低密度灰质,海马在侧脑室颞角存在时一直位于其内侧,在可以见到侧脑室的层面,把它作为内侧标志,当T1低信号的结构不在靠近侧脑室边缘时,海马的勾画结束。脑干的勾画,需在CT或MRI上显示的脑干结构,上界:丘脑下,下界:枕骨大孔。视神经勾画:CT或MRI上显示的视神经结构;视交叉的勾画:CT或MRI显示的视交叉结构。
注意事项:勾画GTV时,建议CT和MRI融合勾画,在全脑放疗时建议勾画双侧海马并外扩5 mm给予保护,记录瘤体最长直径。海马剂量分布为:海马Dmax为1 698.9 Gy,海马Dmean为1 183.8 Gy。
甲组采用常规剂量分割方式,具体如下:(1)全脑放疗。每次照射剂量(DT)为3 Gy,每周5次,连续2周,DT总量为30 Gy;(2)局部推量。每次2 Gy,5次/周,连续1周,总量为10 Gy。
乙组采用低剂量分割方式,具体如下:(1)全脑放疗。每次DT为2 Gy,每周5次,连续4周,DT总量为40 Gy;(2)局部推量。每次2 Gy,5次/周,连续1周,总量为10 Gy。
1.3 观察指标 观察两组患者的治疗后1个月时的卡氏(KPS)评分、临床疗效,放疗后不良反应、精神障碍发生情况,中位生存期,并检测血清S-100β蛋白水平。临床疗效判定:依据RECIST1.1标准[5]评估疗效。总有效率=完全缓解率+部分缓解率。随访1年,计算两组中位生存期。
参照美国精神疾病诊断标准第4版[6]进行分析,并观察精神障碍者的具体情况,其诊断主要依赖于临床,病程至少3个月以上,有社会功能明显受损或缺乏现实检验能力,存在2项及以上精神症状。
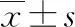
2 结 果
2.1 两组放疗后不良反应发生情况比较 放疗后两组不良反应较轻微,多为Ⅰ级和Ⅱ级。不良反应总发生率比较,差异无统计学意义(P>0.05)。见表2。

表2 两组放疗后毒性反应发生情况比较[n(%)]
2.2 两组放疗后精神障碍发生情况比较 甲组精神障碍发生率高于乙组(P<0.05),见表3。
2.3 两组不同时间的中位生存期、血清S-100β蛋白水平比较 两组中位生存期比较,甲组8.3个月,短于乙组的11.2个月(P<0.05),见图1。甲组放疗后1、5、14 d的血清S-100β蛋白水平高于乙组(P<0.05)。见表4。

表3 两组放疗后精神障碍发生情况比较[n(%)]

表4 两组不同时间的血清S-100β蛋白水平比较

图1 生存函数

组别n时间60~<70分70~<80分80~<90分90~<100分甲组30治疗前20(66.67)10(33.33)00治疗后1(3.33)2(6.67)5(16.67)22(73.33)乙组30治疗前20(66.67)9(30.00)01(3.33)治疗后2(6.67)3(10.0)6(20.00)19(63.33)
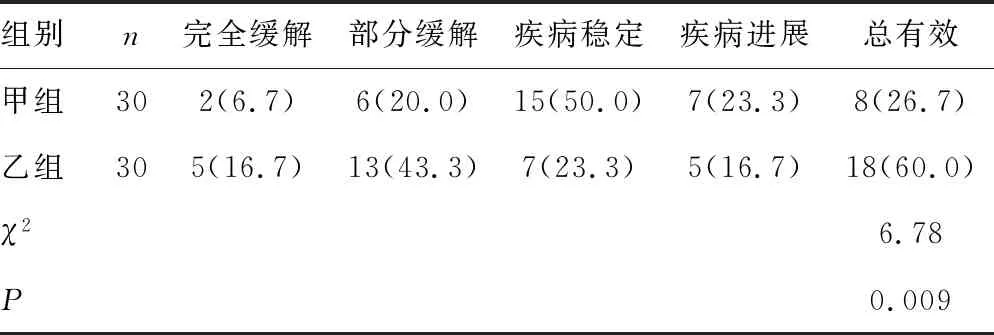
表6 两组临床疗效比较[n(%)]
2.4 两组KPS评分、临床疗效比较 治疗前后两组KPS评分比较,差异均无统计学意义(P>0.05)。见表5。甲组临床疗效的总有效率高于乙组,差异有统计学意义(P<0.05)。见表6。
3 讨 论
脑转移瘤是指原发于身体其他部位的肿瘤细胞进入颅内,属于继发性恶性肿瘤,多发生于大脑半球的顶枕叶区,占颅内肿瘤的3.5%~10.0%[7]。脑转移瘤的发展较为快速,病程短,可在短时间内表现出脑组织的定位症状及邻近组织受侵及压迫症状。导致脑转移瘤最常见的原发恶性肿瘤主要有肺癌、乳腺癌等,其中其肺癌最为常见,且多数为多发,易导致肺癌患者治疗失败[8-9]。
放射治疗是脑转移瘤最常用的一种治疗方式,因部分脑转移瘤为多发性,目前以全脑放疗(WBRT)作为脑转移瘤的主要治疗方法,但在放射治疗后,多数患者会在1年内发生精神障碍,临床上主要表现为意识障碍、智力下降、人格改变、癫痫等,这可能与放射治疗会造成脑损伤有关。有研究发现,不同治疗分割方式对患者造成的不同的精神障碍,大剂量的放射治疗,会产生精神衰弱、亢进,甚至痴呆、昏迷等,部分可导致死亡[10-12]。因此需探讨一种较为合适的放射治疗分割方式,以减轻脑损伤,降低精神障碍的发生率,提高临床疗效,延长生存时间。本次研究就两种不同放射分割方式治疗脑转移瘤的临床疗效及精神障碍进行分析,以便能够为脑转移瘤患者提供一种较为有效的治疗方案。
本次研究结果显示,甲组治疗总有效率低于乙组,且中位生存时间短于乙组,差异有统计学意义(P<0.05),这一结果提示,低剂量分割方式具有更好的治疗效果,且能够延长患者的生存时间。另外本次研究还就两组患者的精神障碍及脑损伤情况进行了探讨。本研究结果显示:甲组精神障碍发生率高于乙组,提示低剂量分割方式能够降低脑转移瘤的精神障碍发生率,这一结果与金红松等[13]研究结果一致,但金红松等[13]的研究中,放射分割方式仅为全脑放疗,并未进行局部推量,而本次研究中笔者在进行全脑放疗后还进行了局部推量,且局部推量的剂量更小,因此本次研究对脑转移瘤患者精神障碍的影响更小。另外金红松等[13]的研究中,仅对精神障碍情况进行了研究,而本次研究还对患者的临床疗效、中位生存期及脑损伤进行了探讨。
S-100β蛋白是人体钙离子结合蛋白,主要存在于中枢神经系统各部位的星状神经胶质细胞的胞液中,可刺激神经突触的产生和生长,促进脑部损伤的修护。正常人体中,S-100β蛋白水平是微量的,难以检测到,一旦达到可检测水平,表明脑损害已经产生,且含量越高,脑损害程度越严重。一般认为,中枢神经系统细胞损伤时,S-100β蛋白可从胞液中渗出进入脑脊液中,再经受损的血脑屏障进入血液,因此脑脊液和血液中的S-100β蛋白增高是中枢神经系统损伤的特异度和灵敏度指标[14]。有研究显示:S-100β蛋白在正常情况下,具有修复人体脑部损伤的作用,但当含量过高时,就会造成神经损害[15]。本次研究结果显示,放疗后1、5、14 d,甲组患者的血清S-100β蛋白水平均高于乙组,且呈上升趋势,而乙组3次检测结果未见明显升高,这一结果证实,低剂量分割方式对患者的脑损伤更小,安全性更高。这一结果与胡潺潺等[16]研究相一致,但胡潺潺等[16]的研究中并未对中位生存时间及精神障碍进行探讨,而本次研究则弥补了这一不足。
总之,本研究中对脑转移瘤患者选取不同放射治疗分割方式,结果证实经低剂量分割方式的患者,可以获得更高的总有效率和更长的中位生存期,即临床疗效更好;同时该组患者的精神障碍发生率更低。本研究结果提示,低剂量分割方式的放疗更宜在临床得到合理的推广应用。但本次研究也具有一定的缺陷,诸如病例数有限,可能对研究结果造成一定的影响;随访时间较短,未对患者的长期疗效进行探讨,仍需深入研究。
综上所述,低剂量分割方式,治疗脑转移瘤具有更好的临床疗效,且可降低精神障碍,值得临床推广。

