硒化低聚氨基多糖对免疫抑制小鼠免疫器官及肠紧密连接蛋白表达的影响
汤 震,顾丽霞,相兴伟,2,*,闻正顺,*,曲有乐,郑 斌,2,宋厚辉
(1.浙江海洋大学食品与医药学院,浙江 舟山 316022;2.浙江省海洋开发研究院,浙江 舟山 316021;3.浙江农林大学动物科技学院,浙江 杭州 311300)
免疫低下是免疫系统异常的病理性特征,免疫系统包括免疫器官和免疫组织[1]。其中肠黏膜是机体最大的免疫组织,处于被大量抗原包围的状态,具备防御肠内致炎因子及致病微生物入侵的功能[2-3]。肠黏膜组织遭到破坏会引发许多肠源性疾病[4-5]。肠黏膜上皮细胞之间的紧密连接为主要连接方式[6],紧密连接分子是由3 种膜蛋白(闭锁蛋白(Occludin)、紧密连接蛋白和连接黏附分子)以及闭合小环蛋白(zonula occludens,ZO)家族组成,紧密连接分子表达量是反映肠道紧密连接屏障功能和通透性功能的重要指标[7-8]。其中ZO-1与Occludin定位于细胞连接处,二者是表达紧密连接屏障功能的重要蛋白,对保持紧密连接的完整性起到关键作用[9-10]。因此,阐明紧密连接分子表达量的变化,对认识肠黏膜屏障功能、预防与治疗某些肠道疾病具有重要意义。
目前,硒元素被认为具有增强机体免疫力、抗氧化、抗肿瘤的生物学功能,常用的补硒方式为补充以亚硒酸钠为代表的无机硒,其吸收转化率低且使用受到限制,使用不当会产生许多副作用[11]。通过摄入有机硒的方式补充机体所需硒元素能够提高其转化率并降低毒副作用。目前,对有机硒的开发引起了研究者的关注,其中硒多糖可发挥多糖、硒的双重生物活性,因此学者们对其研究尤为重视[12]。前期研究结果表明,硒化低聚氨基多糖(low-molecular-mass seleno-aminopolysaccharide,LSA)具有较低的毒性,且含有较高含量的多糖和更高生物活性的硒[13],具有提高机体免疫功能、改善断奶应激引起的肠道免疫失调的作用[14-15]。本实验采用腹腔注射环磷酰胺(cyclophosphamide,CPA)建立小鼠免疫抑制模型,研究LSA对免疫低下小鼠组织形态、回肠ZO-1及OccludinmRNA表达的影响,进而探讨LSA对免疫抑制小鼠的免疫器官及肠道组织的保护作用,以期为将其开发为免疫调节剂提供一定的理论依据。
1 材料与方法
1.1 动物、材料与试剂
健康BALB/c雄性小鼠80 只,6~8 周龄,体质量18~22 g,购自浙江省医学科学院,生产许可证号:SCXK(沪)2013-0016。实验前小鼠适应性饲养3 d,自由取食饮水。
CPA 美国Sigma公司;低聚氨基多糖 浙江金壳生物化学有限公司;LSA 浙江海洋大学海洋药物研究实验室;TRIzol试剂 美国Invitrogen公司;反转录试剂盒、SYBR Premix ExTaq日本Takara公司;DEPC水(RNase-Free水) 生工生物工程(上海)股份有限公司;亚硒酸钠、乙醇、异丙醇、多聚甲醛、冰乙酸均为国产分析纯。
1.2 仪器与设备
GelDoc XR System凝胶成像系统、MyCycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;Multiskan FC全自动酶标仪 美国赛默飞世尔科技有限公司;CKX41倒置显微镜 深圳市宇德立生物科技有限公司;ZHJH-C1209C型垂直流超净工作台上海智城仪器制造有限公司;ABI ViiA™ 7实时荧光定量PCR仪 美国Applied Biosystems公司。
1.3 方法
1.3.1 动物分组及给药
小鼠按体质量随机分为8 组,分别为空白组(Con组)、模型组(CPA组)、3 种剂量LSA组、亚硒酸钠组(SE组)、低聚氨基多糖组(LA组)、亚硒酸钠与低聚氨基多糖复合组(SELA组),每组10 只。空白组与模型组灌胃生理盐水,LSA1、LSA2、LSA3组分别按照0.3、0.6、0.9 mg/(kgmb·d)剂量灌胃LSA,SE组灌胃Na2SeO3(0.3 mg/(kgmb·d)),LA组灌胃低聚氨基多糖(9.87 mg/(kgmb·d)),SELA组灌胃Na2SeO3(0.3 mg/(kgmb·d))+低聚氨基多糖(9.87 mg/(kgmb·d)),连续灌胃14 d;除空白组外,其他组在第11、12、13、14天腹腔注射50 mg/kgmbCPA,每日1 次。
1.3.2 小鼠脏器指数的测定
末次给药24 h(禁食)后,小鼠称体质量,眼球取血,颈椎脱臼处死,随后迅速摘取脾脏和胸腺,用生理盐水洗涤脏器后用滤纸吸干水迹,分别称质量,记录。按照下式计算脏器指数。

1.3.3 小鼠脾脏、空肠组织形态学观察
新鲜脾脏与空肠组织用生理盐水多次冲洗,洗去残留血液,加10 mL体积分数4%多聚甲醛溶液常温固定24 h,乙醇脱水,二甲苯透明,石蜡包埋,切片机将组织石蜡块连续切成6 μm组织切片,每个组织块随机选取两张进行苏木精-伊红(hematoxylin-eosin,HE)染色,显微镜下观察组织病理变化情况。
1.3.4 小鼠回肠组织紧密连接蛋白mRNA表达水平测定
1.3.4.1 总RNA提取与反转录
小鼠回肠组织在液氮中进行充分研磨,收集回肠组织粉末,每0.1 g小肠组织加1 mL TRIzol试剂,室温静置5 min充分裂解细胞;加入0.2 mL氯仿,用力振荡离心管15 s(使溶液充分乳化,呈乳白状且无分层现象),4 ℃、12 000 r/min离心15 min;取上清液,加入等体积预冷异丙醇,充分混匀,-20 ℃静置30 min使RNA沉淀,4 ℃、12 000 r/min离心15 min,移除上清液,加入4 ℃预冷的体积分数75%乙醇溶液(DEPC水配制)1 mL,离心,温和洗涤沉淀,重复2 次,置于通风橱内使乙醇挥发;加适量DEPC水溶解RNA,即得RNA样品。取1 μL RNA样品用核酸蛋白定量仪检测OD260nm/OD280nm、OD260nm/OD230nm及RNA质量浓度,并通过琼脂糖凝胶电泳检测所提RNA的完整性。取上述RNA样品进行反转录得到cDNA,具体操作依照反转录试剂盒说明书进行。
1.3.4.2 引物设计

表 1 ZO-1、Occludin的实时荧光定量PCR引物序列Table 1 Primer sequences used for qPCR
设计并合成小鼠ZO-1、Occludin特异性引物,具体序列见表1。用SYBR Green法对反转录所得cDNA模板进行实时荧光定量PCR检测(以β-actin作为内参基因)。
1.3.4.3 实时荧光定量PCR扩增
取适量上述cDNA样品,依照荧光定量PCR试剂盒说明书进行操作。以cDNA为模板,用目的基因引物进行实时荧光定量PCR分析,扩增体系为:10 µL SYBR Green qPCR mix、0.4 µL ROXII、2.0 µL cDNA、10 µmol/L上游引物0.4 µL、10 µmol/L下游引物0.4 µL、dH2O 6.8 µL,总计20.0 µL。
将上述体系按照如下程序进行扩增:50 ℃、120 s,95 ℃、10 min;95 ℃、15 s,各靶基因相应退火温度退火60 s,40 个循环。溶解曲线的绘制按照荧光定量PCR仪的说明书进行。每个样品靶基因的相对mRNA表达水平用2-△△Ct法计算,每组别样品进行4 个重复。
1.4 数据统计与分析
实验数据以平均值±标准差表示,采用SPSS 16.0软件进行单因素方差分析,各组间釆用最小显著性差异法进行多重比较检验,P<0.05为差异显著。
2 结果与分析
2.1 LSA对小鼠脏器指数的影响
与空白组比较,模型组小鼠连续腹腔注射4 d CPA后,出现厌食、精神委顿等临床表现。对各组小鼠体质量、脾脏及胸腺指数进行测定,结果如表2所示。与对照组相比,CPA显著降低了小鼠脾脏和胸腺指数(P<0.05)。与模型组相比,灌胃LSA能显著提高小鼠脾脏及胸腺指数(P<0.05)。此外,与模型组小鼠相比,SE组、LA组及SELA组小鼠的胸腺、脾脏指数均无显著性变化。

表 2 LSA对小鼠胸腺指数及脾脏指数的影响Table 2 Effect of LSA on body mass, thymus index and spleen index in mice
2.2 LSA对小鼠脾脏组织形态的影响
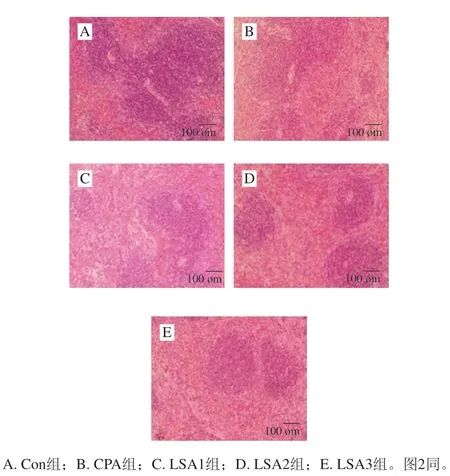
图 1 LSA对小鼠脾脏组织形态的影响(×100)Fig. 1 Effect of LSA on spleen morphology of mice (× 100)
器官的组织结构是其发挥功能的基础。脾脏分为被膜和实质,脾实质的淋巴组织由白髓和红髓组成。由图1可知,空白组小鼠脾脏结构清晰,白髓、红髓界限明显,白髓面积大;模型组小鼠脾脏结构较模糊,白髓和红髓界限不清,白髓面积明显缩小;与模型组比较,中、高剂量LSA组小鼠脾脏结构较清晰,红髓和白髓界限较明显,白髓面积增大。结果提示摄入LSA对小鼠脾脏组织有保护作用。
2.3 LSA对小鼠空肠组织形态的影响
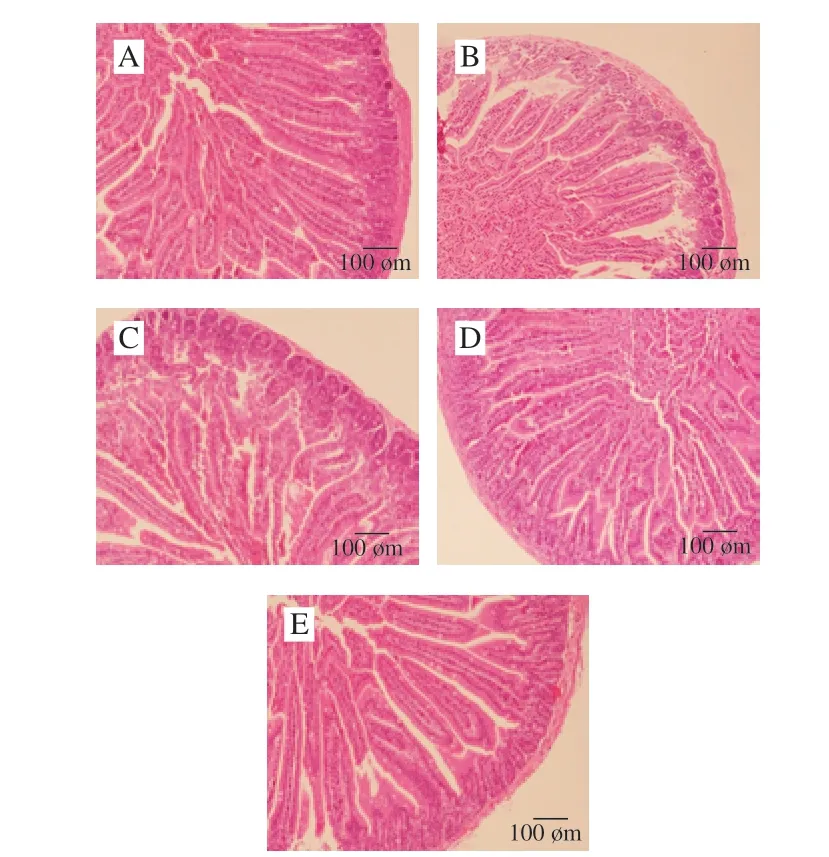
图 2 LSA对小鼠空肠组织形态的影响(×100)Fig. 2 Effect of LSA on histopathological observation of the mice jejunum (× 100)
如图2所示,空白组(图2A)小肠绒毛排列整齐、细长紧密、隐窝较深、肠壁厚实;而模型组(图2B)小肠绒毛松散且绒毛结构出现破损,部分绒毛甚至出现断裂、脱落的现象,隐窝变浅,肠壁变薄;低剂量LSA组小鼠小肠绒毛形态无明显改善,中、高剂量LSA组(图2D、E)小肠绒毛形态略有好转,相对模型组和低剂量LSA组,绒毛结构较完整,破损状态有所好转,排列较整齐。上述结果提示摄入LSA对小鼠空肠组织有一定的保护作用,能够缓解CPA导致的肠道损伤。
2.4 总RNA纯度和完整度分析结果
采用微量核酸定量仪检测RNA OD260nm/OD280nm,结果显示其值都在1.8~2.0之间,表明提取的总RNA无明显的盐类、DNA及蛋白等其他有机物污染。如图3所示,有清晰的28S、18S及5S条带,其中28S条带亮度基本是18S的两倍,5S条带亮度较弱,且条带与条带之间无明显拖尾现象,表明总RNA较完整,基本无降解。因此,所提样品总RNA质量可靠,可用于后续实验。

图 3 部分小鼠回肠组织总RNA琼脂糖凝胶电泳图Fig. 3 Agarose gel electropherogram of total RNA from ileum tissue of mice
2.5 回肠组织紧密连接蛋白mRNA表达水平
由4图可知,与空白组比较,模型组小鼠回肠ZO-1和OccludinmRNA表达量均显著降低(P<0.05)。与模型组相比,灌胃LSA后,免疫抑制小鼠回肠ZO-1及OccludinmRNA表达量有所上升,其中,中、高剂量LSA组的ZO-1、OccludinmRNA表达量显著升高(P<0.05),且中剂量LSA组的效果最好。但是SE组、LA组及SELA组小鼠回肠ZO-1、OccludinmRNA表达量与模型组相比变化不显著。
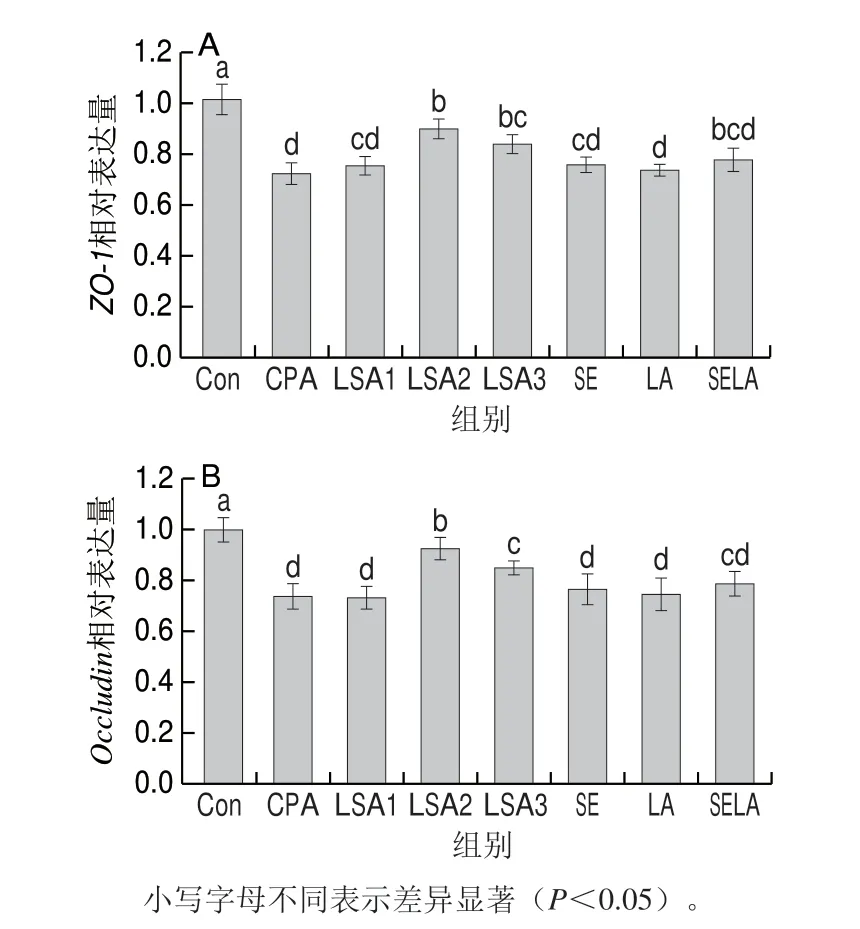
图 4 LSA对小鼠回肠ZO-1(A)和Occludin(B)mRNA表达水平的影响Fig. 4 Effect of LSA on mRNA expression of ZO-1 (A) and occludin (B)in ileum of immunosuppressed mice
3 讨 论
研究表明,硒作为机体必不可少的微量元素之一,在体内起着非常重要的作用,尤其在氧化还原系统、内分泌系统和免疫调节系统方面[16-18],但亚硒酸钠具有较大的毒性,副作用较大。为解决以亚硒酸钠补硒方式中硒毒性的问题,硒多糖作为一种低毒、高活性有机硒成为了研究的焦点,许多学者利用多糖的羟基作为结合位点与亚硒酸钠反应制备硒多糖,研究其活性。刘宽辉等证明多糖-硒化多糖复方可以增强免疫活性[19];于闯发现经亚硒酸钠化学修饰后的茶多糖(Cse-tps1)活性明显比普通茶多糖(Tps1)强,其中Cse-tps1主要是以Vas C—O—Se和O—H—Se与多糖进行结合[20];羊雪芹等通过建立CPA诱导的免疫抑制小鼠模型研究Z0206细菌富硒,发现细菌富硒多糖能增强小鼠的免疫功能,对CPA诱导的免疫抑制具有缓解作用[21]。与单一羟基结合位点的多糖相比,本研究中使用低聚氨基多糖存在氨基、酰胺基结合位点,能够提高的硒化效率,研究结果表明硒化修饰增强了低聚氨基多糖的生物活性。
免疫抑制是机体免疫功能异常的一种表现,是指机体在单一或多种致病因素的作用下,免疫系统受到损害,导致机体出现暂时性或是持久性的免疫应答功能紊乱,从而产生对疾病的高度易感性[22]。CPA作为一种临床上常用的化疗药物,其在发挥良好的抑制肿瘤细胞生长作用的同时也对正常细胞产生了一定的毒副效应,从而造成机体免疫系统损伤。因此,在免疫学研究中,常以CPA作为制备免疫抑制模型的药物。本实验采用腹腔注射CPA建立了BALB/c小鼠免疫抑制模型,实验结果显示,小鼠连续4 d腹腔注射CPA后产生了明显的免疫抑制症状,行为学上主要表现为厌食、精神委顿等,小鼠免疫器官(脾脏、胸腺)脏器指数明显减小;病理切片HE染色结果显示,模型组小鼠脾脏发生病理性结构变化,与其他文献报道的结果[23-25]基本一致。机体免疫器官由中枢免疫器官和周围免疫器官两大部分组成,本研究所涉及的胸腺、脾脏分别属于中枢免疫器官和周围免疫器官,两者的脏器指数在某种程度上能反映机体免疫功能的高低。因此,本实验考察了小鼠的胸腺及脾脏指数,结果显示,与空白组比较,模型组小鼠胸腺及脾脏指数明显下降,灌胃LSA后的小鼠胸腺及脾脏指数显著上调,说明LSA对CPA所致免疫器官萎缩有一定的预防和保护作用。本实验进一步通过病理切片HE染色观察了小鼠脾脏组织的结构形态,结果显示,较空白组小鼠,模型组小鼠的脾脏结构较模糊,红髓、白髓界限不明显,白髓面积小;灌胃LSA后,小鼠脾脏结构较清晰,红髓、白髓分界比较明显,白髓面积增大。小鼠脾脏、胸腺指数及脾脏形态学观察结果提示LSA能在一定程度上逆转CPA引起的变化,改善CPA对小鼠胸腺及脾脏造成的损伤。
肠道不仅是机体消化食物和吸收营养物质的主要场所,同时也是许多病原体入侵或起始感染的主要位点[26-27]。肠内淋巴细胞较多,且肠道接触抗原的表面积较大,因此肠道还是机体最大的免疫组织,其免疫屏障功能的正常发挥对维持机体整体免疫起着至关重要的作用[28-29]。CPA对增殖迅速的组织细胞存在强大的杀伤作用,而被应用为一种常用的恶性肿瘤化疗药物,但因其特异性不强,易产生多种副作用,其中胃肠道不良反应发生率最高,主要表现为食欲下降、呕吐、腹泻等[30]。本实验发现,BALB/c小鼠连续4 d腹腔注射CPA后出现小肠绒毛破损、变短、排列稀疏,细胞间紧密连接分子ZO-1和OccludinmRNA表达水平显著下降等变化,与文献[31-32]结果基本一致。肠腔内抗原物质的抵御作用依赖于肠道组织结构的完整性,其中小肠绒毛长度与结构的完整性在肠道黏膜免疫过程中起着重要的作用[33-34]。本实验结果显示,CPA对小肠绒毛结构有破坏作用,甚至出现部分绒毛脱落的现象,摄入LSA可以在一定程度上缓解CPA对肠绒毛结构的损伤,具有保护肠道的作用。ZO-1和Occludin是细胞间紧密连接的重要组成部分,肠道ZO-1、Occludin基因表达量结果显示LSA能显著恢复CPA所致细胞紧密连接分子表达的抑制,结合小鼠肠道HE染色结果,进一步证实了LSA对肠道的保护作用。综上,本研究结果表明LSA具有一定的免疫调节功能及保护肠道作用,这将为LSA的开发与利用提供数据支撑。

