远志三萜类成分及其药理作用研究进展
陈其润 张旭

【摘 要】远志为远志科植物远志Polygala tenuifolia Willd.或卵叶远志Polygala sibiric L .的干燥根,是一种传统中药材,其化学成分主要为皂苷、 酮和寡糖酯类化合物。目前,其研究主要集中在三萜类化学成分及复方代谢产物的分离,以及粗提物药理作用的研究上。为了评估这些药理作用的用途,已经在临床前(体外和体内)和临床模型中进行了几项研究,这对于远志的临床应用而言是至关重要的。因此,本文主要通过研究21世纪后远志三萜类化学成分及药理作用的相关文献,并对远志药效物质基础及其机理进行整合,从而为其进一步研究提供参考。
【关键词】远志;卵叶远志;三萜;药理活性
【中图分类号】R285 【文献标志码】A 【文章编号】1007-8517(2019)19-0049-08
Abstract:The roots of Polygala tenuifolia Willd.orPolygala sibiricL. “Yuanzhi”, is a well-known traditional Chinese medicine. Various saponins, xanthones and oligosaccharide esters have been isolated from this plant.Recent studies have also focused on the separation of triterpenoidconstituents, includingmetabolites oftraditional Chinese medicine, and pharmacological properties of crude extract. To evaluate these ethnopharmacological uses, several studies have been carried out in pre-clinical (in vitro and in vivo) and clinical models.It is significant for clinical application of Polygalae.In this paper, the triterpenoidconstituents andpharmacological effectsbasis of Polygala tenuifolia Willd.andPolygala sibiricL.are summarizedby reviewing literaturessafter the 21st Century.Simultaneously,therapeutic material and its mechanism of action are integrated to provide references for further study.
Key words:Polygala tenuifolia Willd.;Polygala sibiric L.; Triterpenoid; Pharmacological activity.
远志为远志科植物远志Polygala tenuifolia Willd. 或卵叶远志Polygala sibirica L.的干燥根,其有安神益智,交通心肾,祛痰,消肿之功效,常用于治疗心肾不交引起的失眠多梦、健忘惊悸、神志恍惚、咳痰不爽、疮疡肿毒、乳房肿痛等症[1]。现代研究表明其有神经保护、增强记忆、抗炎、抗病毒和抗溃疡等药理作用[2-7],这为药物的开发研究奠定了基础。因此本文综述了21世纪后,从远志的两种药用植物及其次级代谢产物中分离鉴定的三萜类化合物(见图1和表1)与药理活性研究进展,以期为该属植物的开发利用提供参考。
1 三萜类化合物
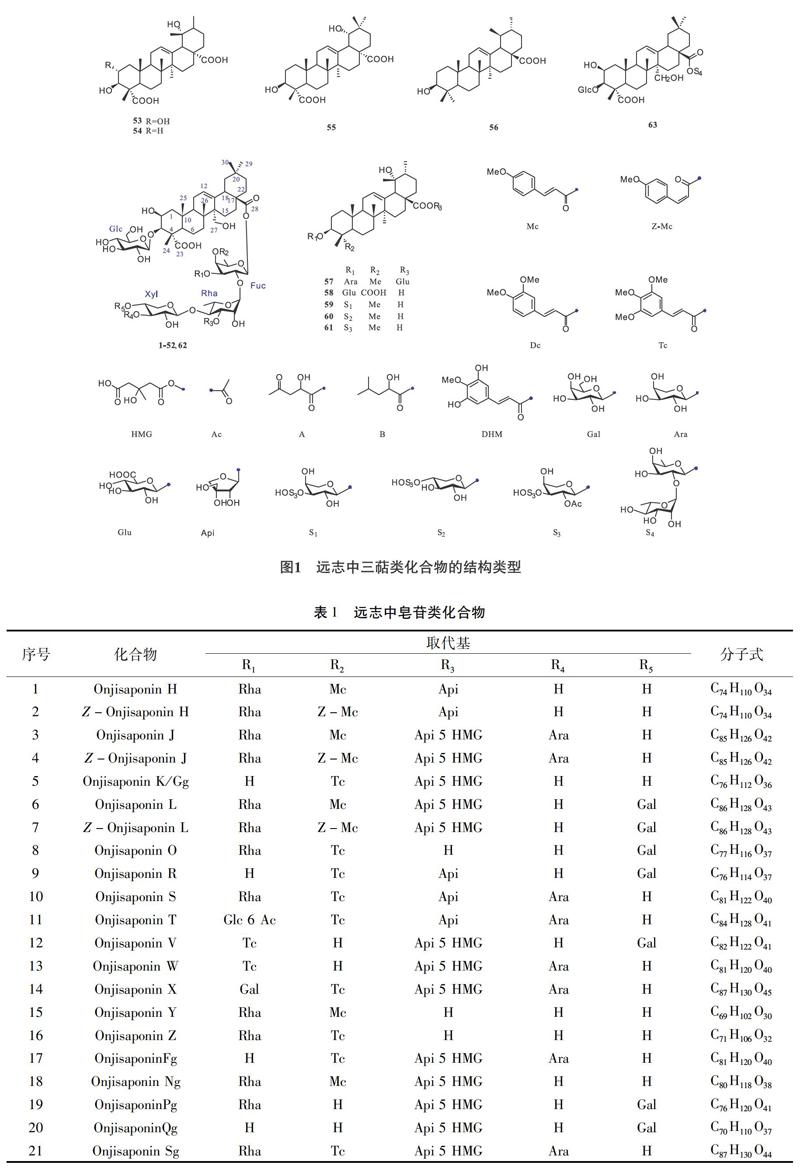
迄今為止,从远志中分离的主要活性成分有三萜皂苷、酮、寡糖酯类化合物。自21世纪以来,由于质谱、液相色谱和核磁共振等技术的广泛应用,皂苷类化合物的研究取得了进一步地发展,且证实植物体不同部位三萜的含量也有所差异。三萜类成分主要聚集在营养器官的薄壁细胞中,根系皂苷含量较高,含茎叶的地上部分皂苷含量较低。且在发育阶段呈现动态变化,在果实后期达到最高水平。因此,根和地上部分的最佳采收期应该在8月份。同时,由于随着树龄的增加,总皂苷和苷元含量呈持续下降的趋势,故一年生根系具有较高的品质。而根不同部位其含量也有显著差异,研究者通过对远志根木质部和韧皮部的“蜘蛛网”分析,阐明了“废弃木质部,保留韧皮部”的必要性[8-9]。
远志皂苷作为远志的主要活性成分之一,其均为齐墩果酸型的五环三萜皂苷。其母核特点为:C-2位常被羟基取代,C-12、13为不饱和双键;且多为双糖链,C-3位连接葡萄糖,C-28位通过酯键与夫糖相连,夫糖C-2位连接鼠李糖,鼠李糖的C-4位又与木糖相连,木糖的C-4位常被阿拉伯糖或木糖取代,C-5位则与半乳糖链接;糖链的差异主要是夫糖的C-3位、鼠李糖的C-3位和木糖C-4、C-5位所连接的糖的种类及位置不同。一般连接3-7个糖基,并含有多个取代基。
2004年,刘江云等[10-11]系统研究了开心散抗痴呆有效部分的化学成分,从中分离得到13个新化合物,即Onjisaponins J、L、O、R、S、T、Pg、Qg、Sg、Ug、Z-Onjisaponin J、Z-OnjisaponinL和Z-Polygalasaponin XXXII(3-4, 6-11, 19-21, 23, 46),并报道了Onjisaponins J、L、O、Pg、Qg、Z-Onjisaponin L的核磁数据;2个化合物Z-SeneginⅣ、Polygalasaponin XXXII(42, 45)为首次在该种分离得到,并通过电喷雾多级串联质谱(ESI/MSn)规律,推定了混合物OnjisaponinsGg、Fg、Ng、Tg(5, 17-18, 22)的结构,且皆为新化合物。该作者于2007年进一步通过电喷雾离子阱质谱联用技术(ESI-ITMSn)对以上部分化合物进行了结构分析。
2005年[12-13],北京大学的屠鹏飞教授课题组从远志中分离鉴定了OnjisaponinsJ、K、L,Z-Onjisaponin J和Z-Onjisaponin L(3-7),并发表了专利;同年,孙红详从中分离得到3个三萜皂苷Tenuifolisaponins A-B(38-39)和PolygalasaponinXXVIII(43),其中PolygalasaponinXXVIII为首次从该种中分离得到。
2006年[14],LiJ从中分离鉴定了2个化合物Onjisaponin H和Z-Onjisaponin H(1-2)。
2008年[15-17],XuTun-hai从远志跟中分离鉴定了Tenuifoside A(40)、3-β-O-β-D-glucopyranosylpresenegenin 28-O-α-L-arabipyranosyl(1→3)-β-D-xylopyranosyl(1→4)-[β-D-apiofuranosyl(1→3)]-α-L-rhamnopyranosyl(1→2)-[ α-L-rhamnopyranosyl(1→3)]-β-D-fucopyranosyl ester(41)两个三萜皂苷;LiChuang-jun分离得到6个新的三萜皂苷Onjisaponins V-Z和Vg(12-16, 24),并首次从该种中分离鉴定了Polygalasaponin XXXI(44)和E-senegasaponin a(37),并于2011年分离鉴定了OnjisaponinWg(25),并首次报道了OnjisaponinsFg、Ng、R和O的核磁数据[18]。
2013~2019年[19-22],LingYun等研究者通过超高效液相色谱-四级杆飞行时间串联质谱(UPLC/Q-TOF MS)对口服后体内远志及其代谢产物化学成分进行分析,从中鉴定了11个新化合物,即OnjisaponinsMF、TE、TF、TG、TH,Onjisaponins-1428、1560、1602、1702、1720、1864(26-36);并从中分离鉴定了Polygalasaponins XLV、LIII,Myrtifolioside A1、Desacylsenegasaponin B、Arilloside D(47-50, 52)等微量皂苷。
而对于卵叶远志的研究相对较少,宋月林[23-25]于2010年从卵叶远志地上部分分离鉴定了4个三萜苷元(53-56),即2α,3β,19α-三羟基乌索-12-烯-23,28-二羧酸、3β,19α-二羟基乌索-12-烯-23,28-二羧酸、3β,19α-二羟基齐墩果-12-烯-23,28-二羧酸和熊果酸;于2012年鉴定了地榆皂苷I(57),该5个化合物均是从该属首次分离得到,区别于常规远志的三萜类化合物;同时,在2013年分离得到5个新的三萜皂苷Sibiricasaponins A–E(58-62),2个皂苷Arilloside A(51)和Polygalasaponin XLVIII(63)为首次在该种分离得到。
2 药理作用
2.1 抗痴呆和脑保护活性 远志根粗提物及其纯化的精提物,如BT-11(粗提物)、Tenuifolin和Senegenin等对阿尔茨海默病(Alzheimers disease, AD)都有一定的治療作用。其中,远志水提物对转基因AD模型小鼠记忆缺陷有预防作用,其可防止β-淀粉样蛋白(amyloid β-protein, Aβ)诱导的轴突生长锥塌陷和轴突萎缩,还可阻止Aβ诱导的神经元生长锥内吞作用[26]。而抑制内吞作用足以防止Aβ诱导的生长锥塌陷、轴突变性和记忆障碍。因此,远志水提物可能通过抑制内吞作用,进而防止轴突变性和记忆障碍。而BT-11在体外和体内对Aβ25-35肽诱导的神经毒性具有保护作用,因此对老年人的记忆也有增强作用[27-29]。
同时,其乙醇、正丁醇提取物均能减轻海马CA1亚区缺血后神经元坏死,并能减轻缺血再灌注时的脑损伤,防止脂质过氧化,保护能量代谢[30]。Tenuifolin可能通过抑制β-位点的APP切割酶来降低COS-7细胞的Aβ分泌,而不改变Aβ40和Aβ42的比率,且能被迅速吸收到体内循环中,且保留时间较长[31-32]。
而Senegenin可使细胞存活率提高,在浓度为1μg/mL(P<0.01)和5μg/mL(P<0.05)时,能通过增强微管结合蛋白2(microtubule-associated protein 2, MAP2)和生长相关蛋白43(growth associated protein 43, GAP-43)的表达来触发神经细胞生成,且总神经细胞数量、平均长度和最大长度显著增加。后期有研究表明Senegenin可通过抑制核因子-κB(nuclear transcription factor kappa B, NF-κB)来调节Nod样受体蛋白3(Nod-like receptor protein3, NLRP3)的信号通路,从而对慢性不可预测轻度应激所致的小鼠抑郁起到治疗作用[33-34]。
研究者以神经生长因子(NGF)作为阳性对照物,用MTT法研究了远志皂苷Onjisaponins V-Z等对由谷氨酸和血清缺乏诱导的嗜铬细胞瘤细胞(PC12细胞)毒性的拮抗作用。结果表明当血清浓度降低或在培养基中加入过量的谷氨酸盐时,PC12细胞的存活率显著下降,而远志皂苷则提高了存活率。因此,推断该类皂苷具有神经保护作用[35]。而Polygalasaponin XXXII皂苷可能通过改善突触传递、激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联和提高脑源性神经营养因子水平来改善海马依赖性学习和记忆[36]。综上所述,远志有助于开发治疗老年痴呆的药物。
2.2 抗炎 除了在抗AD方面有一定的进展外,其在抗炎方面也进行了大量的研究。为证实远志根的70%的甲醇粗提物对缓激肽和环氧化酶-2(cyclooxygenase-2, COX-2)介导的疼痛和炎症有抑制作用,研究者以100mg/kg远志提取物对醋酸致扭体进行给药,发现其有明显的镇痛作用(抑制率为97%);同时,在0.1~100mg/kg的剂量范围内对大鼠足肿胀模型也具有显著的抗炎作用(抑制率为8%~33%);对缓激肽介导的大鼠回肠收缩也有明显的抑制作用(抑制率为53%)。同时,远志酸也能通过抑制白细胞介素1β(IL-1β)诱导的Wnt/β-catenin和MAPK信号通路,从而对骨关节炎产生一定的治疗作用[37-38]。
为了研究远志水提物治疗固定化应激加重特应性皮肤皮炎及其潜在机制,将偏苯三酸酐(TMA)涂于小鼠的双耳,在之后的连续6天对双耳进行2 h的固定化应激和远志水提物给药。结果表明远志能显著抑制人肥大细胞株HMC-1细胞脱粒、胰蛋白酶分泌和蛋白激酶A(protein kinase A, PKA)活性,并选择性地抑制p38MAPK的磷酸化。其机理是水提物通过调节PKA/p38 MAPK的信号通路,显著抑制HMC-1细胞脱粒,从而减轻固定化应激引起的特应性皮炎加重;并通过超高效液相色谱-电喷雾串联质谱(UPLC-ESI-MS)分析,从中鉴定了Onjisaponins Sg、O、V、J、Ng,SeneginⅢ和Polygalasaponin XXXII等三萜皂苷[39]。这表明远志皂苷对皮炎有一定的治疗作用。
除了对远志粗提物的研究外,研究者对Tenuigenin的抗炎机制进行了大量的研究[40-43]。其能显著降低前列腺素E2(prostaglandin E2, PGE2)和一氧化氮的产生,降低RAW 264.7细胞中诱导型一氧化氮合酶(nitric oxide synthase, iNOS)和COX-2基因的表达,抑制c-Jun氨基末端激酶1/2(c-Jun N-terminal kinase1/2, JNK1/2)、细胞外信号调节蛋白激酶1/2(extracellular signal-regulated kinase1/2, ERK1/2),以及p38MAPK和NF-κB(p65)的磷酸化,阻止IκBα蛋白的磷酸化和降解。并能显著上调血红素加氧酶(HO-1)和红系衍生核因子相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)的表达,这与诱导Nrf2核易位和降低Kelch样环氧氯丙胺相关蛋白1(Keap1蛋白)表达有关。同时,Tenuigenin对金黄色葡萄球菌致小鼠肺炎有保护作用,且稳定性较高,能显著减弱金黄色葡萄球菌诱导的肺组织病理学变化,还抑制了肺湿/干(w/d)比值和炎性细胞因子肿瘤坏死因子α(TNF-α)和IL-1β的产生,并能显著抑制金黄色葡萄球菌诱导的NF-κB激活。
2.3 镇静和抗焦虑 早期研究证实远志根水提物与甲醇提取物的氯仿层和正丁醇层对环磷酸腺苷(cAMP)磷酸二酯酶均显示出较强的抑制活性,且正丁醇部分对cAMP磷酸二酯酶表现出更强的抑制活性,当剂量为100 μg/mL时,其抑制率73.3%。并从这两个部位分别得到了活性化合物油酸和远志皂苷。其中Onjisaponins E、F、G与阳性对照药罂粟碱的IC50值接近,而Onjisaponin A的活性高于罂粟碱。机理研究表明,远志皂昔和罂粟碱一样对cAMP磷酸二酯酶起到了非竞争抑制作用[44]。
远志皂苷可增加小鼠在孔板试验中的头倾角和在X-迷宫开放臂中的时间,延长睡眠时间和缩短睡眠潜伏期,表明其具有明显的抗焦虑和镇静催眠活性,且具有相对安全的剂量范围[45]。研究者为了探讨远志粗提物对小鼠反复抑制应激诱导焦虑样行为反应的影响,以及小鼠海马中枢去甲肾上腺素能和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号系统的变化。连续14天在小鼠应激前30 min口服提取物(50或250mg/kg)。并通过测定血清皮质酮水平和下丘脑中促肾上腺皮质激素释放因子的表达来反应其抗焦虑的能力。与对照受试者相比,每日给予较大剂量的提取物(250mg/kg)可增加在高架迷宫中的开放臂时间;并能逆转蓝斑中酪氨酸羟化酶的表达,减少海马中BDNF mRNA的表达。进而使得下丘脑-垂体-肾上腺轴的表达减弱。这些研究结果表明,远志提取物可显著降低小鼠的焦虑样行为[46]。
通过脑电图和肌电图对口服Tenuifolin(20, 40, 80 mg/kg)的镇静催眠作用进行研究,并采用免疫组化双染色法评价睡眠-觉醒调节脑区的神经元活性。结果显示当剂量为40和80mg/kg时,其通过增加非快速眼动(NREM)和快速眼动(REM)睡眠量显著延长了总睡眠时间。而免疫组化双染色显示,其可提高腹外侧视前区(VLPO)氨基酸能非快速眼动促睡眠神经元c-Fos基因的阳性率,以及后背被盖区(LDT)和脑桥头被盖区(PPT)的胆碱能快速眼动睡眠促进神经元;并降低唤醒神经元c-Fos基因的阳性率。神经递质检测显示,其能显著降低蓝斑、VLPO、PPT和LDT中的去甲肾上腺素(NA)水平,升高VLPO、LC和PEF中的氨基丁酸能水平,增加了LDT和PPT中的乙酰胆碱(Ach)水平,且对自主运动无影响。以上结果为Tenuifolin显著增强小鼠睡眠提供了依据,也揭示远志具备开发为镇静催眠药的潜力[47]。
2.4 抗病毒 相对于远志脑保护等作用而言,其抗病毒的研究較少。据日本研究者的一篇专利报道,远志皂苷可预防和治疗丙型肝炎病毒感染[48]。远志水提液(0.01-1 μg/mL)剂量依赖性地抑制乙醇诱导的IL-1α的分泌,同时还可抑制乙醇和IL-1α导致的细胞毒性。此外,对IL-1α诱导的肝肿瘤细胞株HepG2的凋亡也具抑制作用。这表明远志的水提液可通过抑制HepG2细胞凋亡来抑制乙醇所引起的细胞毒[49]。
為了证实远志皂苷具有粘膜佐剂活性,分别用Onjisaponins A、E、F和G(10 μg)与流感疫苗(10 μg)对小鼠进行鼻内接种,在4周后,血凝抑制(hemagglutination-inhibiting, HI)抗体效价比对照组小鼠提高3-14倍;当分别用10mg皂苷与10mg疫苗进行接种时,与疫苗单独接种3周后相比,血清HI抗体滴度增加了27~50倍,同样的条件也显著提高了鼻腔抗流感病毒IgA抗体滴度。同时,在感染小鼠的支气管肺泡灌洗液中,鼻内接种Onjisaponin F可抑制小鼠流感病毒A/PR/8/34的增殖。其次,分别用Onjisaponins A、E、F和G(10 μg)和白喉-百日咳-破伤风(DPT)疫苗(10 μg)对小鼠进行鼻内接种,其血清免疫球蛋白G和鼻内免疫球蛋白A抗体滴度显著增加。在高达100 μg/mL的浓度下,所有的远志皂苷都显示极低的溶血活性。这表明远志皂苷可能为流感和DPT疫苗的鼻内接种提供安全有效的佐剂[50]。
2.5 降脂 为了研究远志提取物是否具有抗肥胖活性,及其对肝脏基因表达和肠道微生物群的影响。研究者[51]使用3T3-L1脂肪细胞和高脂肪饮食诱导的肥胖小鼠模型来确定其对脂质积累的影响,阐明了其通过降低脂质的形式,抑制细胞内脂质积累的可能性。经远志提取物治疗后,由高脂肪饮食引起的低度慢性肥胖症也有所减少,并改善了高脂肪饮食肠道中相对较低的拟杆菌/硬杆菌比率。总之,其通过诱导主转录因子过氧化物酶体增殖物激活受体α(PPARα)的表达来抑制脂质积累,减轻了肥胖的低度慢性炎症,也改变了肠道微生物群的分布。这表明,远志有潜力被开发成为一种抗肥胖食品,以及在药物研发中起到降脂的功效。
同时,还有研究者对其复方进行了研究,KBH-1由三白草、姜黄和远志混合而成,不仅能抑制游离脂肪酸(FFA)作用下肝癌细胞(HepG2细胞)的脂质沉积,而且能显著降低脂质生成的主要因子和提高脂质分解的主要因子。同时,在高脂饮食(HFD)诱导的肥胖模型中,其通过减轻对生脂基因和激酶的影响来改善肝脂肪变,并能显著改善肥胖模型和原代培养的皮质神经元细胞中瘦素介导的受肥胖或FFA影响的信号。因此,采用高效液相色谱法对KBH-1进行了分析,确定了Onjisaponin B对甘油三酯的含量有明显的抑制作用[52]。
3 结语
远志属植物在我国有丰富的自然资源,远志皂苷作为远志的主要成分,具有抗痴呆和脑保护、抗炎、镇静和抗焦虑等药理作用。但在这两种药用远志中,研究最多的是细叶远志在记忆改善方面的作用,揭示其在阿尔茨海默病治疗中的潜力;其次,是其在抗炎方面的研究,以及通过液质联用识别鉴定远志组方的药物代谢产物等。然而,细叶远志提取物、组分及单体对记忆和中枢神经系统保护的作用机制、抗炎机制,以及其在抗病毒、镇静抗焦虑等方面的物质基础及机理都还需进一步的研究证实。同时,另一种药用植物卵叶远志,除了宋月林等研究者从中分离得到少数单体化合物外,其在药理学研究方面还未见报道。作为同属植物,卵叶远志还存在较大的研究潜力。所有的研究结果表明,远志可能在发现新的药物方面发挥重要作用。本文对药用远志的三萜类成分及其生物活性进行综述,为该属植物的进一步开发和利用提供科学依据。
参考文献
[1]国家药典委员会.中国药典[S]. 一部. 2015.
[2]MIAO M S, SHI J J, GUO L, et al. Effect of topical application of two Polygala tenuifolia species decoction on guinea pig skin[J]. Trop J Pharm Res, 2017, 16 (1):75-81.
[3]Nagajyothi P C, Cha S J, YANG I J, et al. Antioxidant and anti-inflammatory activities of zinc oxide nanoparticles synthesized using Polygala tenuifolia root extract[J]. J Photoch Photobio B, 2015, 146:10–17.
[4]LI Z Y, LIU Y, WANG L W, et al. Memory-enhancing effects of the crude extract of Polygala tenuifolia on aged mice[J]. Evid-Based Compl Alt, 2014, doi:10.1155/2014/392324.
[5]YU X B, LIU G L, ZHU B, et al. In vitro immunocompetence of two compounds isolated from Polygala tenuifolia and development of resistance against grass carp reovirus (GCRV) and dactylogyrus intermedius in respective host[J]. Fish Shellfish Immu, 2014 (41):541-548.
[6]XIN T, ZHANG F B, JIANG Q Y, et al. Purification and antitumor activity of two acidic polysaccharides from the roots of Polygala tenuifolia[J]. Carbohyd Polym, 2012 (90):1671-1676.
[7]Park H, Kang S, Nam E, et al. The protective effects of PSM-04 against beta amyloid-induced neurotoxicity in primary cortical neurons and an animal model of Alzheimers disease[J]. Front Pharmacol, 2019, doi:10.3389/fphar.2019.00002.
[8]TENG H M, FANG M F, CAI X, et al. Localization and dynamic change of saponin in vegetative organs of Polygala tenuifolia[J]. J Integr Plant Biol, 2009, 51 (6):529-536.
[9]YANG F, YU H J, CHAI X, et al. Illumination on “Reserving Phloem and Discarding Xylem” and quality evaluation of radix Polygalae by determining oligosaccharide esters, saponins, and xanthones[J]. Molecules, 2018 (23):836-846.
[10]劉江云. 中药经方开心散抗老年性痴呆的物质基础研究[D]. 中国协和医科大学, 中国医学科学院, 2004.
[11]LIU J Y, YANG X D, HE J M, et al. Structure analysis of triterpene saponins in Polygala tenuifolia by electrospray ionization ion trap multiple-stage mass spectrometry[J]. J Mass Spectrom, 2007 (42):861-873.
[12]姜勇, 屠鹏飞. 一组具有抗神经细胞凋亡功效的化合物: 中国, CN1631865[P], 2005-06-29.
[13]孙红祥. 远志中皂营类免疫佐剂活性成分的分离及活性评价[D]. 杭州:浙江大学, 2005.
[14]LI J, JIANG Y, TU P F. New acylated triterpene saponins from Polygala tenuifolia willd[J]. J Asian Nat Prod Res, 2006, 8 (6):499-503.
[15]XU T H, LV G, XU Y J, et al. A novel triterpenoid saponin from Polygala tenuifolia Willd[J]. J Asian Natl Prod Res, 2008, 10 (8):803-806.
[16]XU T H, LV G, LIU T H, et al. A new glycoside from Polygala tenuifolia Willd[J]. Chinese Chem Lett, 2008(19):817-820.
[17]LI C J, YANG J Z, YU S S, et al. Triterpenoid saponins with neuroprotective effects from the roots of Polygala tenuifolia[J]. Planta Med, 2008, 74:133-141.
[18]LI C J, YANG J Z, YU S S, et al. Triterpenoid saponins and oligosaccharides from the roots of Polygala tenuifolia Willd[J]. Chinese J Nat Med, 2011, 9 (5): 0321-0328.
[19]LING Y, LI Z X, CHEN M C, et al. Analysis and detection of the chemical constituents of radix Polygalae and their metabolites in rats after oral administration by ultra high-performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. J Pharmaceut Biomed, 2013(85):1-13.
[20]LING Y, LI Z X, CHEN M C, et al. Analysis of multiple constituents in Cong-Ming-Tang, a Chinese herbal formula for the treatment of amnesia, by high-performance liquid chromatography with quadrupole time-of-flight mass spectrometry[J]. Phytochem Analysis, 2013, 24 (6):677-688.
[21]FENG G F, LIU S, PI Z F, et al. Studies on the chemical and intestinal metabolic profiles of Polygalae radix by using UHPLC-IT-MS(n) and UHPLC-Q-TOF-MS method coupled with intestinal bacteria incubation model in vitro[J]. J pharmaceut biomed, 2018(148):298-306.
[22]FENG G F, LIU S, PI Z F, et al. Comprehensive characterization of in vivo metabolic profile of Polygalae radix based on ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. J Pharmaceut Biomed, 2019(165):173-181.
[23]宋月林, 姜勇, 周思祥, 等. 卵葉远志地上部分化学成分研究[J]. 中草药, 2010, 41 (1):27-29.
[24]宋月林, 姜勇, 毕丹, 等. 卵叶远志地上部分正丁醇萃取物的化学成分研究[J]. 中国中药杂志, 2012, 37 (4): 471-474.
[25]SONG Y L, Zwng K W, SHI T X , et al. Sibiricasaponins A–E, five new triterpenoid saponins from the aerial parts of Polygala sibirica L .[J]. Fitoterapia, 2013(84):295-301.
[26]Tomoharu K, Keisuke H, Tetsuya A, et al.Polygalae radix extract prevents axonal degeneration and memory deficits in a transgenic mouse model of Alzheimers disease[J]. Front Pharmacol, 2017, doi:10.3389/fphar.2017.00805.
[27]LIU Y M, LI Z Y, HU H, et al. Tenuifolin, a secondary saponin from hydrolysates of polygalasaponins, counteracts the neurotoxicity induced by abeta 25-35 peptides in vitro and in vivo[J]. Pharmacol Biochem Behav, 2015 (128):14-22.
[28]Shin K Y, Lee J Y, Won B Y, et al. BT-11 is effective for enhancing cognitive functions in the elderly humans[J]. Neurosci Lett, 2009, 465 (2):157-159.
[29]Lee J Y, Kim K Y, Shin K Y, et al. Effects of BT-11 on memory in healthy humans[J]. Neurosci Lett, 2009, 454 (2):111-114.
[30]Park J H, Kim J S, Jang D S, et al. Effect of Polygala tenuifolia root extract on cerebral ischemia and reperfusion[J]. Am J Chinese Med, 2006, 34 (1):115-123.
[31]LV J, JIA H, JIANG Y, et al. Tenuifolin, an extract derived from tenuigenin, inhibits amyloid-βsecretion in vitro[J]. Acta Physiol, 2009 (196):419-425.
[32]WANG Q, XIAO B X, PAN R L. An LC-MS/MS method for simultaneous determination of three Polygala saponin hydrolysates in rat plasma and its application to a pharmacokinetic study[J]. J Ethnopharmacol. 2015, doi:10.1016/j.jep.2015.04.033.
[33]Jesky R, Chen H L. The neuritogenic and neuroprotective potential of senegenin against Aβ-induced neurotoxicity in PC 12 cells[J]. BMC Complem Altern M, 2016, 16:26.
[34]LI H W, LIN S Y, QIN T T, et al. Senegenin exerts anti-depression effect in mice induced by chronic unpredictable mild stress via inhibition of NF-κB regulating NLRP3 signal pathway[J]. Int Immunopharmacol, 2017 (53):24-32.
[35]LI C J, YANG J Z, YU S S, et al. Triterpenoid saponins with neuroprotective effects from the Roots of Polygala tenuifolia[J]. Planta Med, 2008 (74):133-141.
[36]XUE W, HU J F, YUAN Y H, et al. Polygalasaponin XXXII from Polygala tenuifolia root improves hippocampal-dependent learning and memory[J]. Acta Pharmacol Sin, 2009 (30):1211-1219.
[37]Oh J J, Kim S J. Inhibitory effect of the root of Polygala tenuifolia on bradykinin and COX 2-mediated pain and inflammatory activity[J]. Trop J Pharm Res. 2013, 12 (5):755.
[38]XU K, MA C Y, XU L H, et al. Polygalacic acid inhibits MMPs expression and osteoarthritis via Wnt/βcatenin and MAPK signal pathways suppression[J]. Int Immunopharmacol, 2018 (63):246-252.
[39]Sur O, Lee B, Yoon Y S, et al. Extract of Polygala tenuifolia alleviates stress-exacerbated atopy-like skin dermatitis through the modulation of protein kinase A and p38 mitogen-activated protein kinase signaling pathway[J]. Int J Mol Sci, 2017,doi: 10.3390/ijms18010190.
[40]LV H M, REN W Z, ZHENG Y W, et al. Tenuigenin exhibits anti-inflammatory activity via inhibiting MAPK and NF-κB and inducing Nrf2/HO-1 signaling in macrophages[J]. Food Funct, 2015, doi:0.1039/c5fo00807g.
[41]YUAN H L, LI B, XU J, et al. Tenuigenin protects dopaminergic neurons from inflammation mediated damage induced by the lipopolysaccharide[J]. CNS Neurosci Ther, 2012 (18):584-590.
[42]WANG X K, LI M, CAO Y Z. Tenuigenin inhibits LPS-induced inflammatory responses in microglia via activating the Nrf 2-mediated HO-1 signaling pathway[J]. Eur J Pharmacol, 2017, doi:10.1016/j.ejphar.2017 (5).004.
[43]YU B, QIAO J T, SHEN Y B. Protective effects of tenuigenin on staphylococcus aureus-induced pneumonia in mice[J]. Microb Pathogenes, 2017, doi:10.1016/j.micpath.2017.07.023.
[44]Nikaido T, Ohmoto T, Saitoh H, et al. Inhibitors of cyclic adenosine monophosphate phosphodiesterase in Polygala tenuifolia[J]. Chem Pharm Bull, 1982, 30 (6):2020-2024.
[45]YAO Y, JIA M, Rahman K, et al. Anxiolytic and sedative-hypnotic activities of polygalasaponins from Polygala tenuifolia in mice[J]. Pharm Biol, 2010, 48 (7):801-807.
[46]Lee B, Sur B, Shin S, et al. Polygala tenuifolia prevents anxiety-like behaviors in mice exposed to repeated restraint stress[J].Anim Cells Syst,2015,19 (1):1-7.
[47]CAO Q, JIANG Y, CUI S Y, et al. Tenuifolin, a saponin derived from Radix Polygalae, exhibits sleep-enhancing effects in mice. Phytomedicine, 2016, doi:10.1016/j.phymed.2016.10.015.
[48]伊藤達也, 青木雅弘, 須藤正幸. Preventive and remedy for hepatitis C virus infection: 日本, JP-WO2006046674-A[P].
[49]Koo H N, Jeong H J, Kim K R, et al. Inhibitory effect of interleukin-1α-induced apoptosis Polygala tenuifolin HepG2 cells[J]. Immunopharm Immunot, 2000, 22 (3):531-544.
[50]Nagai T, Suzuki Y, Kato T, et al. Onjisaponins, from the root of Polygala tenuifolia Willdenow, as effective adjuvants for nasal influenza and diphtheria–pertussis–tetanus vaccines[J]. Vaccine, 2001 (19):4824-4834.
[51]WANG C C, Yen J H, CHENG Y C. Polygala tenuifolia extract inhibits lipid accumulation in 3T3-L1 adipocytes and high-fat diet-induced obese mouse model and affects hepatic transcriptome and gut microbiota profiles[J]. Food Nutr Res, 2017, doi:10.1080/16546628.2017.1379861.
[52]Lee J H, Lee J J, Cho W K, et al. KBH-1, an herbal composition, improves hepatic steatosis and leptin resistance in high-fat diet-induced obese rats[J]. BMC Complem Altern M, 2016 (6):355-366.
(收稿日期:2019-08-18 編辑:刘斌)

