典型肺纤毛黏液结节性乳头状肿瘤1例临床病理分析
张勇 陆世春 王霄霖 樊露 欧阳兰巍 束余声
肺纤毛黏液结节性乳头状肿瘤(ciliated muconodular papillary tumor, CMPT)是一种罕见的肺部肿瘤。临床工作中,病理科医师和胸外科医师对其缺乏充分的认识,易将其误诊为腺癌而导致过度治疗。本文通过对我院首例CMPT患者进行回顾性分析,并结合相关文献对该肿瘤的诊断治疗进行深入探讨,以提高对该肿瘤的认识,避免临床工作中出现误诊。
1 材料与方法
1.1 临床资料 男,55岁,因“体检发现肺结节8个月”入院,患者无胸闷胸痛、无咳嗽咳痰、无畏寒发热等症状,既往体健,无肿瘤家族史及个人吸烟史,体格检查及相关实验室检查未见异常,8个月间随访两次胸部计算机断层扫描(computed tomography, CT),结节无明显变化,本次入院查CT报告:右下肺近胸膜处可见混合结节影,密度不均,大小约9 mm×9 mm,边界清晰,结节内存在不规则厚壁空洞,周围胸膜稍增厚(图1A),入院完善相关检查后行右下肺楔形切除术。术后患者恢复良好,手术5 d后出院。
1.2 方法 标本取出后,经4%中性甲醛固定,常规取材、脱水后石蜡包埋,4 μm厚切片,行HE染色。免疫组化采用EnVision法,采用即用型抗体包括CEA、TTF-l、CK5/6、p63、CK7、CK20、和Ki-67(Dako)Napsin A。
2 结果
2.1 外观 在楔形切除的肺组织紧接胸膜处,距切缘约3 cm见一结节,大小12 mm×5 mm×4 mm,切面灰褐、质中、境界较清楚,具有黏液(图1B)。
2.2 镜检 结节由增生的纤毛细胞、黏液细胞及基底样细胞混合组成,以乳头状、腺样结构为主,纤毛细胞衬覆于乳头状结构表面,基底样细胞位于外层,黏液细胞则位于两者之间,各种细胞异型不明显(图1C)。
2.3 免疫组化 上皮细胞CEA(+)、CK7(+)(图1D);CA125(+)、TTF-1(弱+)(图1E);CK20(-)、Ki67(约1%+)、CK5/6(+);基底细胞P63(+)(图1F)。
3 讨论
根据其组织形态学及临床表现,有研究[1]于2002年对该病例进行了首次报道并将其命名为CMPT,截止目前,国内外相关个案报道仅约数十例,是一种较为罕见的肺部肿瘤。2015年世界卫生组织(World Health Organization, WHO)呼吸系统肿瘤分类中未对该肿瘤进行描述;该病主要发生在东方人群,西方人中亦可见少量发病[2],男性相对多见,而是否吸烟与该病并无明显相关性,患者中又以中老年人较为多见,但亦有青少年罹患该病的报道[3],该病在临床上一般无特殊症状,多由体检或其他疾病进行检查时偶然发现。
3.1 诊断 CMPT在外观上通常为灰白或灰褐色、柔软、境界清楚的结节,具有黏液或凝胶质[4],影像学上常表现为单发的、位于肺外周的小结节,肿瘤直径通常≤15 mm[5],可见毛刺、胸膜凹陷等征象,中心可伴有不规则空洞,肿瘤界限相对清楚,形态规则或不规则[6],因该肿瘤在影像学上具有多种恶性征象,故CT检查时其常被误诊为肺腺癌。
镜下可见到该肿瘤具有特征性的生长模式,如腺泡、乳头状、微乳头状,甚至肿瘤沿着肺泡壁进行增殖,周围肺泡腔内充满黏液;肿瘤由纤毛柱状细胞、黏液细胞和基底细胞所组成,纤毛柱状细胞位于腺样及乳头样结构的表面,基底细胞位于外层起支架作用,而黏液细胞则散在分布;镜下肿瘤细胞没有见到明显异型性、核分裂象(有丝分裂)及坏死,肿瘤周围或内部可见大量肺泡腔内黏液,部分肿瘤上皮沿肺泡壁呈不连续生长,周围无包膜,且多数病例伴有形成不规则的支气管壁或厚壁血管[5],肿瘤间质有增生的纤维组织,常伴有淋巴细胞、浆细胞浸润。
免疫组化:CMPT的3种细胞表达CEA和CK7多强阳性,TTF-1弱阳性,Ki-67低表达(≤10%),CK20和MUC2阴性,基底细胞p40、p63和CK5/6强阳性,黏液细胞不表达MUC5AC,而纤毛细胞局部表达MUC5AC[4,7];本文报道的1例CMPT,肿瘤镜下病理特征及免疫组化与相关报道基本符合。
CMPT内存在多项基因突变,Kamata等[8]报道10例中有8例(80%)发生突变,其中4例具有BRAF-V600E基因突变,1例携带BRAF-G606R突变,3例检测出EGFR第19号外显子缺失;Liu等[2]认为BRAF V600E有致癌特性且其在广泛的人类肿瘤驱动中具有重要作用,其被认为是约40%的CMPT中的重要驱动突变;与此同时,Liu等[2]对报道的CMPT病例进行基因检测,其中1例显示有BRAFV600E和AKT1-E17K突变;Udo等[7]报道的4例CMPT中,2例检测到基因突变,1例为BR AF-V600E和AKT1-E17K突变,另1例首次检测到KR AS-G12D突变。然而,鉴于CMPT的病例报道数较少,针对其基因突变的研究尚不足,所以目前关于该肿瘤的驱动基因尚不能完全明确,但以上报道足可证明CMPT是一种肿瘤性病变而非反应性的化生性改变。
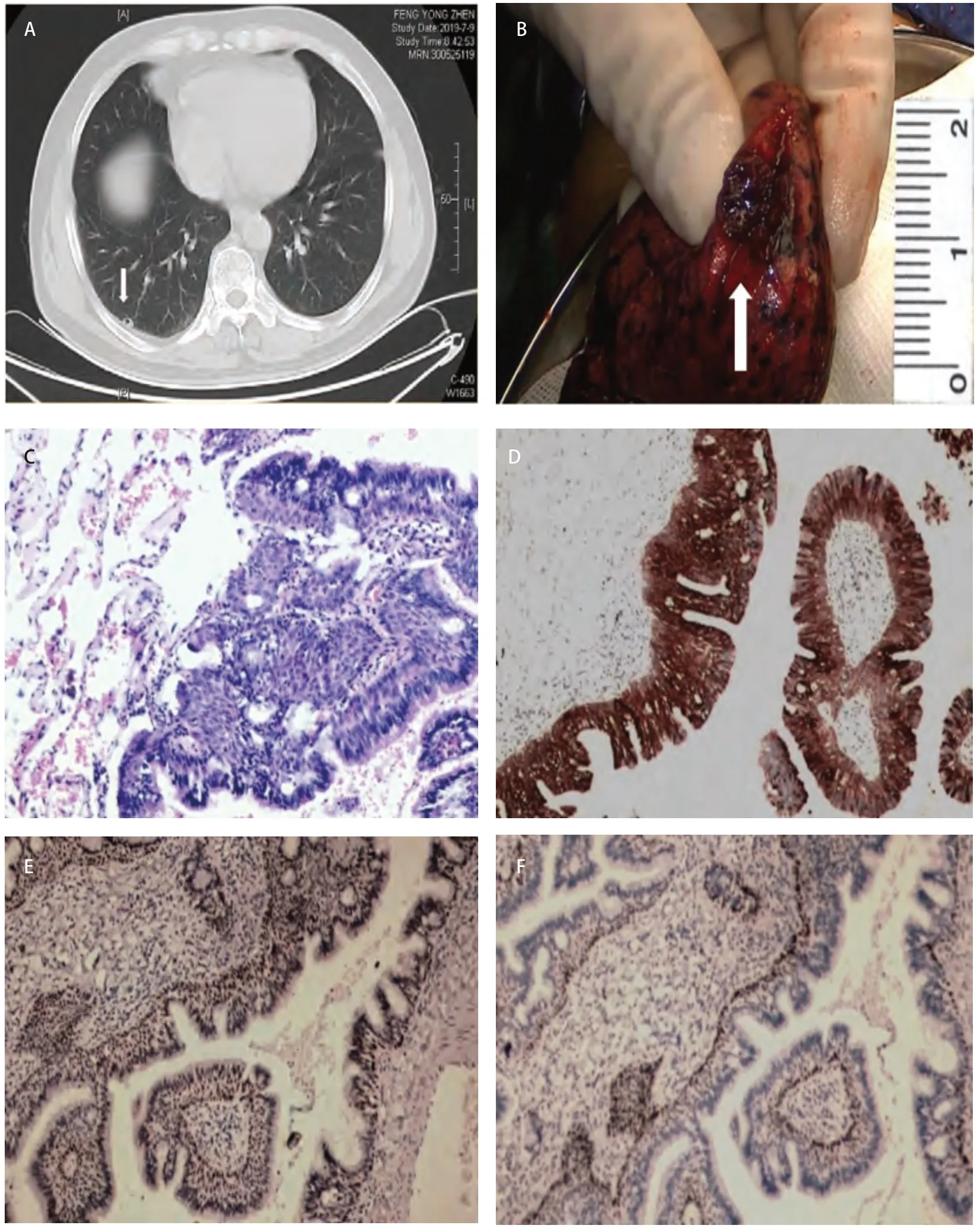
图 1 病例图片。A:CT影像上可见右下肺近胸膜处可见边界清晰的混合结节影,密度不均,大小约9 mm×9 mm,内可见不规则厚壁空洞,周围胸膜稍增厚(箭头处);B:切开肿瘤见切面灰褐、质中、境界较清楚,具有黏液,大小约12 mm×5 mm×4 mm(箭头处);C:镜下观见结节由增生的纤毛细胞黏液细胞及基底样细胞混合组成 (HE染色法,×100);D:纤毛细胞、黏液细胞和基底细胞CK7(+)(EnVision法,×100);E:纤毛细胞、黏液细胞和基底细胞TTF-1(弱+)(EnVision法,×100);F:基底细胞P63(+)(EnVision法,×100)。Fig 1 Case pictures. A: CT images showed visible mixed nodules with clear borders in the right lower lung near the pleura. The density was uneven, and the size was about 9 mm×9 mm. Irregular thick-walled cavities were visible inside, slightly thickened around the pleura (arrow); B: Cut the tumor and see the cut surface gray brown, medium and clear, with clear mucus, and the size was about 12 mm×5 mm×4 mm (arrow); C: Microscopically, the nodules are composed of a mixture of proliferating ciliated mucous cells and basal cells (HE staining, ×100); D: Ciliated cells, mucous cells and basal cells CK7 (+) (EnVision method, ×100); E: TTF-1 weakly positive for ciliated cells, mucous cells, and basal cells (EnVision method, ×100); F: Basal cell P63 (+) (EnVision method, ×100). CT: computed tomography.
3.2 鉴别诊断 鉴于CMPT的罕见性及其组织病理学、免疫组化方面的独特性,临床诊疗中需注意与以下几种病变相鉴别。
3.2.1 黏液腺癌 部分CMPT细胞沿肺泡壁不连续生长,且形成腺管、乳头状结构,肿瘤内或周边又充满黏液,容易与黏液腺癌相混淆[9];但CMPT镜下由典型的纤毛柱状细胞、黏液细胞以及连续的基底细胞构成,且其肿瘤细胞无异型性及核分裂活性;而黏液腺癌镜下多无纤毛成分,可见到不同程度的细胞异形、核分裂相及坏死,不存在连续的基底细胞群,且其免疫组化TTF-1多为阴性[10]。基因表达方面亦可作为两者鉴别点,Kamata等[4]报道,CMPT经常(5/10)表达BRAF突变,但在肺腺癌中却很少有这种突变(3%);通过以上几点对两者进行鉴别,具有相当的价值。Udo等[7]研究认为:CMPT的病变具有异质性,某些CMPT可能是侵袭性黏液腺癌的某种癌前病变,但该观点尚需要进一步研究来证实。
3.2.2 肺黏液表皮样癌 该肿瘤起源于支气管粘膜的腺体及其导管,是一种低度恶性的真性肿瘤,由黏液样细胞、表皮样细胞和中间细胞组成,与CMPT有一定相似性,但其影像表现多为中央型,通常具有多个病灶,肿瘤镜下缺乏纤毛细胞,且细胞具有异型性,亦可与CMPT进行鉴别[11]。
3.2.3 细支气管鳞状上皮化生 该病变细胞成分与CMPT类似,但CMPT一般为单病灶,而细支气管鳞状上皮化生往往形成多个病灶,且无复杂结构;再者,该病变的免疫组化MUC5AC呈阳性表达[12],而CMPT的黏液细胞多不表达MUC5AC[13]。
3.2.4 乳头状瘤 2015年世界卫生组织(World Health Organization, WHO)将支气管乳头状瘤收录在良性肿瘤范围,并将其分为鳞状细胞乳头状瘤、柱状细胞乳头状瘤及混合性乳头状瘤3种[1],后两种尤其是混合性乳头状瘤与CMPT的组织结构及细胞成分非常相似;乳头状瘤发生在大的支气管腔内,并呈息肉状突入支气管腔,患者有气道阻塞的典型表现,而CMPT则发生与肺外周组织,即支气管腔外,且多无临床症状,但也有肺外周型的乳头状瘤的病例报道[14,15];Aida等[16]描述了3例肺外周型孤立纤毛腺性乳头状瘤(solitary peripheral ciliated glandular papillomas, SPCGP),该病例在2015年被WHO引用为罕见的发生于肺外周的腺性乳头状瘤,通过对比,两种肿瘤具有很相似的临床病理学特点,SPCGP是发生于肺外周的孤立性小结节且部分病例位于细支气管内,在镜下可见到乳头状、管状结构,被覆不同比例的纤毛细胞和黏液细胞,其下可见连续的基底细胞,因此,国内外部分学者认为CMPT与SPCGP是同一类肿瘤[4,17];根据WHO定义:混合性乳头状瘤在支气管内形成,所以,该肿瘤和CMPT的生长机制可能经历了相同过程,区别仅在于它们的位置(中央或外周)以及两者与支气管腔的关联(支气管内或支气管外)[1];也有报道[13]称,混合乳头状瘤的黏液细胞MUC5AC阳性,而CMPT的黏液细胞MUC5AC为阴性;因此,乳头状瘤与CMPT究竟是不同病变还是同一病变的不同谱系,目前还存在一定的争议。
3.2.5 具有纤毛结构的乳头状腺癌 一般而言,具有纤毛结构被认为是良性的标志,但也有少量具有纤毛结构的乳头状腺癌的病例报道[18,19],但此种腺癌的纤毛被覆上皮过于单一,且肿瘤细胞存在异型及核分裂像,以及免疫组化中CMPT的基底细胞表达P63及P40,都可用于鉴别二者。
3.3 CMPT良恶性判断 多数学者倾向于将CMPT归为良性病变,理由如下:目前发现的CMPT患者,无论行肺叶切除、肺段切除或肺楔形切除,术后经过长时间随访,皆未发现复发病例,肿瘤发展遵循着良性临床过程[4];其次,CMPT组织学上具有纤毛,而纤毛的存在可作为支持良性诊断的可靠发现[20];CMPT在镜下无异型性、核分裂象、坏死以及Ki-67的低表达均支持其为良性病变[21];Kamata等[8]的研究表明:CMPT的BRAF高表达,而该基因在肺癌患者中很少发生突变(3%),在亚洲患者中更为罕见(1.3%),研究中,有3例患者表达了带有dele746-t751/s752v突变的EGFR基因,这在肺腺癌中也很少见,两种基因在CMPT及肺癌中的突变的对比亦提示CMPT的良性倾向。但有部分学者认为CMPT亦具有潜在的恶性倾向,该观点认为CMPT无包膜,正常肺泡结构被破坏,肿瘤沿肺泡壁的增殖以及其类似于原位腺癌的跳跃病变[23],肿瘤形成黏液湖、微乳头及间质纤维组织增生,CEA(+),都提示其恶性可能;且虽然发现纤毛细胞往往被认为是病变的良性过程,但亦可见到具有纤毛的肺黏液腺癌的报道[18,19,22]。因此,目前CMPT的良恶性判断尚未明确,但支持良性诊断的证据多于支持恶性诊断,因此,临床上可将CMPT作为良性肿瘤予以诊治。
3.4 CMPT的治疗 就目前而言,肺楔形切除可作为主要推荐,系统性淋巴结清扫或采样的意义并不大,但在临床实践中,由于该病罕见,临床和病理医生对该疾病缺乏了解,术中冰冻病理往往亦难以准确识别病变的性质,CMPT经常被误诊为肺腺癌,所以目前该疾病合理的诊断和治疗方式仍在探索中[23]。
4 总结
CMPT作为一种新近发现的肺部肿瘤,由于其发病罕见,国内外报道的病例数并不多。本文通过描述我院首例CMPT患者的临床资料,并查阅国内外相关文献报道,对该疾病的诊断、病理及免疫组化特点、可能的基因改变以及鉴别诊断进行了详细叙述。通过本文,胸外科医师及病理科医师可提高对该疾病的认识,尽可能避免在临床工作中出现误诊。

