电渗析法处理生物质水解液分离提纯乙酰丙酸
龚 晨,唐 兴,2*,曾宪海,2,孙 勇,2,林 鹿,2
(1.厦门市生物质清洁高值化利用重点实验室(厦门大学),福建 厦门 361102;2.福建省生物质清洁高值化技术工程研究中心(厦门大学),福建 厦门 361102)
乙酰丙酸(levulinic acid,LA)是一种具有高附加值的绿色平台化合物,在农药、树脂、溶剂、添加剂和医药等各种工业生产过程中均有重要的作用[1-2],并且被美国能源部列为十大增值生物基化学品之一,拥有广泛的应用前景[3].木质生物质是一种清洁的可再生碳源,能够替代化石资源进行化学转化,其价格便宜、无毒无害并且来源广泛,是一种优质的制备LA的原料[4-6].工业上常采用硫酸为催化剂,在水溶剂中直接水解生物质制备LA,即首先在高温下将生物质中的纤维素水解为葡萄糖单体,然后在酸存在下将葡萄糖进一步降解为5-羟甲基糠醛并最终转化为LA和甲酸(formic acid,FA),整个水解过程还伴随着大量腐殖质的产生[1].目前,木质纤维素制备LA的收率一般能达到50%以上[7-11],但如何有效地对水解液中的LA进行分离提纯仍是一个难题.LA分离提纯的方法有树脂吸附法[12]、溶剂萃取法[13]、结晶法[14]和色谱法[15]等,回收率高于90%,但这些方法只适用于较清洁的LA水溶液.生物质水解液中存在大量的腐殖质[16-17],因此难以直接使用上述方法进行处理.蒸馏法是一种应用非常广泛的分离方法,具有效率高、工艺简单、成本低等优点.但是,利用蒸馏法从含硫酸的生物质水解液中分离提纯LA的过程中,随着水解液中水分的蒸发,体系中浓硫酸的氧化性和脱水性会使LA发生剧烈的副反应,生成黑色焦油状物质,导致分离提纯过程失败,因此本研究尝试使用电渗析法对生物质水解液进行处理,除去其中的硫酸,以保证后续蒸馏过程的顺利进行.本研究首先利用固体碱活性氧蒸煮脱除木质素制备的竹浆[18-20]和工业上由玉米秸秆制备糠醛后余下的糠醛渣为原料,通过多次投料以及补加硫酸的方式得到含有高浓度LA的生物质水解液;然后对主要成分为LA、硫酸和FA的模拟水解液进行电渗析处理,分析电渗析过程中原料液中各成分的分离规律;最后,根据上述分离规律利用电渗析法处理生物质水解液并进行减压蒸馏得到高纯度的LA产品.
1 实验部分
1.1 主要试剂和仪器
LA(分析纯)和偶氮氯膦Ⅲ(显色剂)购自阿拉丁试剂(上海)有限公司;硫酸(质量分数98%)、FA、乙醇、甲基异丁基酮、氯化钡和氯化钠均为分析纯,购自国药集团化学试剂有限公司.
400 mL高压反应釜,大连自控设备厂;EX-3BT型台式电渗析仪和均相膜堆,杭州蓝然环境技术有限公司;Starter 3C型pH计,奥豪斯仪器(上海)有限公司;Waters 2695型高效液相色谱(HPLC)仪,美国 Waters 公司;Agilent 7890型气相色谱(GC)仪,美国Agilent 公司.
1.2 实验过程
1.2.1 生物质原料的制备
将1 kg竹子机械粉碎至小块状后投入到反应器中,加入150 g氧化镁粉末和5 kg水,密封反应器后通入氧气使反应器内气体初压达到1 MPa.将反应器加热至170 ℃并保温反应180 min.反应结束后,取出产物过滤并烘干得到固体竹浆(纤维素72.7%,半纤维素20.3%,木质素3.7%,灰分3.3%).
将1.9 t玉米秸秆原料、285 kg水和28 kg 93%(质量分数,下同)的硫酸加入反应器中,充入氮气调节反应器压力至0.95 MPa,在180 ℃下保温反应200 min.反应结束后,取固体残渣烘干得到糠醛渣(纤维素35.4%,半纤维素3.5%,木质素与腐殖质58.1%,灰分3.0%).
1.2.2 LA的制备
将50 g糠醛渣投入到反应釜中,并加入200 mL 3%稀硫酸,确认反应釜气密性良好并在220 ℃下保温反应60 min.待反应结束后,取出产物并过滤得到水解液,取样进行检测.将水解液稀释至200 mL并检测其pH值,然后将稀释后的水解液作为溶剂,再次向其投入等质量(50 g)的原料,在反应条件不变的情况下进行下一次水解实验,共投料5次.另外,为了验证补加硫酸的效果,取糠醛渣50 g或竹浆20 g作为原料在相同的反应条件下进行多次投料实验,但水解液稀释至200 mL后,加入一定量98%的硫酸调节水解液pH至0.34(与3%稀硫酸溶液相当),再进行后续的水解实验.
1.2.3 模拟水解液的配制与电渗析处理
分别配制LA水溶液(100 g/L)、LA-硫酸水溶液(LA 100 g/L,硫酸30 g/L)和LA-硫酸-FA水溶液(LA 100 g/L,硫酸30 g/L,FA 40 g/L).
将电渗析装置(图1)的工作电压和电流分别设为15 V和1.1 A,将均相分离膜堆安装紧密后,向A入口(电极液)中加入500 mL 5%(质量分数)的氯化钠溶液,然后分别将500 mL模拟水解液加入B入口(原料液),500 mL去离子水加入C入口(浓水),接通电源,等待液体循环稳定,并确定工作电压与工作电流是否正常.从电渗析装置正常运行时开始,每15 min 记录一次实验数据,包括原料液体积、浓水体积和电导率等,并从原料液与浓水中取一定量样品,检测其中LA、SO42-和FA的质量浓度.每组电渗析分离实验进行120 min.

图1 处理生物质水解液的电渗析装置Fig.1 Electrodialysis device for treating biomass hydrolysate
1.2.4 LA的提纯
将500 mL生物质水解液(LA 93.7 g/L,SO42-32.7 g/L,FA 35.7 g/L)作为原料液进行电渗析,反应时间为120 min并记录8次数据(每隔15 min记录一次数据).另取500 mL生物质水解液,电渗析60 min 后停止,从中取100 mL生物质水解液置于250 mL 的蒸馏烧瓶中,并使用旋转蒸发仪在80 ℃水浴温度以及90 kPa真空度的条件下除去其中的水与FA,得到的棕黑色浓缩液在170 ℃油浴温度以及99 kPa 真空度的条件下分离提纯LA,蒸馏烧瓶中的LA经过气化和冷凝过程最终从原体系中分离并且由冷凝管末端连接的25 mL烧瓶收集.待蒸馏过程结束,取出馏分称量并进行后续的定量检测.
1.2.5 成分检测
使用HPLC对生物质水解液、模拟水解液以及浓水中的LA和FA的质量浓度进行检测,具体条件为:Waters 2414示差折光检测器,Bio-Rad Aminex HPX-87H色谱柱,Empower TM 3工作站,流动相5 mmol/L稀硫酸,流动相流速0.6 mL/min,色谱柱温度60 ℃,检测器温度35 ℃,单次进样量10 μL.利用外标法绘制标准曲线后计算样品中LA和FA的质量浓度,再根据下式计算生物质水解过程中LA的收率:
(1)
式中:YLA为LA的收率;ρLA为测得的水解液中LA的质量浓度,g/L;V为水解液的体积,L;mcellu为原料中纤维素的质量,g;0.716为纤维素制备LA的理论最高质量收率.
各溶液中SO42-的质量浓度使用滴定法进行检测.具体步骤为:取5.00 mL样品,加入5 mL去离子水和20 mL乙醇,摇匀后加入5滴0.1%(质量分数)的偶氮氯膦Ⅲ水溶液作为指示剂,使用0.05 mol/L的氯化钡标准溶液滴定至溶液由紫红色变为稳定的蓝色.同时进行空白实验,并利用下式计算原溶液中SO42-的质量浓度:
(2)
式中:ρS为SO42-的质量浓度,g/L;cB为氯化钡溶液的实际浓度,mol/L;V1为滴定过程消耗氯化钡溶液的实际体积,mL;V0为空白实验消耗氯化钡溶液的实际体积,mL;MS为SO42-的摩尔质量,96.05 g/mol;V为样品的实际体积,mL.
利用GC对生物质水解液中分离提纯的LA产品进行定量分析,具体条件为:火焰离子化检测器(270 ℃),DB-INNOWAXETR色谱柱(30 m×0.25 mm×0.25 μm),载气为氮气,载气流速1.0 mL/min,初始柱温40 ℃,升温速率10 ℃/min,最终柱温度240 ℃,单次进样量1 μL.取1 g馏分,加入甲基异丁基酮定容至10 mL后取样检测,利用外标法计算样品中LA的质量浓度,并利用下式计算蒸馏提纯过程中LA的回收率和纯度:
(3)
(4)
式中:P为LA产品的纯度;ρ2为测得的样品中LA的质量浓度,g/L;ρ1为样品中馏分的实际质量浓度,g/L;R为生物质水解液蒸馏提纯过程中LA的回收率;m1为馏分的质量,g;m0为100 mL经电渗析处理后的水解液中LA的质量,g.
另外,为了减少误差,所有实验均在相同条件下进行重复,最终结果取3次实验的平均值.
2 结果与讨论
2.1 生物质水解制备LA
2.1.1 直接多次投料
在稀硫酸催化水解生物质的过程中,原料质量浓度是一个十分重要的参量.一般来说,较低的原料质量浓度有利于反应体系中传质过程的进行,进而得到较高的LA收率,但同时也将导致水解液中LA的质量浓度变低.因此,为了得到含高质量浓度LA的水解液,需要在单次实验中选取尽可能高的原料质量浓度,同时利用多次投料的方式,进一步提高整个反应过程中的原料质量浓度.以糠醛渣为原料直接多次投料水解制备LA的效果如表1所示,其中单次实验的原料质量浓度为250 g/L,水解过程中LA的收率基于已投入的原料总质量计算.可以看出:第1次水解过程中LA的收率仅为18.0%,这也证实了较高的原料质量浓度对水解反应的不利影响;而水解液中LA的质量浓度达到17.3 g/L,这意味着如果后续的水解过程中LA收率保持不变,那么总投料5次即可得到LA质量浓度超过86 g/L的水解液.第2次投料后,整体的LA收率基本不变,水解液中LA的质量浓度也达到第1次投料后水解液的2倍,这说明第2次投料的水解效果仍然比较明显.值得注意的是,水解液的pH随着投料次数的增加不断增大,这意味着反应过程消耗了大量的氢离子,而氢离子的不足会导致水解反应难以进行.当投料次数达到3时,LA的收率骤降至12.0%,水解液中LA的质量浓度也几乎没有增长,这说明第3次投料水解实验中几乎没有LA生成,而水解液的pH继续增大至0.74,验证了上述推测,即此时过低的氢离子浓度已经不足以支持水解反应的顺利进行.后续的第4和第5次投料实验均没有LA生成,而水解液的pH仍在不断地增大,因此可以认为保证多次投料实验顺利进行的关键在于维持一个较高的氢离子浓度.
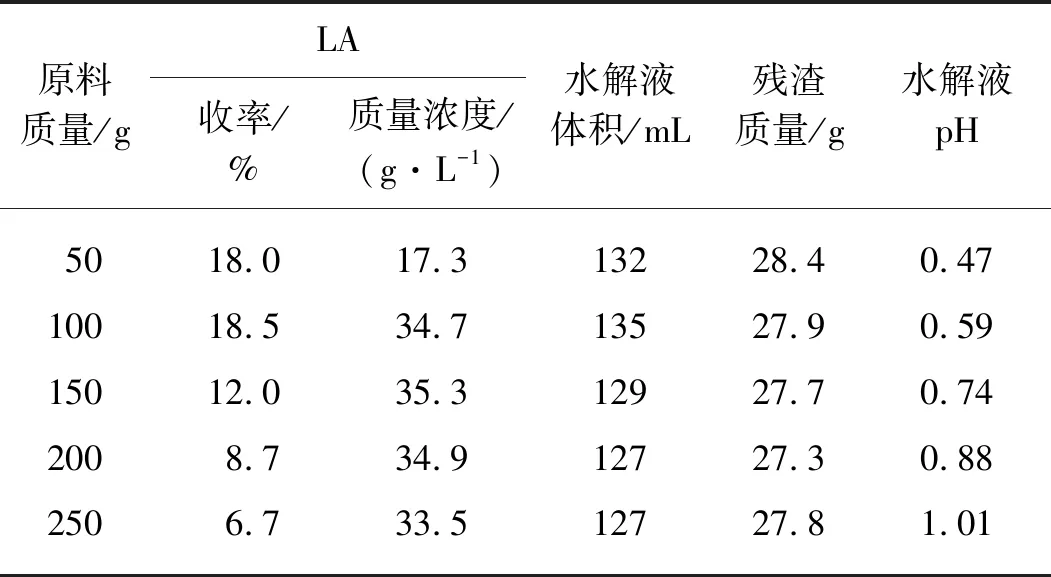
表1 多次投料水解糠醛渣制备LA
注:水解液pH在其稀释至200 mL后测得,下同.
2.1.2 多次投料并补加硫酸
为了补充反应中消耗的氢离子,在反应结束后向水解液中加入硫酸以维持反应前后溶液的pH基本相等.以糠醛渣为原料多次投料并且补加硫酸水解制备LA的结果如表2所示.通过与表1中的结果对比可以发现,补加硫酸后第2次投料的LA收率从18.5% 提高至20.0%,这说明在没有补加硫酸的实验中,尽管第2次投料有比较好的效果,但氢离子的减少仍导致LA的收率降低.通过补加硫酸维持水解液pH稳定在0.34左右,可以有效地控制其中的氢离子浓度.在后续的投料实验中,LA的收率稳定在20%以上,水解液中LA的质量浓度则不断增加,单次增幅约为20 g/L.因此,在5次投料后,整个过程中LA的收率为21.3%,水解液中LA的质量浓度为101.7 g/L,质量分数约为10%,达到较高的水平,对后续的分离提纯过程十分有利.另外,统计每次实验后水解液的体积以及残渣的质量可以发现,无论是否补加硫酸,反应结束后水相的体积均减少了约70 mL;没有补加硫酸时,每次投料实验的残渣质量均在28 g左右,而补加硫酸后,随着投料次数的增加,残渣的质量从28.4 g逐渐提高至35.5 g.

表2 多次投料并补加硫酸水解糠醛渣制备LA
验证了在多次投料过程中补加硫酸的可行性后,以竹浆为原料在相同反应条件下进行实验.由于竹浆的结构较为膨松,吸水性很强,原料质量浓度不宜过高,所以取原料质量浓度为100 g/L.如表3所示,竹浆多次投料并补加硫酸的水解效果同样良好,第1次水解实验中LA的收率超过40%,远高于糠醛渣的LA收率.在后续的投料实验中,尽管LA的收率缓慢降低,水解液中LA的质量浓度仍然不断增高,投料5次后,水解液中LA的质量分数超过8%,仍维持在较高的水平.总的来说,相对于糠醛渣,竹浆作为水解原料的优点较多,例如单次投料量少,LA收率高,残渣生成少等.另外,竹浆水解液的pH稳定在0.4附近,而糠醛渣水解液的pH则接近0.5,这意味着竹浆在水解过程中消耗的氢离子比糠醛渣少.

表3 多次投料并补加硫酸水解竹浆制备LA
2.2 电渗析处理模拟水解液
2.2.1 LA水溶液
LA属于相对较弱的电解质,在水溶液中会部分电离,因此,电渗析处理过程会对LA产生效果.利用电渗析法处理LA水溶液的实验结果,如表4所示:在电渗析过程中,原料液的体积不断减少而浓水体积不断增加,这是水循环的结果.原料液中LA的质量不断减少,平均减速约为0.25 g/min,浓水中LA的质量则不断增加,平均增速约为0.21 g/min,这说明在整个实验过程中,LA电离的阴阳离子会通过膜堆由原料液进入浓水;但LA在水溶液中的电离并不完全,因此原料液中的离子浓度不高,导致整体上LA的转移速度比较慢.另外,原料液和浓水中测得的LA总量随着实验的进行不断减少,最后稳定在44 g左右,这个过程中损失的LA(4.4 g)可能吸附在膜堆内部.
2.2.2 LA-硫酸水溶液
硫酸属于强电解质,因此在硫酸存在的情况下,电渗析过程首先会分离原料液中的SO42-,具体结果如表5所示.在初始60 min内,原料液中的SO42-质量不断减少,同时电导率也不断降低,当SO42-完全转移至浓水后,原料液的电导率为0,因此,可以通过电导率来直观判断原料中的SO42-是否被完全除去.另外,SO42-存在时,原料液中的LA仍然会缓慢地转移至浓水中;而当时间超过60 min后,SO42-被完全除去,此时实质上是电渗析处理LA水溶液的过程,LA的转移速度也增大到0.17 g/min左右;整个过程中有3.6 g的LA质量损失.
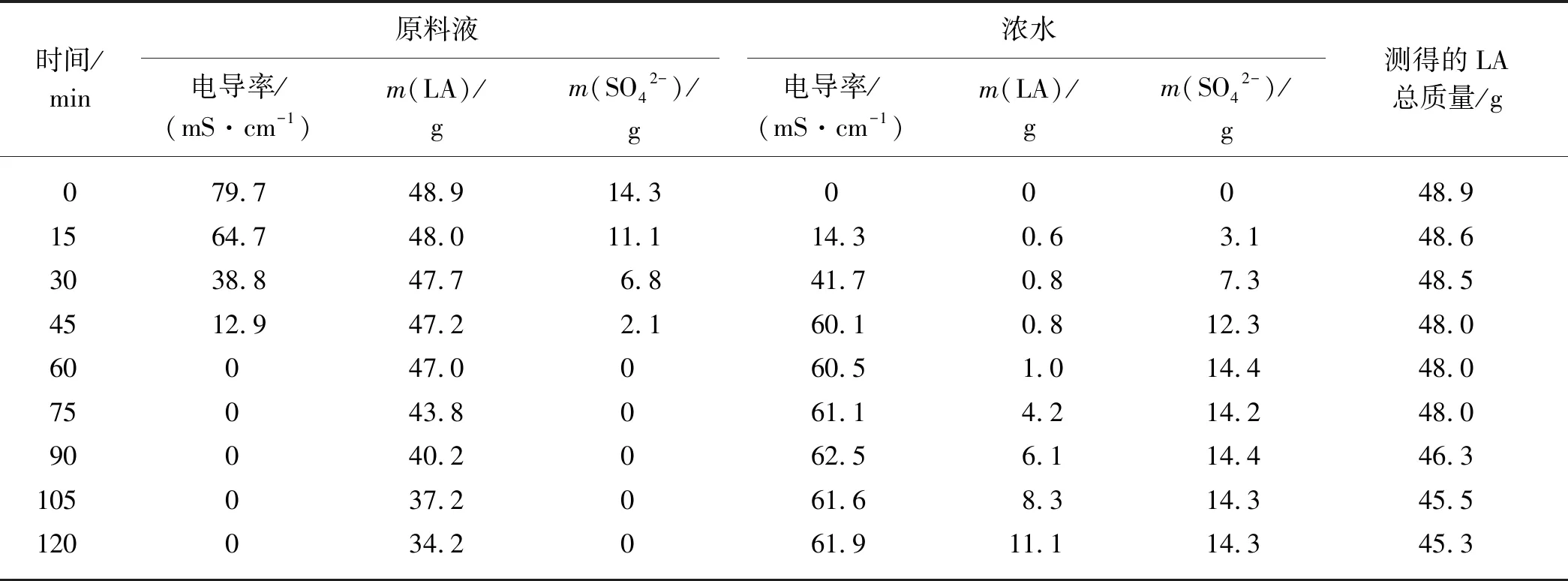
表5 电渗析法处理LA-硫酸水溶液
2.2.3 LA-硫酸-FA水溶液
LA-硫酸-FA水溶液的成分最接近真实的生物质水解液,其电渗析处理的结果如表6所示.在SO42-的分离过程中,LA和FA以较慢的速度转移至浓水中;而当SO42-完全分离后,LA和FA的转移速度均增大,并且没有明显的先后顺序,这说明在电渗析过程中,首先被分离的是原料液中的SO42-,随后LA与FA同时被分离.另外,由于后续蒸馏过程中,FA会与水同时被分离,对后续LA的提纯没有影响,所以电渗析过程只需要除去溶液中的SO42-即可.
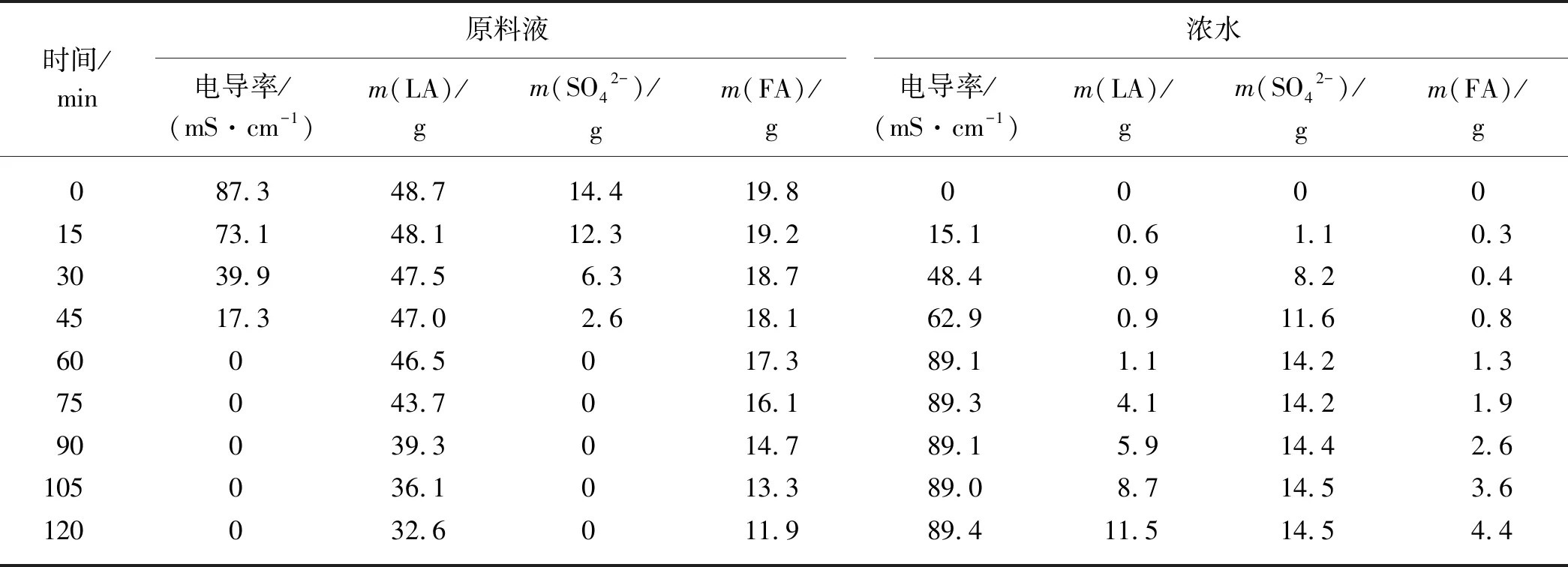
表6 电渗析法处理LA-硫酸-FA水溶液
2.3 从生物质水解液中提纯LA
对生物质水解液采用电渗析处理,分离其中的硫酸,结果如表7所示.根据模拟水解液的电渗析结果,当电渗析60 min后原料液中已不存在SO42-,继续进行电渗析会导致LA的大量损失,因此电渗析时间选择60 min为宜.取电渗析处理后的水解液进行蒸馏实验,利用旋转蒸发除去其中的水和FA等低沸点物质,再将浓缩液进行减压蒸馏,得到LA产品,经检测其纯度为94.7%,蒸馏过程中LA的回收率为91.2%.另外,电渗析过程会造成一定的LA损失,通过电渗析-蒸馏法处理生物质水解液的LA总回收率为87.1%.值得注意的是,电渗析过程结束后,蒸馏处理原料液可以分离LA,而浓水的主要成分是硫酸,可以利用浓水作为生物质水解的催化剂,从而重复利用分离的硫酸.实验证实,在相同的条件下以分离出的稀硫酸溶液水解竹浆制备LA的收率为43.7%,效果良好.
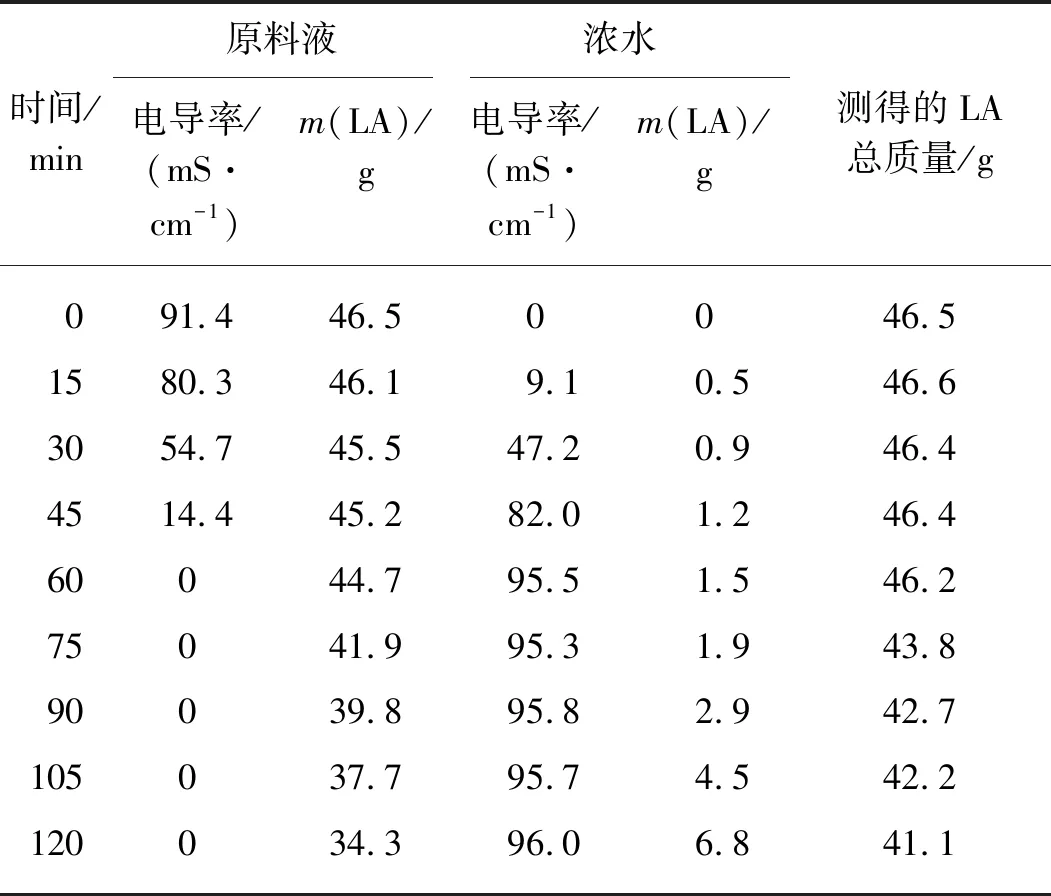
表7 电渗析法处理生物质水解液
3 结 论
生物质在稀硫酸体系下水解制备LA的过程会消耗溶液中的氢离子,导致后续多次投料水解过程难以顺利进行,而通过补加硫酸可以有效地维持水解液的pH.利用竹浆和糠醛渣均可以在投料5次并补加硫酸的条件下,得到质量分数为8%~10%的高浓度LA水解液,有利于后续LA的分离提纯.电渗析过程对LA、硫酸和FA均有分离效果,在硫酸存在时,电渗析过程主要分离SO42-,少量分离LA和FA;当原料液中硫酸被完全除去时,溶液电导率降为0,电渗析过程开始同时快速分离LA和FA.对生物质水解液进行电渗析处理除去SO42-,并使用旋转蒸发除去水和FA等低沸点物质后,再利用减压蒸馏法提纯LA,LA的总回收率为87.1%.另外,电渗析过程中分离得到的稀硫酸溶液可作为溶剂重复利用,以竹浆为原料进行水解反应时,LA的收率为43.7%.

