白藜芦醇对山羊冷冻精液质量的影响
吕春荣,李俊喜,Allai Larbi,权国波*
(1.云南省畜禽遗传资源保护和种质创新工程实验室,云南省肉羊工程技术研究中心,云南省畜牧兽医科学院,云南昆明 650224;2.禄丰县动物疫病预防控制中心,云南禄丰 651200)
精液冷冻保存对于山羊种质资源保护和人工授精技术推广具有非常重要的意义。众所周知,精子在冷冻过程中要面临冰晶机械损伤、低温冲击、渗透和化学毒性损伤、氧化损伤等问题,因此影响冻精质量的因素复杂,目前精子冷冻损伤机制尚不清楚。但普遍认为冷冻保存过程中冰晶的形成及氧化应激,特别是过量活性氧(Reactive Oxygen Species,ROS)的产生,是导致冻精质量下降的主要原因之一。ROS 在细胞信号传导中起重要作用[1],但超过生理水平的过量ROS 直接导致细胞氧化损伤[2],尤其是不饱和脂肪酸含量丰富的精子质膜更容易被ROS 攻击,造成过氧化损伤[3]。据报道,在稀释液中添加外源抗氧化剂可改善牛[4]、马[5]和山羊[6-7]精子冷冻解冻后的质量。
白藜芦醇早在1924 年就被发现,1974 年在葡萄属植物中找到该物质,并首先定性为是一种能自身产生抗逆性的物质[8]。白藜芦醇是一种天然的非黄酮类多酚类复合物,在抗炎、抗病毒、抗肿瘤和调节氧化还原信号等方面发挥重要作用,并可作为自由基的有效清除剂[9]。研究表明白藜芦醇可以显著提高家畜冻精品质[4-5,10-11]。本实验旨在研究白藜芦醇缓解山羊精子冷冻解冻过程中冷冻损伤的作用,进而改善山羊冻精的品质,为山羊冻精人工授精技术的推广奠定基础。
1 材料与方法
1.1 主要药品与试剂 实验所用化学试剂如无特殊说明均购自Sigma 公司。Optidyl 牛用稀释液购自法国IMV公司,Annexin V-FITC 细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司。
1.2 精液的采集及处理
1.2.1 精液采集和处理 精液采自昆明易兴恒畜牧科技有限责任公司8 只健康、成年(2~3 岁)云上黑山羊种公羊。采集好的精液马上进行质量评价,只有精液量为1~2 mL,最低精子密度达2.5×109/mL,精子活力在75%以上的精液才能用于冷冻保存。将符合标准的精液混匀后分为5 等份,与含不同浓度白藜芦醇(0、0.1、1、10、20 μmol/L)的稀释液混合均匀,最终调整精子密度为2×108/mL,其中不添加白藜芦醇为对照组。
1.2.2 冷冻和解冻 将稀释后的精液在冷库中平衡至5℃,然后将精液分装在冷冻细管中,在液氮蒸气中预冻10 min,预冻后直接将冷冻细管投入液氮中保存30 d。解冻时,细管在37℃水浴30 s 即可。
1.3 测定指标及方法
1.3.1 活力 用SCA 精液分析仪(Version 5.1;Microptic,Barcelona,Spain)检测精子总活力和直线运动百分率,每组至少分析500 个精子,具体操作参见仪器操作说明。
1.3.2 质膜完整性检测 采用低渗耐受性试验(HOST)检测精子质膜完整性。低渗溶液的配制:精确称取9 g 果糖和4.9 g 柠檬酸钠溶于1 000 mL 灭菌水。100 μL 低渗溶液中缓慢加入10 μL 精液混匀后在37℃水浴中孵育30 min。涂片在倒置显微镜下统计发生弯尾的精子数(图1)。精子质膜完整性=弯尾的精子数/400×100%。
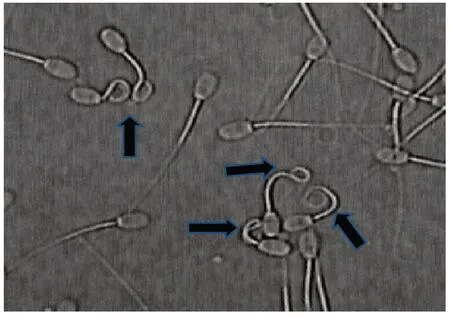
图1 精子HOST 检测
1.3.3 顶体完整性检测 用异硫氰酸荧光素(FITC)标记的豌豆凝集素(FITC-PSA)检测精子的顶体完整性。500 μL PBS 中加入5 μL 解冻后的精液混匀,而后加入5 μL FITC-PSA 混匀,在室温下避光孵育30 min 后进行流式检测。据荧光强度判断精子的顶体完整性,荧光强度越高说明精子的顶体完整性越好。
1.3.4 质膜磷脂酰丝氨酸分布检测 磷脂酰丝氨酸外翻是细胞早期凋亡的重要标志之一。本实验采用Annexin V-FITC 细胞凋亡检测试剂盒对解冻后精子细胞磷脂酰丝氨酸分布进行检测,Annexin V 可以特异性地标记磷脂酰丝氨酸,因此可以反映精子的凋亡状态。具体操作步骤参照说明书。精子经Annexin V-FITC 和碘化丙啶(PI)标记后分为4 个细胞亚群,如图2 所示,左下角细胞亚群代表正常精子(Annexin V 和 PI 均阴性);右下角细胞亚群代表早期凋亡细胞群(Annexin V 阳性,PI 阴性);左上角细胞亚群代表坏死细胞;右上角细胞亚群代表晚期凋亡细胞(Annexin V 和PI 阳性)。
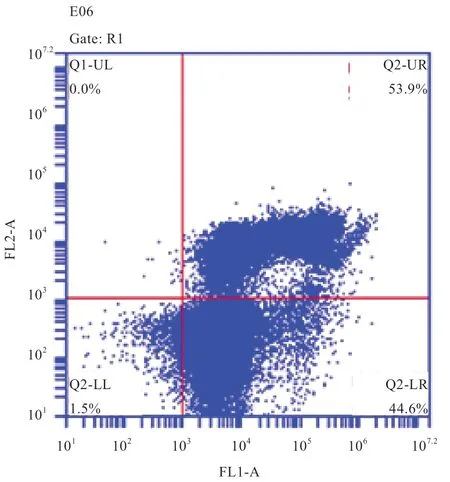
图2 质膜磷脂酰丝氨酸分布检测
1.3.5 ROS 检测 将500 μL 精液样品用TALP 液稀释至终浓度为1×106精子/mL,与0.5 μL 2,7-二氯二氢荧光素二乙酸酯(H2DCFDA)和50 μL PI(50 μg/mL)混合。H2DCFDA 终浓度为20 μmol/L。然后,将样品在室温下避光孵育60 min。采用流式细胞仪对精子进行分析。正常精子由于无活性氧产生,为H2DCFDA 和PI 阴性。
1.4 统计分析 将每次采集的精液混合以消除个体差异,本实验精液采自8 只不同种公羊。实验重复6次。采用SPSS 19.0 软件对数据进行单因素方差分析(LSD),数据用平均值± 标准差表示。P<0.05 或P<0.01 表示处理组间差异显著或极显著。
2 结果
2.1 白藜芦醇对山羊冻精活力的影响 如图3 所示,解冻后对照组冻精的精子活力与10 μmol/L 白藜芦醇冷冻组差异不显著,但这2 组高于20 μmol/L 白藜芦醇冷冻组(P<0.05)。10 μmol/L 白藜芦醇冷冻组的直线运动百分率高于其他各冷冻组(P<0.05),20 μmol/L 白藜芦醇冷冻组低于其他各处理组(P<0.05)。
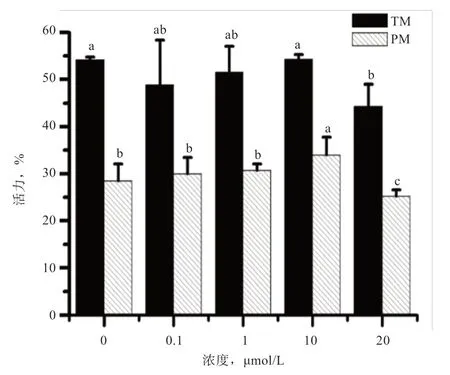
图3 白藜芦醇对山羊冷冻精子活力的影响
2.2 白藜芦醇对山羊冷冻精子质膜完整性的影响 如图4 所示,10 μmol/L 白藜芦醇冷冻组精子弯尾率为28.53%,高于其他各处理组(P<0.05),而其他各组间无显著差异。
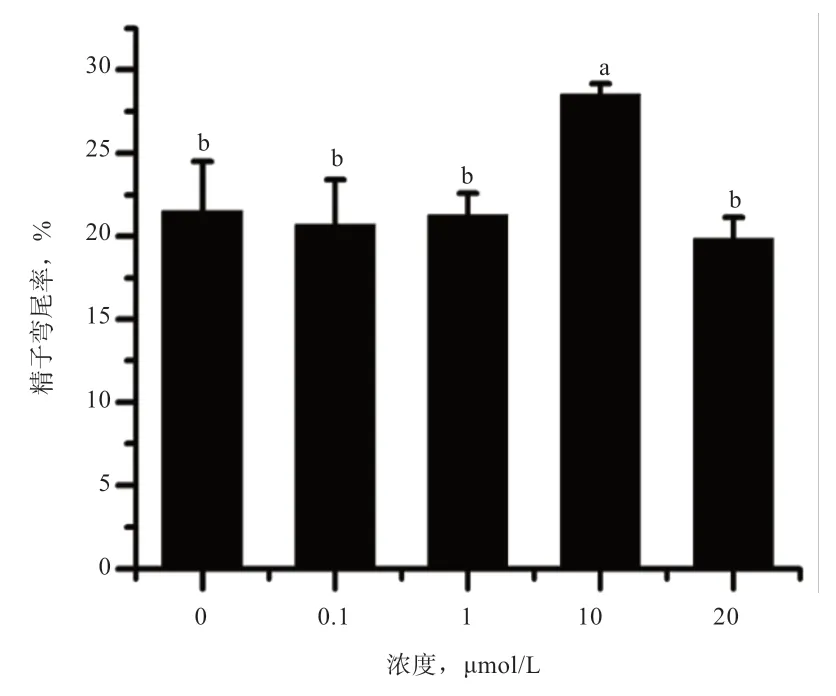
图4 白藜芦醇对山羊冷冻精子弯尾率的影响
2.3 白藜芦醇对山羊冻精顶体完整性的影响 如表1 所示,白藜芦醇不能改善解冻后山羊冻精的顶体完整性。本实验结果表明,尽管10 μmol/L 白藜芦醇冷冻组精子顶体完整性最高,为49.76%,但各处理组精子顶体完整性之间差异不显著。
2.4 白藜芦醇对山羊冻精磷脂酰丝氨酸分布的影响 本实验中,Annexin V 阳性细胞群代表磷脂酰丝氨酸外翻的细胞群。结果表明,解冻后早期凋亡细胞群很少,低于5%。大部分磷脂酰丝氨酸外翻的精子细胞集中于晚期凋亡亚群。然而,各处理组的磷脂酰丝氨酸标记率差异不显著(表2)。此外,添加白藜芦醇并不能显著提高精子的活率。

表1 白藜芦醇对山羊冷冻精子顶体完整性的影响
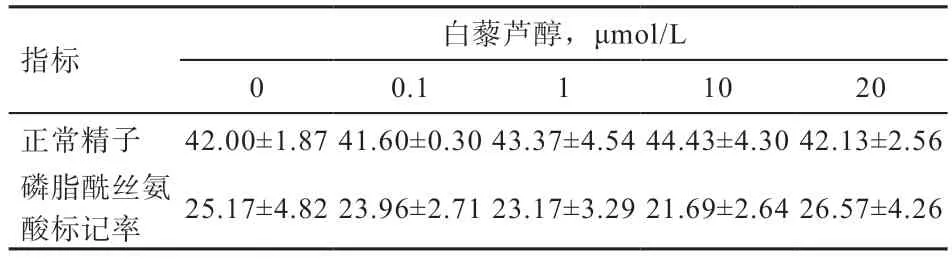
表2 白藜芦醇对山羊冷冻精子活率和磷脂酰丝氨酸分布的影响 %
2.5 白藜芦醇对山羊冻精ROS 的影响 图5 显示,当白藜芦醇浓度为10 μmol/L 时,ROS 阴性精子62.85%高于其他各组(P<0.05),而其他组间没有显著差异。
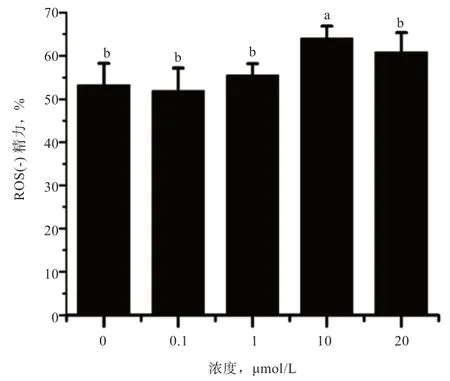
图5 白藜芦醇对山羊冷冻精子ROS 的影响
3 讨 论
由于目前的冻精制作技术所限,无法完全隔绝精子与空气的接触,这可能导致ROS 产生,进而对精子造成氧化损伤。此外,正常情况下,精液中的总抗氧化能力和抗氧化成分可以维持ROS 产生和降解的一种动态平衡。但在冻精制作过程中,由于需要添加稀释液而造成精液抗氧化成分浓度降低和总抗氧化能力降低,最终导致精子的氧化损伤。此外,精子质膜结构含有丰富的不饱和脂肪酸,这也导致其对脂质过氧化高度敏感[3]。脂质过氧化导致ROS 的形成,最终破坏精子的结构和功能。而在精液中添加一定的外源性抗氧化成分,如二丁基羟基甲苯(BHT)、维生素E,是降低精子氧化损伤的重要措施[12-13]。本实验中,在冷冻稀释液中添加白藜芦醇能够显著改善山羊冷冻精液的直线运动百分率和质膜完整性。同时,白藜芦醇可以抑制精子冷冻解冻过程中ROS 的生成,进一步证实白藜芦醇是通过其抗氧化作用改善冻精品质。
关于小鼠[14]、人[15]、牛[4,10]、羊[11]精子的研究表明,白藜芦醇可以有效保护精子免受冷冻或补充促氧化剂引起的氧化应激。本实验表明,与对照组相比,当冷冻稀释液中白藜芦醇浓度为10 μmol/L 时,解冻后精子的直线运动百分率显著高于对照组;但当白藜芦醇浓度提高至20 μmol/L 时,直线运动百分率呈下降趋势。对马精子[5]的研究表明,当白藜芦醇浓度为10 μmol/L 时,解冻后直线运动百分率显著高于对照组,而较高浓度(20 μmol/L)白藜芦醇对直线运动百分率有负作用,与本研究结果一致。本研究中,20 μmol/L 白藜芦醇组精子活力显著低于对照组和10 μmol/L 白藜芦醇组,20 μmol/L 白藜芦醇组的直线运动百分率显著低于其他各处理组,说明高浓度白藜芦醇(20 μmol/L)对精子的活力和直线运动速率有抑制作用。还有研究表明,当白藜芦醇浓度过高(66 μmol/L 或100 μmol/L)时,对猪精子运动有抑制作用[16]。不同研究结果的白藜芦醇高浓度值不同,可能是不同物种精子对白藜芦醇的敏感性不同或者稀释液成分不同造成的。此外,白藜芦醇对冻精活力的改善效果可以通过其降低ROS 生成的作用来解释[10]。有研究证实,通过添加外源性抗氧化剂可有效抑制ROS 产生,从而保护精子的结构和功能,提高精子的受精能力[17]。本研究发现,当白藜芦醇浓度为10 μmol/L 时,ROS 阴性的精子百分率显著高于其他各组。另外,10 μmol/L 白藜芦醇显著提高冷冻精子的低渗耐受性,这表明白藜芦醇可以显著提高解冻后精子质膜的结构和功能完整性。在马上的研究也得到证实[5]。
本研究也表明,过高浓度的白藜芦醇可能对精子产生细胞毒性作用,最终导致其精子活力和质膜完整性下降,但原因尚不清楚。顶体是精子特有的结构之一,富含各种水解酶类,受精过程中顶体反应是精卵结合的前提条件。在本研究中,白藜芦醇并不能改善冻精的顶体完整性,这与人[11]的研究结果不同,原因可能与精液来源和冷冻解冻流程不同有关。此外,高浓度的抗氧化剂可能破坏精子顶体和膜的功能完整性[6]。根据目前的报道,精子的低渗耐受性可能和其受精能力相关[18]。在猪上,尽管白藜芦醇对精子活率和质膜完整性无影响,但能显著提高其体外受精率[19]。尽管本研究证实白藜芦醇可以显著提高冻精的低渗耐受性,但由于并未进行体外受精或人工授精实验,关于白藜芦醇是否可以改善冻精的受精能力尚有待进一步研究。
4 结 论
白藜芦醇可有效提高山羊精子对冷冻损伤的耐受性,而且其保护效果呈明显的剂量依赖性。随着白藜芦醇浓度的升高,其直线运动速率、质膜完整性和ROS阴性精子百分率呈先上升而后下降的趋势。白藜芦醇对精子的冷冻保护作用可能与其抑制ROS 产生有关。但过高浓度的白藜芦醇不能缓解冷冻解冻过程对精子的冷冻损伤,推测白藜芦醇浓度过高可能对精子产生细胞毒性作用。另外,白藜芦醇能否改善山羊冻精人工授精效果仍需要进一步研究。

