不同产奶量和乳蛋白率奶牛的血液生化和激素水平分析
武雪会,孙会增,王迪铭,薛茗元,刘建新
(浙江大学动物科学学院,浙江杭州 310058)
产奶量(Milk Yield,MY)和乳蛋白率(Milk Protein Content,MP)是衡量奶牛泌乳性能的重要指标,直接影响奶业利润。以往多从育种、营养和管理角度研究如何提高奶牛的泌乳性能[1],而从奶牛自身生理代谢角度的研究较少。血液生化指标可反映奶牛的能量代谢状态和生理变化[2],与泌乳性能密切相关[3]。据报道,泌乳前期血中非酯化脂肪酸(Non-esterified Fatty Acids,NEFA)和血尿素氮与MY 显著正相关,血钙与MY 显著负相关;泌乳中后期血尿素氮与MP 显著负相关[3]。但上述研究检测指标少(NFEA、血尿素氮、钙、磷和碱性磷酸酶),不能满足对奶牛系统性生理研究的需要。一直以来,激素对奶牛泌乳性能的研究多通过体外细胞试验或外源激素在体试验进行探究[4],缺乏正常生理状态下奶牛自身分泌激素的调控作用研究。Fiore 等[5]报道,围产期和泌乳早期的水牛,MY 与胰岛素、甲状腺刺激激素显著正相关。但上述研究围绕水牛的特殊生理阶段,忽略了平稳生理阶段(泌乳中期)激素对泌乳的调控。
为研究奶牛自身生理代谢对MY、MP 的影响,本研究在排除奶牛品种、日粮、管理等因素的前提下,以高低MY、MP 的泌乳中期荷斯坦奶牛为研究对象,分析其血液生化指标和激素水平,进一步结合大群奶牛(n=287)进行关联分析,为深入挖掘与奶牛MY 或MP 有关的生理代谢机制提供指导。
1 材料与方法
1.1 试验动物与饲养管理 试验动物为选自杭江奶牛场的287 头健康、体况良好的经产泌乳中期荷斯坦奶牛,日粮、管理条件一致。奶牛采用栓系式饲养,牛棚通风良好,管道式挤奶。以全混合日粮饲喂,日粮精粗比为57∶43,分别在06:30、14:00、20:00 饲喂和挤奶各3 次,自由饮水。试验日粮组成及营养成分见表1。
1.2 试验设计 以287 头荷斯坦奶牛为对象,选取极高、极低MY 牛各20 头,分别设为高MY 组和低MY 组,2 组间乳成分、胎次和泌乳天数差异不显著(表2);选取极高、极低MP 牛各20 头,分别设为高MP 组和低MP 组,2 组间的产奶量、其他乳成分、胎次和泌乳天数差异不显著(表3),分析2 组牛的血液生化指标和血清激素水平差异。以287 头奶牛的试验数据为对象,进行血液生化指标、激素指标与奶牛MY、MP 的关联分析。

表1 试验日粮组成及营养成分(干物质基础)
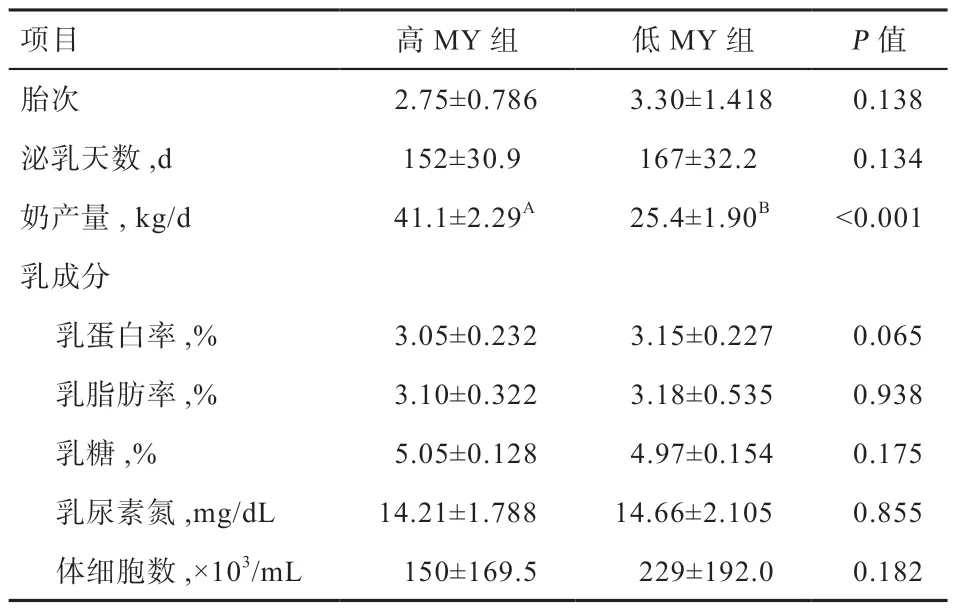
表2 高、低MY 奶牛的奶产量和乳成分(平均值±标准差)
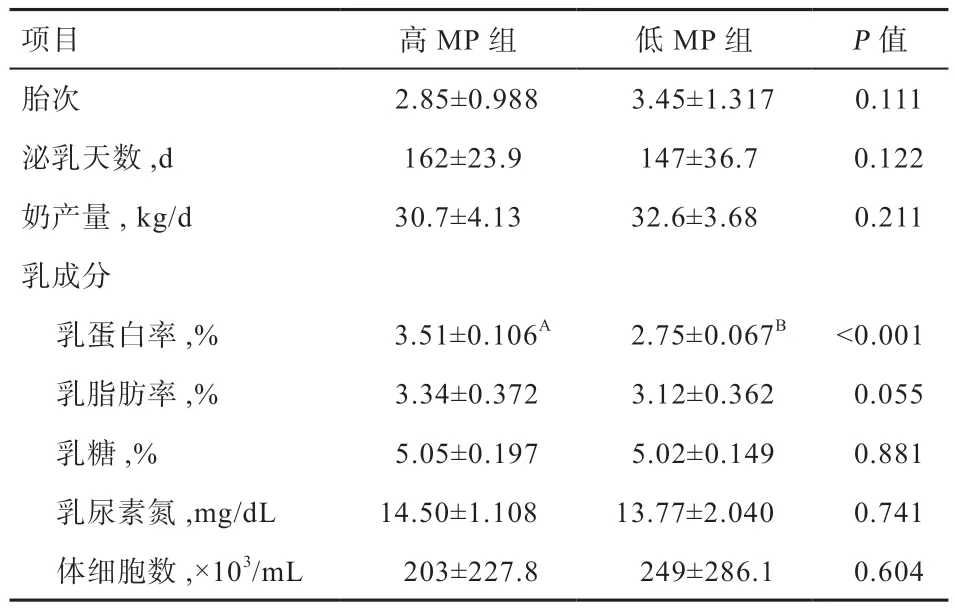
表3 高、低MP 奶牛的奶产量和乳成分(平均值±标准差)
1.3 样品采集 于早晚饲喂前(05:30、19:00)采集饲料样约500 g,置于自封袋并做好标记,冻存于-20℃用于日粮营养组成测定。使用连接有采样器的挤奶器(WAIKATO,新西兰)测定奶牛的产奶量,每头牛使用离心管采集奶样50 mL,按照早∶中∶晚为4∶3∶3 的比例混匀,采样前离心管中添加防腐剂(万分之六重铬酸钾),置于4℃用于乳成分测定。晨饲前(04:00—06:00)使用加有促凝剂的血清管采集颈静脉血10 mL,置于冰上静置分层后,立即在4℃下,3 000×g 离心15 min得到血清,分装后冻存于-80℃,用于测定血液生化指标和血清激素。
1.4 测定指标与方法
1.4.1 饲料常规营养成分 采集的饲料样称重取500 g,于65℃下烘48 h,回潮称重后粉碎,先后过2 mm 筛和1 mm 筛,自封袋封装并做好标记,置于4℃。按照AOAC 方法[7]测定干物质(105℃,5 h)、粗蛋白质(988.05)、粗脂肪(920.39)、酸性洗涤纤维(973.18)、钙和磷含量,并分析中性洗涤纤维含量[8]。
1.4.2 产奶量和乳成分 采样前两天和采样当天测定产奶量,取平均值用于后续分析。利用红外线法[9](Foss-4000;Foss 公司,丹麦)测定乳蛋白、乳脂、乳糖、乳尿素氮、总固形物含量和体细胞数。
1.4.3 血液生化指标 取500 μL 血清,进行分析。使用UNICO 7200 可见分光光度计(尤尼柯(上海)仪器有限公司)测定吸光度,计算血尿素氮、总蛋白、白蛋白、血糖、NEFA、β-羟基丁酸、肌酐、丙二醛浓度;超氧化物歧化酶酶活测定以每毫升反应液中超氧化物歧化酶抑制率达50%时所对应的量为1 个酶活力单位;谷胱甘肽过氧化物酶酶活以每0.1 mL 血清在37℃反应5 min,扣除非酶促反应作用,使反应体系中谷胱甘肽浓度降低1 μmol/L 为1 个酶活力单位;总抗氧化能力以37℃时,每分钟每毫升血清使反应体系的吸光度值增加0.01 时,为1 个总抗氧化能力单位。使用DG5033A 酶标仪(南京华东电子集团医疗设备有限公司)在510 nm 处测定吸光度,配合相应的比色试剂盒(南京建成生物工程研究所)计算总胆固醇(Total Cholesterol,TCH)和甘油三酯浓度。
1.4.4 血清激素 取500 μL 血清,使用DG5033A 酶标仪配合相应的比色试剂盒(江苏酶标生物科技有限公司)应用双抗体夹心法分别在450 nm 处测定吸光度,通过标准曲线计算血清中的胰岛素、胰高血糖素、胰岛素样生长因子-1(Insulin-like Growth Factor-1,IGF-1)、皮质醇、胃饥饿素和瘦素浓度,根据公式计算胰岛素敏感性指数(the Revised Quantitative Insulin Sensitivity Check Index,RQUICKI)[10]:
RQUICKI=1/[log 血糖(mg/dL)+log 胰岛素(μU/mL)+log 非酯化脂肪酸(mmol/L)]
1.5 统计分析 试验数据用Excel 2013 初步统计后,采用SAS 9.2(SAS Institute,2000)中的MIXED 模型,将分组作为固定效应,对胎次、泌乳天数进行单因素方差分析;同样采用MIXED 模型将分组、胎次、泌乳天数作为固定效应对奶产量、乳成分、血液生化参数和激素指标进行三因素方差分析,结果以平均值± 标准差表示;表格中仅列出分组因素(主效应)的显著性检验结果(P值);统计差异性定义为P<0.05,极显著差异定义为P<0.01,差异趋势定义为0.05<P<0.01。应用R 3.5.1 进行Spearman 关联分析,显著关联定义为P<0.05,极显著关联定义为P<0.01。
2 结果
2.1 高低MY 牛的血液生化参数和激素水平 高低MY牛的产奶量分别为41.1 kg/d 和25.4 kg/d(P<0.01)(表2)。由表4 可知,高MY 牛的血尿素氮浓度低于低MY 牛(P<0.01),而血清总蛋白(P<0.05)、白蛋白(P<0.05)和TCH(P<0.01)浓度高于低MY 牛,其他血液生化参数在2 组间不存在显著差异。由表5 可知,高MY 组的胰高血糖素(P<0.01)、IGF-1(P<0.05)和瘦素(P<0.05)浓度低于低产MY 牛,其他激素在2组间不存在显著差异。
2.2 高低MP 奶牛的血液生化参数和激素水平 高低MP组的MP 分别为3.51% 和2.75%(P<0.01)(表3)。分析发现,高MP 牛的血尿素氮(P<0.05)和白蛋白(P<0.05)浓度高于低MP 牛,其他血液生化指标在2组间无显著差异(表6)。由表7 可见,高、低MP 奶牛的激素水平无显著差异。
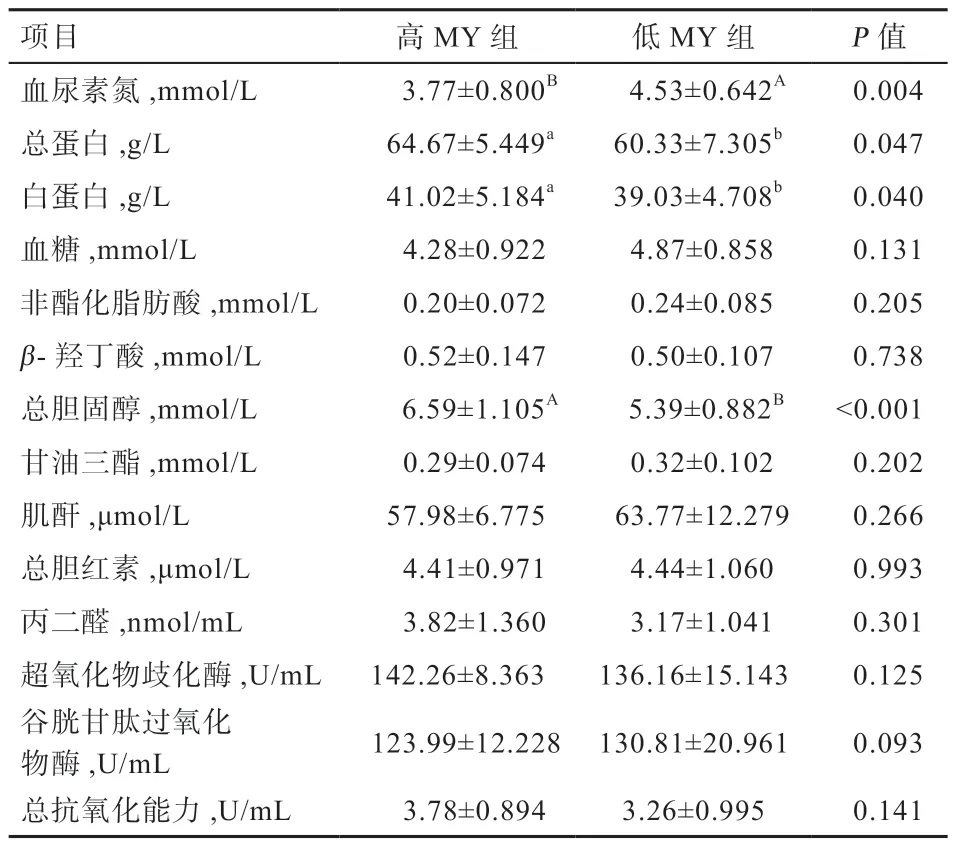
表4 高、低MY 奶牛的血液生化参数
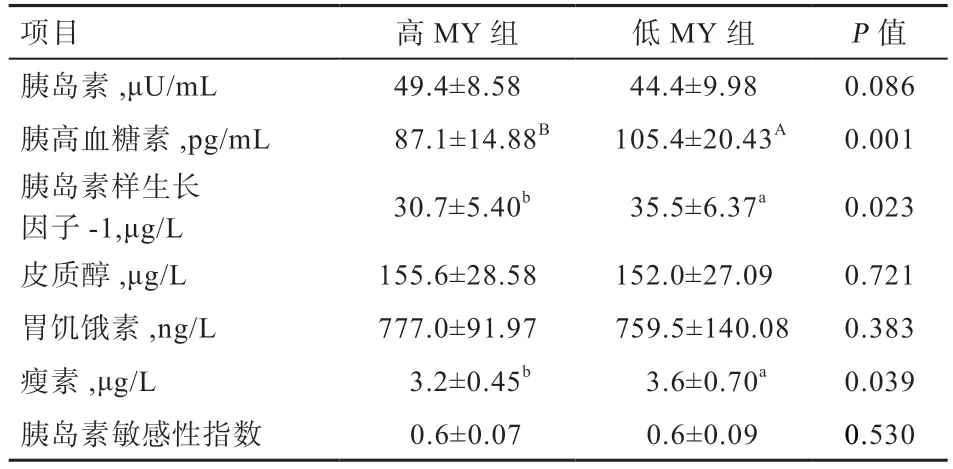
表5 高、低MY 奶牛的激素水平

表6 高、低MP 奶牛的血液生化参数

表7 高、低MP 奶牛的血清激素水平
2.3 奶牛MY 和MP 与差异血液生化参数和激素的关联分析 由表8 可知,高低MY 组的血液生化指标中,总胆固醇(r=0.357)、丙二醛(r=0.211)、总抗氧化能力(r=0.153)与MY 正相关(P<0.01),血糖(r=-0.211,P<0.01)、血尿素氮(r=-0.147,P<0.05)、肌酐(r=-0.146,P<0.05)与MY 负相关。高低MP 牛的血液生化指标中,血糖(r=0.153,P<0.01)、肌酐(r=0.228,P<0.01)、总胆红素(r=0.199,P<0.01)、血尿素氮(r=0.125,P<0.05)与MP 正相关,总蛋白与MP 负相关(r=-0.201,P<0.01)。其他血液生化指标、所有的检测激素与MY、MP 均不存在显著相关性,未列入表8。
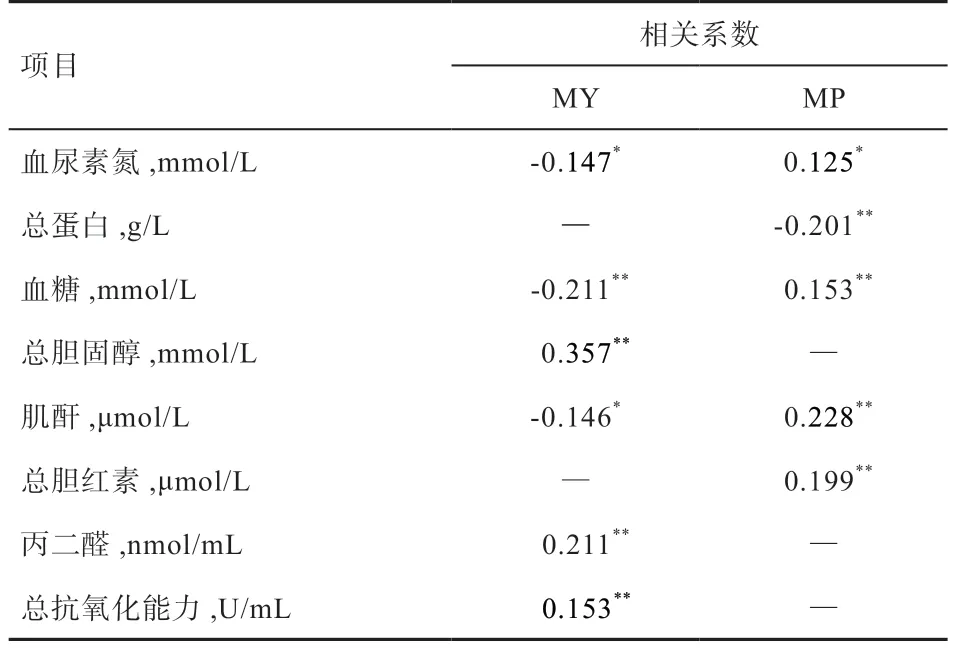
表8 287 头奶牛MY、MP 与血液生化参数的关联分
3 讨 论
3.1 影响奶牛MY 的血液生化参数和激素水平 本研究中血尿素氮和总胆固醇在高低MY 组间存在显著差异,同时经扩群关联分析显示与奶牛MY 显著相关,而且差异分析和关联分析的结果趋势一致。血尿素氮在高、低MY 牛的差异趋势与Ahn 等[11]报道的结论相反。血尿素氮作为评价奶牛蛋白代谢状态的指标,受日粮蛋白质含量与氨基酸组成、瘤胃降解能力、肝肾功能、肌肉代谢的影响[2]。本研究所有试验牛饲喂相同日粮,而且高、低MY 组奶牛的MP 无显著差异,提示低MY 牛可能具备较高的瘤胃降解蛋白能力,产生过量的氨未被利用合成更多的微生物蛋白(Microbial Protein,MCP),而是通过肝脏解毒转变为尿素进入到血液,造成血尿素氮浓度显著高于高MY 牛。总胆固醇是衡量奶牛能量状态的指标[2],与脂质动员供能有关。奶牛机体首先利用血糖为泌乳供能,而高MY 牛需要更多的能量维持泌乳,容易造成血糖供应不足(高MY 牛体内血糖浓度数值上低于低MY 牛),进而促发机体脂质动员,造成高MY牛总胆固醇浓度显著高于低MY 牛。另一方面,总胆固醇参与类固醇激素的生物合成[12],但本研究中皮质醇作为固醇类激素,在2 组奶牛间不存在显著差异,间接证明了2 组牛血清总胆固醇的差异主要与脂质动员供能有关。
此外,血清总蛋白在高、低MY 组的差异趋势与Pazzola 等[13]的报道一致。Nozad 等[14]报道,血清肌酐水平可用于预测奶牛MY 和乳品质,证实了肌酐与奶牛MY 存在相关性。丙二醛作为体内自由基作用下脂质过氧化的终产物,常被用作反映机体不同程度氧化应激的生物标记物[15],总抗氧化能力则反映机体总体的抗氧化水平;二者与奶牛MY 极显著正相关可能提示随奶牛MY 增加,机体泌乳应激水平上升。
本研究中,高MY 组的胰高血糖素、胰岛素样生长因子-1 和瘦素浓度显著高于低MY 组,但扩群关联分析显示上述激素与奶牛的MY 相关性不显著,提示单一激素在调控或反映奶牛MY 上可能存在一定局限性。胰高血糖素由胰岛α细胞分泌,作用于肝细胞促进糖原分解和糖异生以升高血糖。Bobe 等[16]报道,静脉灌注胰高血糖素有降低奶牛MY 的趋势,这与本研究中低MY 牛的胰高血糖素浓度高于高MY 牛的趋势一致。本研究中高MY 组的胰岛素显著高于低MY 组,结合其较低的胰高血糖素水平,提示高MY 牛体内葡萄糖代谢以分解代谢为主,大量葡萄糖分解为泌乳供能,这与其血清中较低的血糖水平相符。胰岛素样生长因子-1 主要由肝脏合成,其在血清中的浓度可以直接反映乳腺组织的营养供应状态[17]。本研究中高MY 牛的胰岛素样生长因子-1 浓度显著低于低MY 牛,究其原因,IGF-1通过抑制生长激素的释放减少营养物质向泌乳的分配,进而造成MY 下降[18]。瘦素主要由脂肪组织分泌,进入血液循环后参与糖、脂及能量代谢的调节,降低采食量和体内脂肪沉积,维持能量平衡,并具备调控繁育(黄体活动、发情)、激活免疫细胞、调控乳腺发育和功能等作用[19]。Liefers 等[20]报道,泌乳期内高MY 牛多处于能量负平衡,其血清瘦素浓度低于能量正平衡的牛。本研究中高MY 牛的瘦素浓度显著低于低MY 牛,反映了高MY 牛对养分的需求更高;高MY 牛的高血清总胆固醇浓度证实了其需要动员体脂供能。
3.2 影响奶牛乳蛋白合成的血液生化参数和激素水平本研究4 个与蛋白代谢有关的血液生化指标中,血尿素氮和白蛋白在2 组间存在显著差异;同时血尿素氮和肌酐浓度与MP 显著正相关,与Nozad 等[14]的研究结果一致。饲喂相同日粮条件下,高MP 组血尿素氮浓度高可能与瘤胃降解蛋白速度超出了瘤胃MCP 的合成速度,促发肝脏合成尿素能力升高有关。白蛋白主要由肝脏合成,是一种负的急性期蛋白,当营养不良、肝肾发生炎症或感染性疾病时,其浓度下降[21]。Bobbo 等[22]报道,血清白蛋白水平与乳中体细胞数呈反比,将其作为乳腺感染或乳腺发生免疫反应的指征物。另有研究发现,奶牛血清白蛋白是血液中类固醇、脂肪酸和甲状腺激素的运输载体[23]。因此,高MP 牛体内较高的白蛋白水平可能有助于脂肪酸转运供能,并促进激素转运至靶器官发挥调控作用。肌酐是肌肉肌酸的代谢产物,可被瘤胃微生物利用合成MCP(乳蛋白前体物)[2],因此高的血清肌酐水平可能会间接提高牛奶的MP,证实了本研究中血清肌酐水平与MP 的正相关关系,同时与Nozad等[14]的研究结果一致。另有研究报道,母羊营养供给不足时,肌肉大量代谢以维持机体能量稳态,提高血糖和肌酐水平[24]。本研究中肌酐和血糖水平与奶牛MP呈显著正相关关系,提示机体可能通过提高肌肉代谢为MP 合成提供间接底物和能量底物(血糖)。
本研究发现,在相同的日粮、管理和品种条件下,奶牛自身生理代谢的不同是造成其泌乳性能(MY、MP)差异的重要原因,血尿素氮与MY 显著负相关,与MP 显著正相关;总胆固醇与MY 极显著正相关,可作为潜在的生理标记物。张辉等[3]报道,血液生化指标与泌乳性能的相关性与泌乳阶段有关,并且二者的相关性在泌乳中后期较弱,这与本研究中相关系数较低的结果一致,提示后续试验或需借助代谢组学等手段,挖掘与奶牛MY 或MP 相关性更为显著的代谢标志物;同时可开展不同泌乳阶段的研究,挖掘具有普适性地能够反映奶牛MY 或MP 的血液生理标志物。
4 结 论
在相同的日粮和管理条件下,高MP 和低MP 组在血尿素氮、白蛋白浓度上存在显著差异,提示其在氮代谢效率上的差异;而胰高血糖素、IGF-1 和瘦素浓度等参数的差异表明激素调控介导的糖代谢和能量供应是造成奶牛产奶量不同的生理原因。血尿素氮与MY 显著负相关,与MP 显著正相关;总胆固醇与MY 呈极显著正相关,可作为潜在的生理标记物。

