白三烯类成分在动脉粥样硬化中的研究进展
黄家欣 田 稷 倪 维 都文文 黄荣增 宋成武 谢 云 金姝娜
1.湖北中医药大学药学院,湖北武汉 430065;2.湖北省中医院检验科,湖北武汉 430060;3.河南省焦作市人民医院药剂科,河南焦作 454000;4.华中科技大学公共卫生学院,湖北武汉 430030
Feldberg 和Kellaway[1]于1938~1940 年首次发现白三烯C 化合物(leukotriene C,LTC),称其为“缓慢的平滑肌刺激物质”。随后由瑞典学家Bengt Samuelsson[2]于1979 年命名为“白三烯”,其名称来源于“白血球”和“三烯”。以往的综述仅基于LTs 某一类化合物或相关联的某一种疾病进行讲解,现通过PubMed 和Web of Science 等网上资料库评估现有动物实验和人体临床研究文献中LTs 和该类疾病之间的相关性,总结在相应部位测量白三烯含量可用于相关疾病的病情监测及治疗方案的调整,同时确定白三烯拮抗剂和白三烯受体拮抗剂在相关疾病治疗中的关系,为基于LTs 疾病生物标志物的筛选及其应用于临床靶向新型治疗方案的研究提供参考,提高未来药物治疗的优质选择。
1 LTs 存在形式及代谢途径
1.1 存在形式
白三烯类成分(LTs)以一条具有四对双键的二十碳长链为结构特征,其中三对共轭。该类成分由炎症细胞分泌,如中性粒细胞、巨噬细胞等,在体内主要有A4、B4、C4、D4、E4、F4 六种主要存在形式。LTs 半衰期短,在体内代谢快,主要通过胆汁、尿液排出。其中LTA4 是白三烯体系中最不稳定的成分,常被LTA4 水解酶(leukotriene A4 hydrolase,LTA4H)、LTC4 合成酶(leukotriene C4 synthetase,LTC4S)迅速氧化成LTB4、LTC4,研究较少。LTB4 具有较强的白细胞趋化作用及免疫调节作用,属于白三烯二羟酸类。LTC4、LTD4、LTE4、LTF4 属于半胱氨酰白三烯类(Cys-LTs)[3],其特征是化学结构C6 位上均有一个硫醚连接的肽,需要通过与激活的半胱氨酰白三烯受体(cysteinyl leukotrienes receptor,Cys-LTR)结合产生活性,能诱导正常外周血液中白细胞;LTC4 与LTE4 结构相似,由β1 和β2 整合素与内皮细胞表面结合,刺激嗜酸性粒细胞分泌而来;LTD4 由外周血嗜酸性粒细胞经白三烯D4 合成酶(leukotriene D4 synthetase,LTD4S)或γ-谷酰基转移酶(γ-glutamyl transpeptidase,γ-GT)代谢生产,和LTF4 一样都是LTC4 的代谢产物,其中LTD4 脱掉的为谷胱甘肽的谷氨酸残基,而LTF4 结构中缺失的是谷胱甘肽的甘氨酸残基[4]。6 种白三烯化学结构见图1。
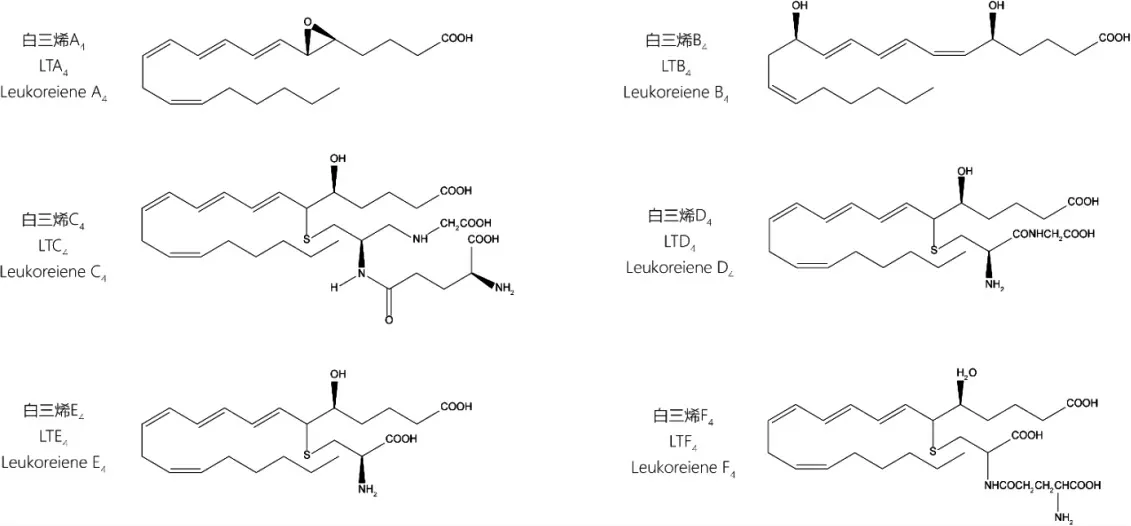
图1 白三烯类成分LTA4、LTB4、LTC4、LTD4、LTE4、LTF4 化学结构式
1.2 代谢途径
LTs 生物合成启动需要抗原与肥大细胞表面IgE受体相互作用,免疫反应过程中,接触变应原后产生的炎性反应能刺激并激活嗜曙红细胞等炎症细胞细胞膜、核膜磷脂双分子层上的膜磷脂或甘油二酯经磷脂酶A2(phospholipase A2,PLA2)释放AA[5-7]。AA 存在两条代谢途径:①环氧化酶(cyclooxygenase,COX)途径,生成前列腺素类[8];②脂氧合酶途径,5-LO 代谢生成5-氢化氧化二十碳四烯酸和LTA4[9]。之后,部分LTA4 被LTA4H(有环氧化物水解酶、氨肽酶双重活性[10],是水解LTA4 产生LTB4 的关键酶[11])转化为LTB4 和水,再通过LTC4S 和谷胱甘肽作用生成LTC4,再经γ-GT 脱去谷氨酸生成LTD4,LTD4 在二肽酶参与转换下生成LTE4[12-13]。其代谢途径见图2。
2 LTs 受体
LTs 受体分为两大亚型:LTB4 受体(BLT)和Cys-LTR,可再细分成BLT1、BLT2、Cys-LT1R 和Cys-LT2R四个小亚型[14]。其中LTB4 的受体BLT1 与其亲和力较高,主要介导化学诱导和炎性反应,常在白细胞中表达;而BLT2 与LTB4 亲和力低,几乎遍布于全身各个组织,作用尚不明确[15]。Cys-LT1R 主要分布于血管壁,可识别LTC4、LTD4、LTE4(与受体结合能力的顺序为:LTD4>LTC4>LTE4),因其广泛分布于巨噬细胞、嗜酸性粒细胞、肥大细胞等[16-17],成为治疗LTs 疾病药物的首要作用靶点;Cys-LT2R 也可识别LTC4、LTD4、LTE4(与受体结合能力的顺序为:LTD4=LTC4>LTE4),在炎症、血管通透性、组织纤维化中起重要作用。
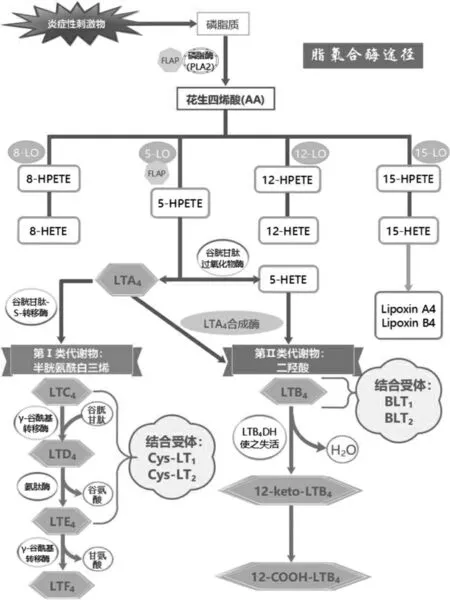
图2 白三烯脂氧合酶途径代谢过程及其产物
3 LTs 与AS 的相关性
3.1 AS 简介
高脂血症(HL)是脂代谢异常最为相关的疾病,作为AS 早期症状,临床表现为血清总胆固醇、三酰甘油、低密度脂蛋白的异常升高。降血脂药物他汀类通常用于治疗HL,使用后可使大多数人血清总胆固醇降低约50%[18],但对于有HL 病症而无其他健康问题的患者来说是否有效,存在着争议。因此,与脂质代谢密切相关的AA 代谢途径及其相关代谢产物成为新的研究重点之一。研究表明,高胆固醇血症可引起中性粒细胞数量增多,随即产生脂质介质,如强化学趋化剂LTB4,通过自分泌方式增加中性粒细胞的动能和数量,其合成取决于其产生途径的游离花生四烯酸含量和可用性及5-LO 亚细胞定位:中性粒细胞休眠时,5-LO 位于细胞质中,一旦被激活,5-LO 会重新分配到核膜上,启动LTB4 的生物合成,由其C-末端催化区域(p-5-LO)通过细胞膜外信号调节激酶(extracellular signal regulated kinases,ERKs)介导进行[19]。HL 早期ERKs 增加中性粒细胞中LTB4 的生成,中后期将引起器官功能性褪变,加重血管负担,从而诱发AS[20]。
3.2 LTs 参与AS 的途径
由近几年文献,此文总结出四大途径,具体途径及其参与物质见图3。
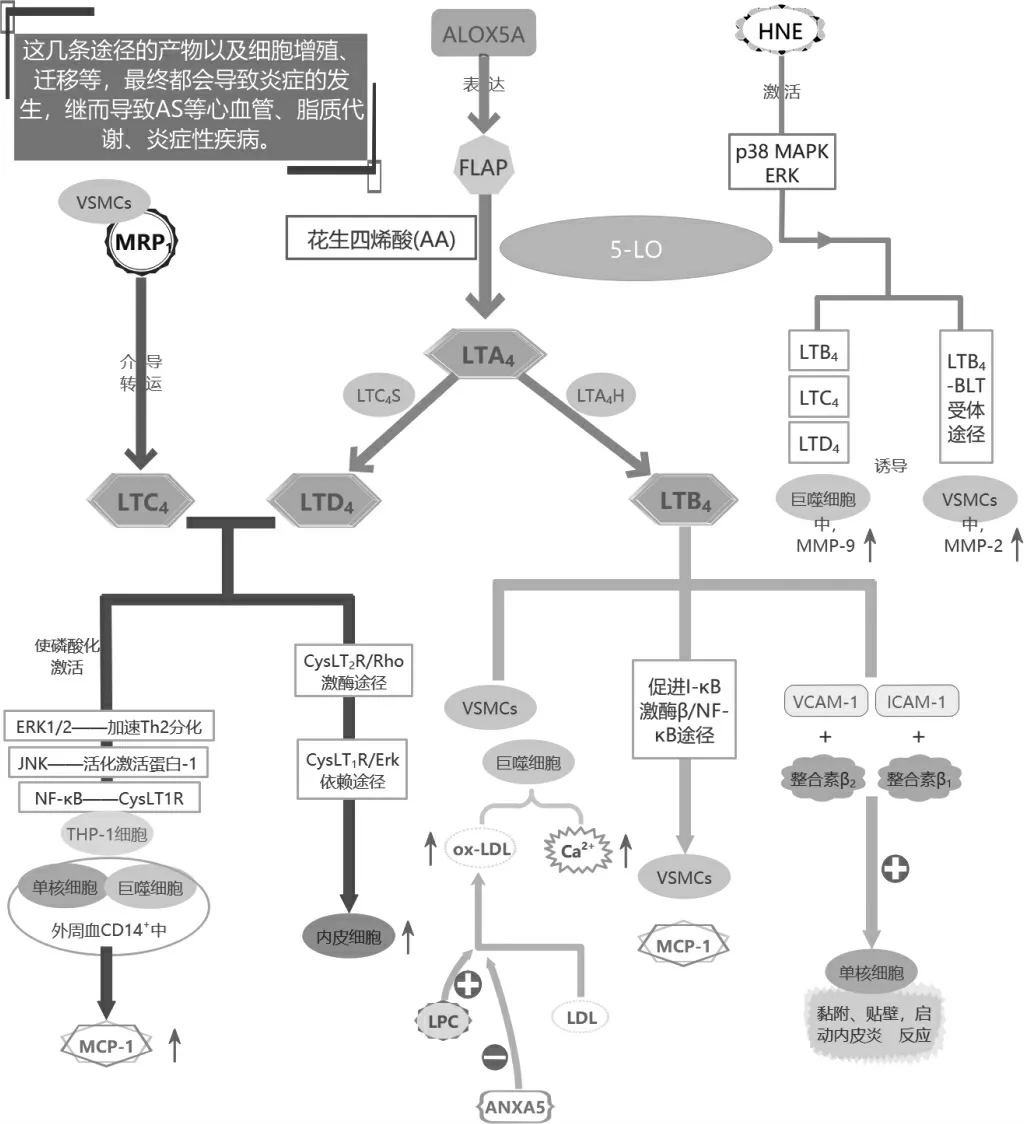
图3 LTs 参与AS 的四条途径
3.2.1 FLAP、LTA4H、LTC4S LTs 通过提高白细胞趋药性,加速心血管炎症及钙化,其合成路线上的酶类与AS 的发病机制密不可分[21]。FLAP 激活蛋白位于人类ALOX5AP 基因染色体上,其中遗传变异体rs4769874能增加基因产物FLAP 表达,从而增加冠状动脉疾病(coronary artery disease,CAD)风险,放大LTs 途径的炎性反应和导致AS 的产生;rs9579646 则减少ALOX5AP的表达和其基因产物FLAP,降低CAD 风险[22]。动物体内实验表明[23],ALOX5 基因敲除的小鼠能增加环氧合酶途径COX-2 和PPAR-γ 的表达,其激活的PON1基因能减少LDL 的氧化,还能水解ox-LDL,减少单核细胞的激活,阻止他们黏附在内皮细胞上,从而阻止AS 的进程。LTA4H 是LTB4 合成过程中的关键蛋白,涉及AA 的新陈代谢。LTC4S 是LTC4 合成酶,与谷胱甘肽共同组成LTC4 这种血管收缩剂。有实验表明[23],与健康对照组比较,在AS 斑块中这三种酶的mRNA 水平有显著增加趋势,且FLAP、LTA4H 蛋白在AS 病灶的巨噬细胞中大量聚集。此外,FLAP、LTA4H、LTC4S 代谢通路上产生重要的炎症介质,其丰富的表达可提高持续性AS 患者中斑块的不稳定。实验证明在给阿曲留通(VIA-2291,5-LO 活性抑制剂)24 周后,通过冠状计算机断层扫描,抑制剂组的34 例患者AS 斑块量相对于安慰剂组大幅度下降[24],由此可知这条途径中关键酶类的拮抗剂可成为药物干预的潜在靶标[25]。
3.2.2 MMPs、HNE 金属蛋白酶类(MMPs)是一组能特异降解细胞外基质成分的蛋白水解酶家族,位于泡沫细胞的胞质中,增加MMPs 活性是介导稳定型AS 斑块向不稳定表现型发展的必要物质条件。有研究提出,在有症状的AS 斑块中,刺激巨噬细胞而激活的5-LO 能通过LTB4-BLT1 途径、CysLTs 途径分别促进血管平滑肌细胞(VSMC)、巨噬细胞中MMP-2、MMP-9的释放[26],后者通过软化细胞外基质,降解斑块内保护性纤维帽,从而促进斑块破裂[27]。在急性缺血综合征的预防及稳定保护糖尿病患者AS 斑块的防治策略中,LTs 受体拮抗剂通过抑制LTs 受体,使LTs 及其衍生物产生减少,从而降低MMPs 的表达[28],预防和治疗糖尿病患者急性AS 血栓形成,为该类新药的研发提供了方向。
3.2.3 LTB4 研究发现肥胖组织中LTB4 明显增加,且其高亲和受体——BLT1,作为新的化学诱导物受体角色,通过LTB4/BLT1 途径促进脂肪组织中的单核细胞聚集,导致慢性炎症。LTB4 通过上调细胞间黏附因子(ICAM-1)和血管细胞黏附分子(VCAM-1)分别与其在单核细胞/巨噬细胞表面的受体整合素β1、β2 的亲和力,促进单核细胞黏附和贴壁,启动内皮反应。选择性提高5-LO 基因表达的氧化型心磷脂,激活5-LO 生成其衍生物LTB4,增加单核细胞/巨噬细胞内游离Ca2+浓度,增加肿瘤坏死因子(TNF-α)诱导血管细胞间黏附因子表达[29],还能增加ICAM-1、VCAM-1水平,加速动脉粥样硬化。LTB4 还能从I-κB 激酶β/NF-κB 通路促进血管结合激活的BLT1 促使单核细胞中CCL2 的产生[30],促进其在血管内皮的聚集和黏附,增加血管通透性,使VSMC 增殖、迁移,增加单核趋化蛋白1(MCP-1)产生[31],参与动脉粥样硬化早期进程。粥样硬化斑块组织中,巨噬细胞产生脂肪酶、活性氧、自由基等使LDL 分子氧化,并通过清道夫受体摄取ox-LDL。LTB4 能使单核细胞/巨噬细胞膜表面ox-LDL 受体表达上调,激活内皮细胞、单核细胞、巨噬细胞、T 细胞,引起巨噬细胞吞噬胆固醇脂质,最终转化成泡沫细胞,导致斑块内脂质堆积,形成不稳定斑块。且溶血性卵磷脂(LPC)在ox-LDL 诱发的免疫活化中起重要作用,能促进LDL 向ox-LDL 转化。因此抑制巨噬细胞摄取ox-LDL,从而减少血管炎症及脂质堆积,也能成为一个新的治疗AS 的方向。
3.2.4 LTC4、LTD4 LTC4、LTD4 能诱导气管平滑肌收缩,使支气管哮喘患者的白细胞产生强烈趋化性[32],在气道黏液分泌、胶原合成中起着重要作用[33]。其小部分通过结合CysLT2R 诱导大量Ca2+进入人脐静脉内皮细胞,增加TNF-α 诱导血管细胞间黏附因子表达;还能从两个受体的不同途径——CysLT2R/Rho 激酶(Rho GTP 酶超家族的Rho 亚家族)途径和CysLT1R/Erk(细胞外调节蛋白激酶)依赖途径,诱导内皮细胞收缩,加速动脉粥样硬化,显著诱导AS 患者冠状动脉收缩。大部分与CysLT1R 结合,通过MAPK 和核转录因子-κB(NF-κB)途径诱发人单核细胞/巨噬细胞中MCP-1 表达[34]。MAPK 属于丝氨酸苏氨酸激酶群体,在各种不同细胞功能的信号传导,哺乳动物细胞中有3 种主要MAPK 亚型:ERK1/2、JNK、p38 MAPK。在抗原呈递细胞中,ERK 信号通路促进最初的天然T 辅助细胞向Th2 表现型分化,从而激活Ras/ERK 通路,介导自身炎症免疫反应;JNK 激活转录因子激活蛋白,能编码各种不同种类的免疫调节基因。LTC4、LTD4 能显著加速ERK1/2、JNK 途径磷酸化过程,控制一些炎症细胞激活过程,进而导致斑块趋于不稳定状态。NF-κB 是基因中普遍存在的转录因子,编码前炎症细胞活素、趋化因子、黏附因子等,LTD4 在人上皮细胞中刺激NF-κB 途径活化;而THP-1 细胞和外周血CD14+中[34],LTC4、LTD4 通过结合其受体CysLT1R诱导NF-κB 途径活化,且THP-1 细胞中由LTC4、LTD4 诱导产生的MCP-1 能被NF-κB 途径抑制剂所阻断[34],可证明NF-κB 途径能介导人单核细胞/巨噬细胞中CysLTs 诱导MCP-1 产生,从而参加到AS 进程中[33]。多药耐药相关蛋白-1(MRP1),作为谷胱甘肽、LTC4、雌激素等的转运体,能介导LTC4 转运、血管功能和粥样斑块的形成。大量MRP1 存在于VSMCs中,对血管细胞中氧化应激的管理具有重要作用,特别是在AS 早期,能通过血管紧张素Ⅱ刺激VSMCs 增加LTC4 生产和释放,LTC4 的增加又导致活性氧含量上升,进一步影响AS 发展。实验结果表明,这些释放的活性氧也能被Cys-LT1R 拮抗剂孟鲁司特所抑制,作为AS 治疗作用的潜在方向[35]。由此可见,MRP1和Cys-LT1R 阻断剂可能成为治疗内皮功能障碍和AS 的潜在作用靶点[36]。
4 小结
LTs 是一种强有力的细胞趋化因子,具有活化炎症细胞的功能,且有较强的趋化作用及自身免疫调节作用,通过与其受体结合激活并聚集较多的炎症细胞及免疫效应细胞,参与全身性炎症、过敏反应。经多种检测手段,测量白三烯含量,可用于相关疾病的病情监测及治疗方案的调整。本文主要介绍了AS 及由各种途径导致其斑块趋于不稳定甚至破裂诱发的疾病,已成为全球发病率和死亡率的新高,所以此文从白三烯入手,仅为新型药物的开发及使用提供理论依据,为相应疾病的防治和治疗开辟新道路新靶点。

