阿德福韦酯片微生物限度检查方法的建立
黄丽华 梁蔚阳 陈宇堃 吴伟平
国家药品监督管理局血液制品质量控制重点实验室 广东省药品监督管理局血液制品质量控制研究重点实验室广东省药品检验所生物制品室,广东广州 510663
慢性乙型肝炎主要是由乙肝病毒感染所致,根据世界卫生组织的报道,在全球曾感染过乙型肝炎病毒的人数约有20 亿,其中感染慢性乙型肝炎的人数达到2.4 亿[1-2]。慢性乙型肝炎发病率高,病情复杂,治疗困难,若没有及时治疗,会逐渐发展为肝硬化、肝癌等,严重威胁患者的生命安全[3]。目前肝移植是治疗肝硬化最为有效的手段,但由于肝源有限、手术难度系数大且费用昂贵,较大地限制了肝移植的临床应用[4-5]。阿德福韦酯是5′-单磷酸脱氧阿糖腺苷的无环类似物,在体内水解为阿德福韦发挥抗病毒作用,不与其他核苷类药物(拉米夫定、恩替卡韦、替比夫定)交叉耐药,是第一个获得美国等多个国家FDA 批准用于治疗慢性乙肝的一种新的核苷类似物[6-8]。
药品检验是目前保证药物质量和安全的一个重要且有效的手段[9-11]。为了确保阿德福韦酯片微生物限度检查法的准确性和可靠性,保证药品的用药安全,现按照《中华人民共和国药典》[12](以下简称《中国药典》)中微生物限度检查方法,对其进行微生物限度方法适用性试验,建立微生物限度检查方法。
1 仪器与试药
1.1 仪器
CL-40M 高压灭菌器(日本ALP 株式会社);GRX-12A 干热消毒箱(上海森信实验仪器有限公司);LRH-250A 生化培养箱(广东省医疗器械厂);MIR-254-PC 恒温培养箱(松下健康医疗器械株式会社);BS323S 电子天平(千分之一,赛多利斯公司)。
1.2 样品
阿德福韦酯片由广东肇庆星湖生物科技股份有限公司星湖生化制药厂(样品1 批号:T161003-10;样品2 批号:T161201-14;样品3 批号:T161202)提供。
1.3 计数方法适用性菌种
大肠埃希菌[CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10104]、枯草芽孢杆菌[CMCC(B)26003]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]均由中国食品药品检定研究院提供,以上菌种均为第3 代。
1.4 培养基
胰酪大豆胨琼脂培养基(简称TSA,批号:1809214),沙氏葡萄糖琼脂培养基(简称SDA,批号:1072401),胰酪大豆胨液体培养基(简称TSB,批号:1073065),沙氏葡萄糖液体培养基(简称SDB,批号:3106032),麦康凯液体培养基(批号:1075425),麦康凯琼脂培养基(简称MAC,批号:3105703)。以上培养基均购自广东环凯微生物科技有限公司,按使用说明书配制。使用前均进行培养基适用性检查,均符合规定。
2 方法与结果
2.1 计数方法适用性试验
2.1.1 菌液的制备 分别接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物至TSB 中,经32℃培养24 h后,培养物用pH 7.0 无菌氯化钠-蛋白胨缓冲液10 倍稀释至含菌数≤1×104cfu/mL 的菌悬液,备用。接种白色念珠菌的新鲜培养物至SDB 中,经23℃培养48 h 后,培养物用pH 7.0 无菌氯化钠-蛋白胨缓冲液制成含菌数≤1×104cfu/mL 的菌悬液,备用。接种黑曲霉的新鲜培养物至SDA 斜面培养基中,经23℃培养7 d 后,加入5 mL 含0.05%(mL/mL)聚山梨酯80 的pH 7.0 无菌氯化钠-蛋白胨缓冲液,将孢子洗脱,吸出孢子悬液至无菌试管内,用含0.05%(mL/mL)聚山梨酯80 的pH 7.0 无菌氯化钠-蛋白胨缓冲液制成含孢子数为≤1×104cfu/mL 的孢子悬液。备用。接种大肠埃希菌的新鲜培养物至胰酪大豆胨液体培养基中,经32℃培养24 h 后,培养物用pH 7.0 无菌氯化钠-蛋白胨缓冲液10 倍稀释至含菌数≤1×102cfu/mL 的菌悬液,备用。
2.1.2 供试液制备 ①1∶10 供试液制备:称取样品1,加pH 7.0 无菌氯化钠-蛋白胨缓冲液至100 mL,用力振摇,溶解,制得1∶10 供试液。②1∶50 供试液制备:取1∶10 供试液10 mL,加pH 7.0 无菌氯化钠-蛋白胨缓冲液至50 mL,用力振摇,溶解,制得1∶50 供试液。③1∶100 供试液制备:取1∶10 供试液10 mL,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL,用力振摇,溶解,制得1∶100 供试液。
2.1.3 需氧菌、霉菌和酵母菌检查方法适用性试验 本品为抗病毒治疗药物,稀释倍数越大,抑菌作用越小,为确定最佳的稀释倍数,需通过预实验进行验证。取样品1 按照“2.1.2”项下,配制不同稀释倍数的供试品,平皿法(倾注法)进行。①试验组:分别取上述菌液制备中菌数≤1×104cfu/mL 的菌悬液0.1 mL 加至10.0 mL供试液中,混匀。分别取上述1∶10 供试液1.0 mL,置直径90 mm 的平皿中,立即倾注20 mL 温度≤45℃熔化的培养基(金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌组倾注TSA,白色念珠菌、黑曲霉组倾注TSA 和SDA 两种培养基),每株试验菌及每种培养基分别平行制备2 个平皿,混匀,凝固。TSA 平皿倒置放至32℃培养箱培养3 d,SDA 平皿倒置放至23℃培养箱培养5 d,观察结果,计数。②供试品对照组:分别取上述制备好的1∶10 供试液,以稀释液pH 7.0 无菌氯化钠-蛋白胨缓冲液代替菌液同试验组操作。③菌液对照组:以稀释液pH 7.0 无菌氯化钠-蛋白胨缓冲液替代供试液,按试验组操作加入试验菌液并进行微生物回收试验。回收比值=(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数。
2.1.4 控制菌检查方法适用性试验 阿德福韦酯片是口服制剂,根据《中国药典》2015 年版微生物限度要求,控制菌应进行大肠埃希菌的检查。①试验组:取上述1∶10供试液10 mL 及含菌数≤1×102cfu/mL 大肠埃希菌的菌悬液1 mL 加至100 mL TSB 中,32℃培养24 h后,取培养物1 mL 接种至100 mL 麦康凯液体培养基中,43℃培养48 h。取麦康凯液体培养物划线接种于MAC 平板上,32℃培养72 h。②供试品对照组:取上述制备好的供试液,以稀释液pH 7.0 无菌氯化钠-蛋白胨缓冲液代替菌液同试验组操作。③阳性对照组:不加供试品,其他操作同试验组。④阴性对照组:以稀释液pH 7.0 无菌氯化钠-蛋白胨缓冲液替代供试液,不加菌液,其他操作同试验组。
2.2 结果
2.2.1 预实验结果 当样品1 配制成不同稀释倍数的供试品,各菌株的回收比值均在0.5~2 之间,符合回收比值规定,并且回收比值均在0.8 以上,3 个稀释级别的供试品回收比值没有明显差异。当有几种不同稀释级别的计数方法回收比值同时达到0.5~2.0 的情况下,应综合考察结果的稳定性,操作的易行性。采用最低稀释级别的计数方法(即1∶10 供试品)作为该品种有效的检查方法,并按照以上试验组,供试品对照组,以及菌液对照组同时进行3 个样品的独立回收试验。见表1。

表1 计数验证不同稀释倍数各菌株回收比值结果
2.2.2 平皿法计数方法适用性试验回收比值 经3 次独立平行试验,金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌其回收比值均在0.5~2 之间,符合回收值规定,并且回收值均在0.8 以上,可见该法适用于本品的微生物检查。见表2。
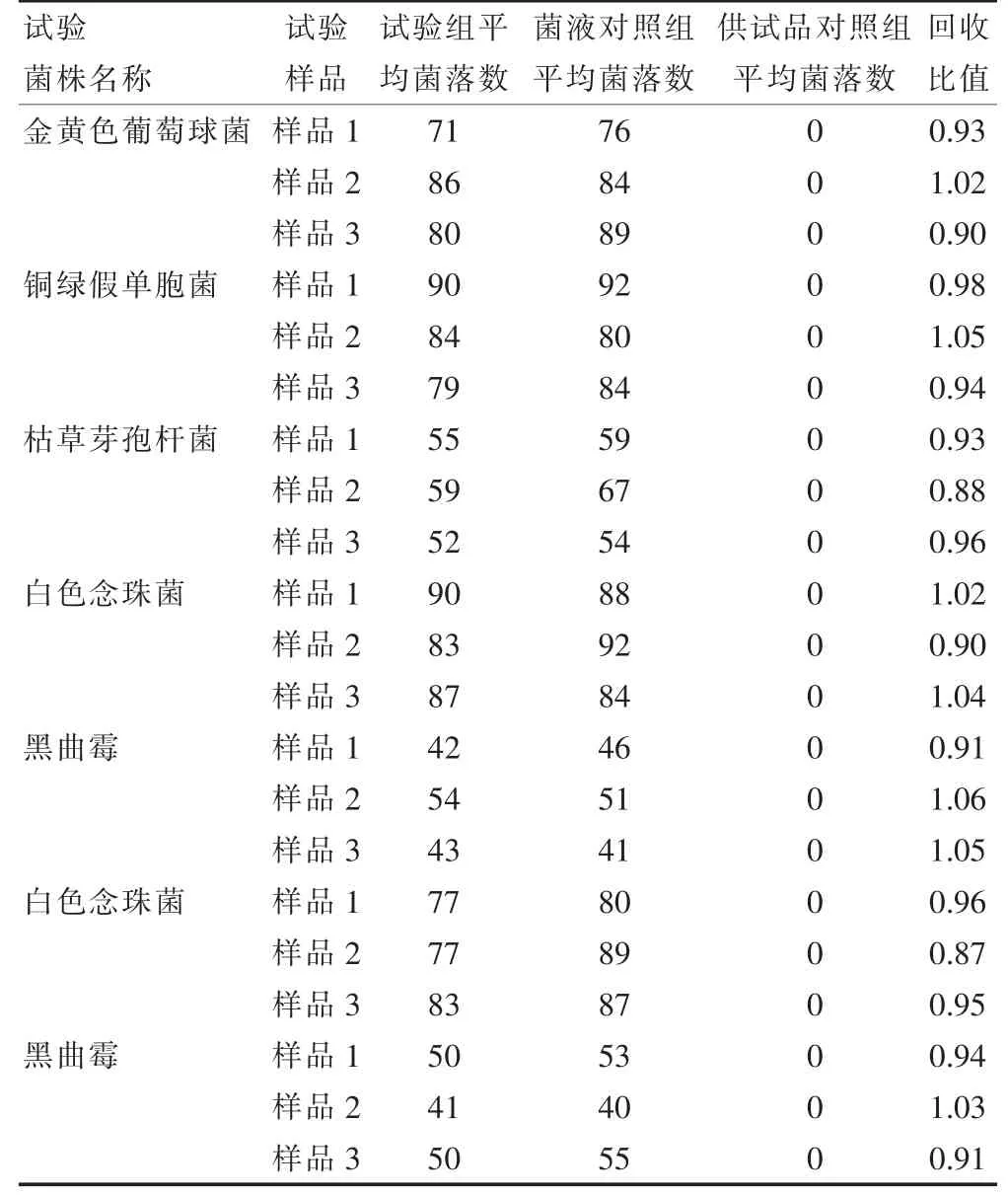
表2 阿德福韦酯片微生物检查回收比值(1∶10 供试液,cfu)
2.2.3 控制菌检查方法适用性试验结果 本品3 个样品控制菌试验组与菌液对照组结果均为阳性,检出大肠埃希菌,供试品对照组均未检出,表明阿德福韦酯片可按照《中国药典》2015 年版控制菌(大肠埃希菌)检查法进行大肠埃希菌检查,经方法适用性试验成立。见表3。
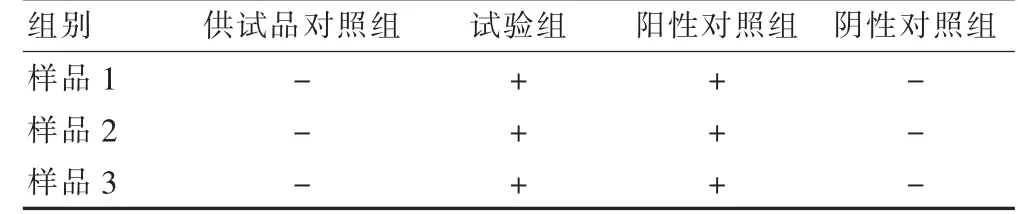
表3 阿德福韦酯片控制菌检查方法适用性试验结果
2.2.4 供试品微生物限度检查及控制菌检查结果 采用上述确定的检查方法对3 批样品进行微生物限度检查和控制菌检查,结果需氧菌总数<10 cfu/g,霉菌和酵母菌总数<10 cfu/g,均未检出大肠埃希菌,符合2015 年版《中国药典》口服制剂的微生物限度标准。见表4。
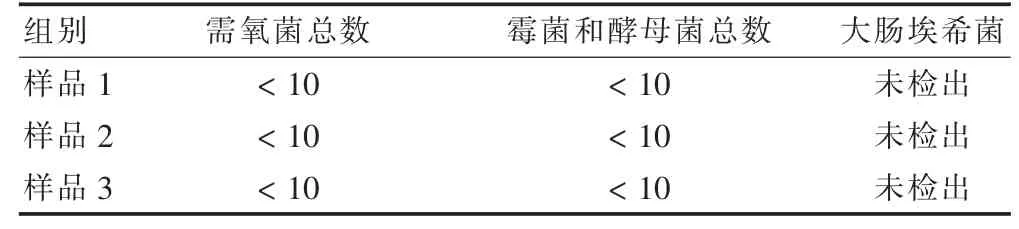
表4 3 批样品的微生物限度检查结果(cfu/g)
3 讨论
药品微生物限度检查的操作步骤繁杂,周期长,对检验环境以及人员等环节要求高,结果受多方面的影响,检验过程需注重人员的业务能力及培养基的适用性等环节[13],确保方法的准确性和完整性。从2005 年版《中国药典》[14]开始,已经形成了一个比较完备的药品微生物控制标准体系,对药品微生物限度检查法进行方法适用性规定,以建立适合该药品的微生物限度检查方法,保证药品的质量安全[15]。
随着《中国药典》2015 年版的颁布,药品微生物限度检查法在检查内容、检查方法、培养体系等方面都发生了很大变化[16-17],这给生产企业和药检机构带来了新的挑战。药品的微生物限度检查以及控制是保证药品质量安全的重要措施[18-20],而微生物的检验结果经常会受到药物本身及检验技术等多种因素的影响,因此,在进行药品的微生物检验之前,需进行适用性试验,采用经过确认的检验方法检验药品,结果方属有效[21-22]。
阿德福韦酯通过抑制乙肝病毒复制而起抗病毒治疗作用[23]。为了明确其抗病毒作用不会影响微生物的检出,因此本研究对1∶10、1∶50 及1∶100 三种不同稀释级别的供试液均做了计数方法适用性试验回收比值试验,结果发现这三种不同稀释级别的供试液回收比值均在0.5~2.0 的规定范围内,当有几种不同稀释级别的计数方法回收比值同时达到0.5~2.0 的情况下,应综合考察结果的稳定性,操作的易行性,采用最低稀释级别的计数方法作为该品种有效的检查方法。

