附子多糖纯化工艺的优化及其毒性
丁兴杰 蒲忠慧 熊 亮郭 力刘 菲∗彭 成∗
(1.成都中医药大学药学院,教育部中药材标准化重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都611137;2.西南特色药材创新药物成分研究所,四川 成都611137)
附子为毛茛科乌头属植物乌头Aconitum carmichaeliDebx.子根的加工品,其味辛、甘,性大热,有毒,具有回阳救逆、补火助阳、散寒止痛功效。附子多糖是附子有效成分之一,具有调节免疫、抗肿瘤、保护心肌细胞、降血脂等作用[1],近年来越来越受到重视[2-4],目前相关工艺研究主要集中在提取上[5-7],鲜有纯化方面的报道。
透析法作为多糖经典的除小分子化合物方法,能有效提高附子多糖纯度,而且损失较少。本实验首次采用Box-Behnken 响应面法优化附子多糖纯化工艺,并进行毒性研究,以期为该成分开发利用提供参考。
1 材料
1.1 试药 生附片(产地四川江油)购自四川江油中坝附子科技发展有限公司,经成都中医药大学药学院高继海副教授鉴定为毛茛科乌头属植物乌头Aconitum carmichaeliDebx.子根的加工品。无水葡萄糖对照品(批号110833-200302,中国食品药品检定研究院)。中性蛋白酶(批号16110902,南宁庞博生物工程有限公司);牛血清白蛋白(如吉生物科技有限公司)。95%乙醇、蒽酮、硫酸均为分析纯(成都科龙化工试剂厂)。
1.2 仪器 Lambda 35型紫外-可见分光光度计;LDZ5-2型离心机;DSY-1-6型电热恒温水浴器;电子分析天平(万分之一,德国Sartorius 公司);DB-211SC 型电热鼓风恒温干燥箱;MD34型透析袋(8 000~14 000 Da,美国Viskase 公司);24孔板;移液枪。
2 方法
2.1 标准溶液配制
2.1.1 葡萄糖 精密称取105 ℃下干燥至恒重的无水葡萄糖对照品10 mg,置于10 mL 量瓶中,定容,摇匀,即得(1 mg/mL)。
2.1.2 蛋白质 精密称取105 ℃下干燥至恒重的牛血清白蛋白对照品10 mg,置于10 mL 量瓶中,定容,摇匀,即得(1 mg/mL)
2.1.3 二硝基水杨酸(DNS)精密称取DNS 0.65 g,适量蒸馏水溶解后转移至100 mL 棕色量瓶中,依次加入NaOH 溶液(2 mol/L)32.5 mL、丙三醇4.5 g,定容,摇匀,放置7 d,即得。
2.1.4 考马斯亮蓝 精密称取考马斯亮蓝G-250 100 mg,依次加入95%乙醇50 mL、85%磷酸100 mL,蒸馏水定容至1 000 mL,即得,置于棕色瓶中备用。
2.2 总糖标准曲线绘制 采用苯酚-硫酸法。精密吸取“2.1.1”项下葡萄糖标准溶液0、40、60、80、100、120 μL,置于试管中,蒸馏水定容至1.5 mL,再加入5%苯酚2 mL,摇匀,迅速加入浓硫酸6.5 mL,室温下显色25 min;另取蒸馏水2 mL,同法显色,作为空白对照,于最大吸收波长488 nm 处测定吸光度。以总糖质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程A=63.75X+0.018(r=0.999 9),在0.004~0.012 mg/mL 范围内线性关系良好。
2.3 还原糖标准曲线绘制 采用DNS 法。精密吸取“2.1.1”项下葡萄糖标准溶液0、0.3、0.4、0.5、0.6、0.7 mL,置于比色管中,蒸馏水定容至1 mL,再加入“2.1.3”项下DNS 试剂2 mL,摇匀,沸水浴3 min,加纯水17 mL,于最大吸收波长495 nm 处测定吸光度。以还原糖质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程A=21.72X-0.046(r=0.999 9),在0.015~0.035 mg/mL 范围内线性关系良好。
“股份制”合作统一经营模式使横溪坞村竹林逐步走向规模化、集约化、效益化、品牌化的现代林业经营道路,实现了生态、经济、社会效益的和谐统一,对当地乡村振兴发挥了更为积极有效的作用。
2.4 蛋白质标准曲线绘制 采用考马斯亮蓝法。精密吸取“2.1.2”项下蛋白质标准溶液0、40、60、80、100、120 μL,置于试管中,蒸馏水定容至1 mL,再加入“2.1.4”项下考马斯亮蓝溶液5 mL,显色15 min,于最大吸收波长590 nm 处测定吸光度,以蛋白质质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程A=52.6X+0.092(r=0.999 9),在0.004~0.012 mg/mL 范围内线性关系良好。
2.5 纯化工艺 采用单因素试验,确定提取工艺为5 g 药材粗粉加40倍量水煎煮4 h,过滤,滤液离心,上清液加80%乙醇醇沉,低温放置过夜,离心,沉淀用水复溶,Sevage 法除蛋白后用透析膜透析。然后,通过苯酚硫酸法、DNS 法[8]测定多糖含有量。
2.5.1 醇沉体积分数对多糖损失率的影响 取药材粗粉5 g,加40倍量水,100 ℃下回流煎煮4 h,离心,取上清液,加乙醇至50%、60%、70%、80%、90%,静置过夜,离心,加水复溶,测定多糖含有量,结果见图1。由图可知,醇沉体积分数80%时多糖损失率最低。
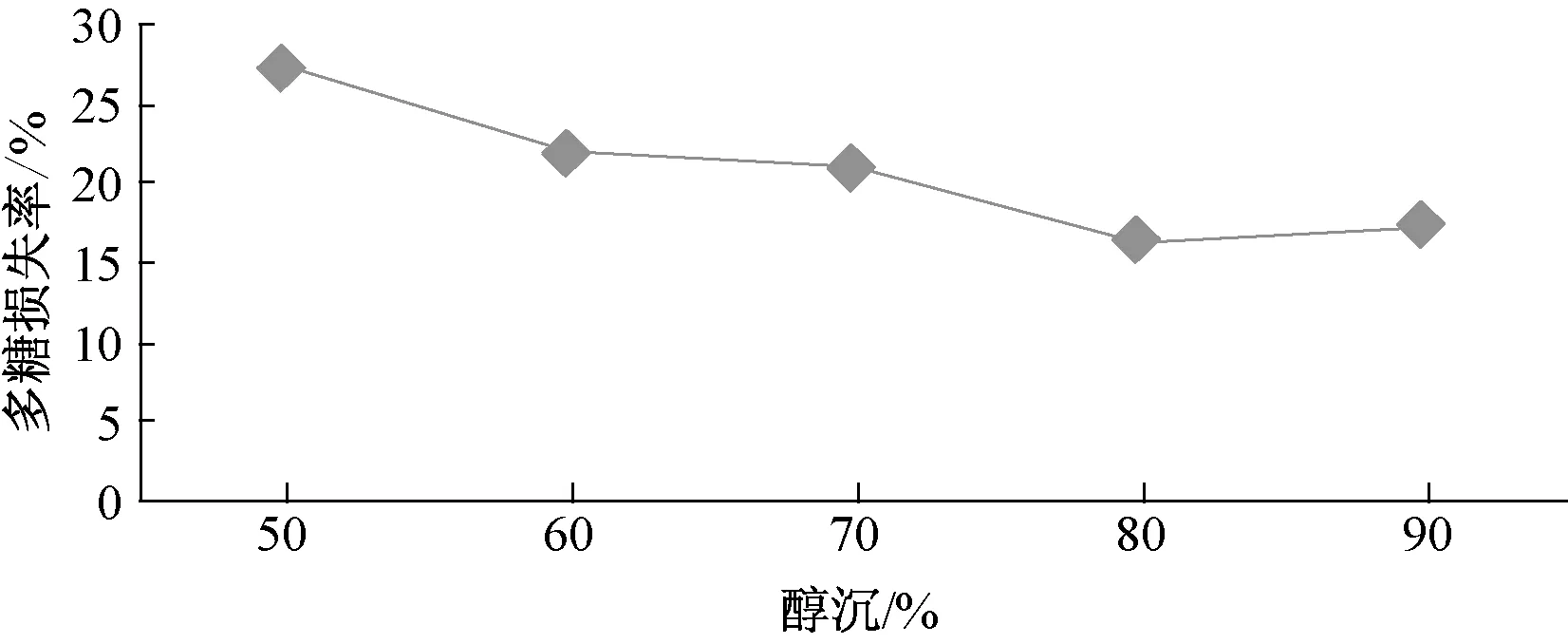
图1 醇沉体积分数对多糖损失率的影响
2.5.2 除蛋白方法对多糖含有量的影响 蛋白质是粗多糖中最主要的杂质,其存在增加了多糖吸湿性,而且所带电荷可吸附大量其他杂质和多糖,导致难以去除或分离[9]。取适量多糖溶于水,离心去沉淀,上清液分别用Sevage 试剂、三氟乙酸、中性蛋白酶除蛋白,考马斯亮蓝法检测蛋白质含有量,结果见图2。由图可知,虽然三氟乙酸法可将蛋白质除尽,但也会使多糖大量降解;酶法虽也可除尽蛋白质,但多糖含有量也较低,综合考虑,选择Sevage 法去除蛋白质。
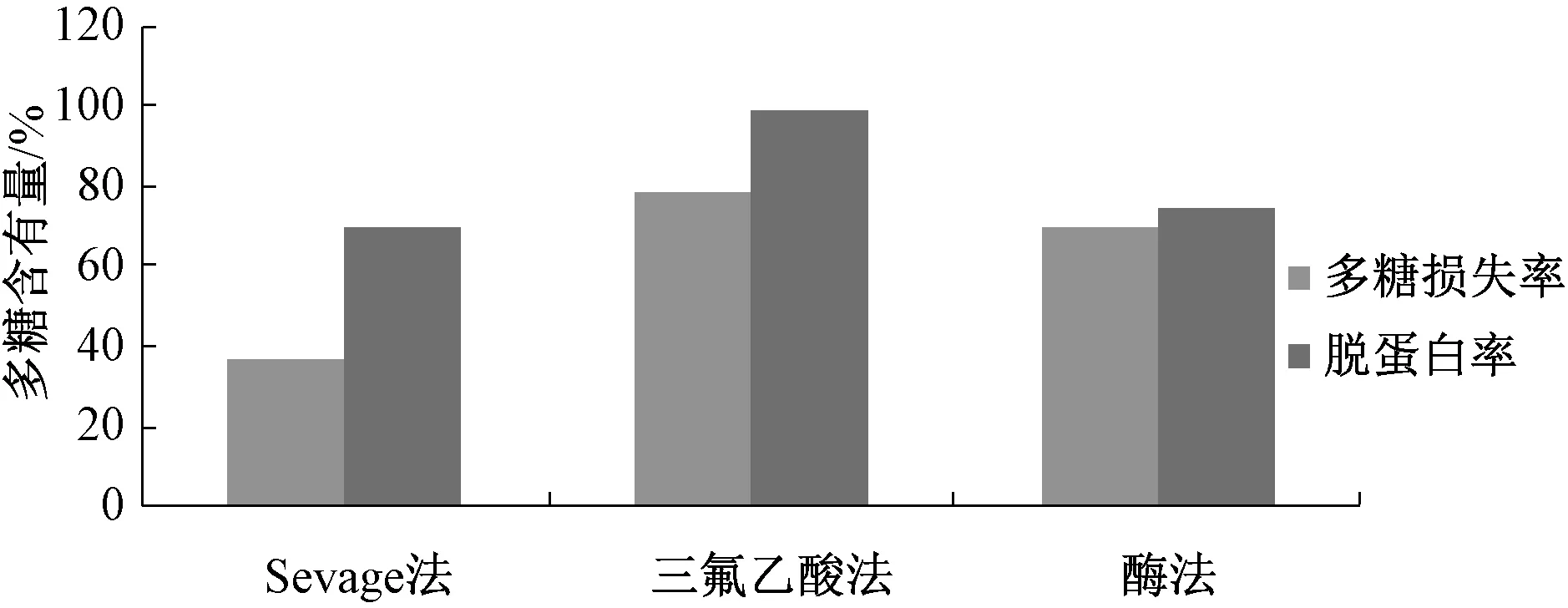
图2 除蛋白方法对多糖含有量的影响
2.6 透析工艺 通过MD34透析袋(8 000~14 000 Da)对多糖进行透析后,对透析时间、透析温度、换液次数进行单因素考察[10]。
2.6.1 透析时间 固定透析液-缓冲液体积比1 ∶50,更换缓冲液4次,透析温度20 ℃,考察透析15、20、25、30、35 h 对多糖纯度的影响,结果见图3。由图可知,透析30 h时多糖纯度最高。
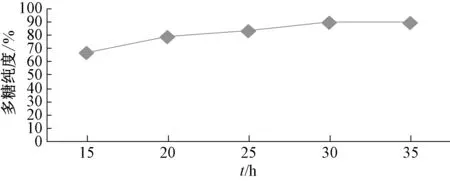
图3 透析时间对多糖纯度的影响
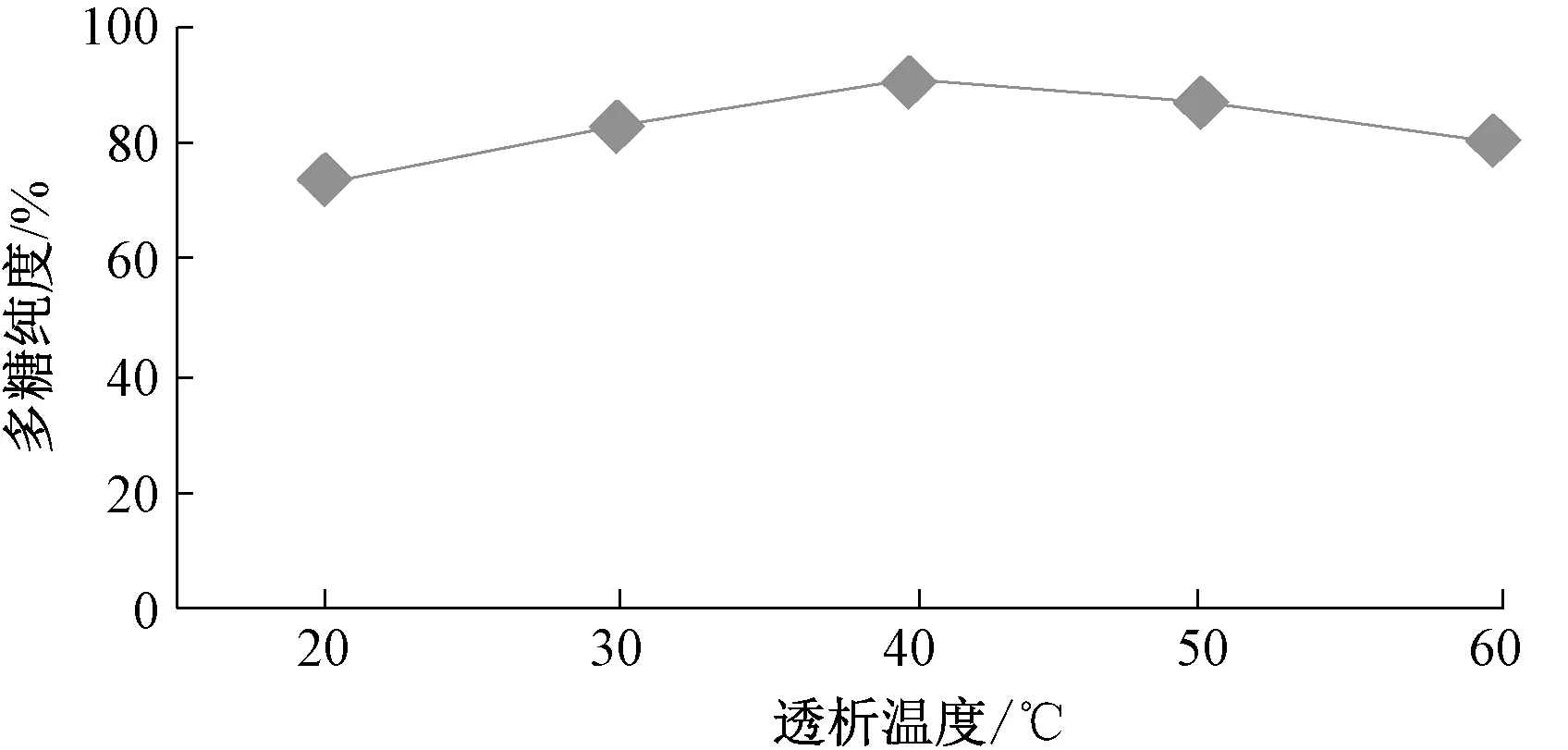
图4 透析温度对多糖纯度的影响
2.6.3 换液次数 固定透析液-缓冲液体积比1 ∶50,透析时间30 h,透析温度40 ℃,考查换液3、4、5、6、7次对多糖纯度的影响,结果见图5。由图可知,随着换液次数增加,多糖纯度逐渐提高,在6次时最高,但在7次时反而稍有降低,可能是由于换液频繁会使小分子聚合糖流失。
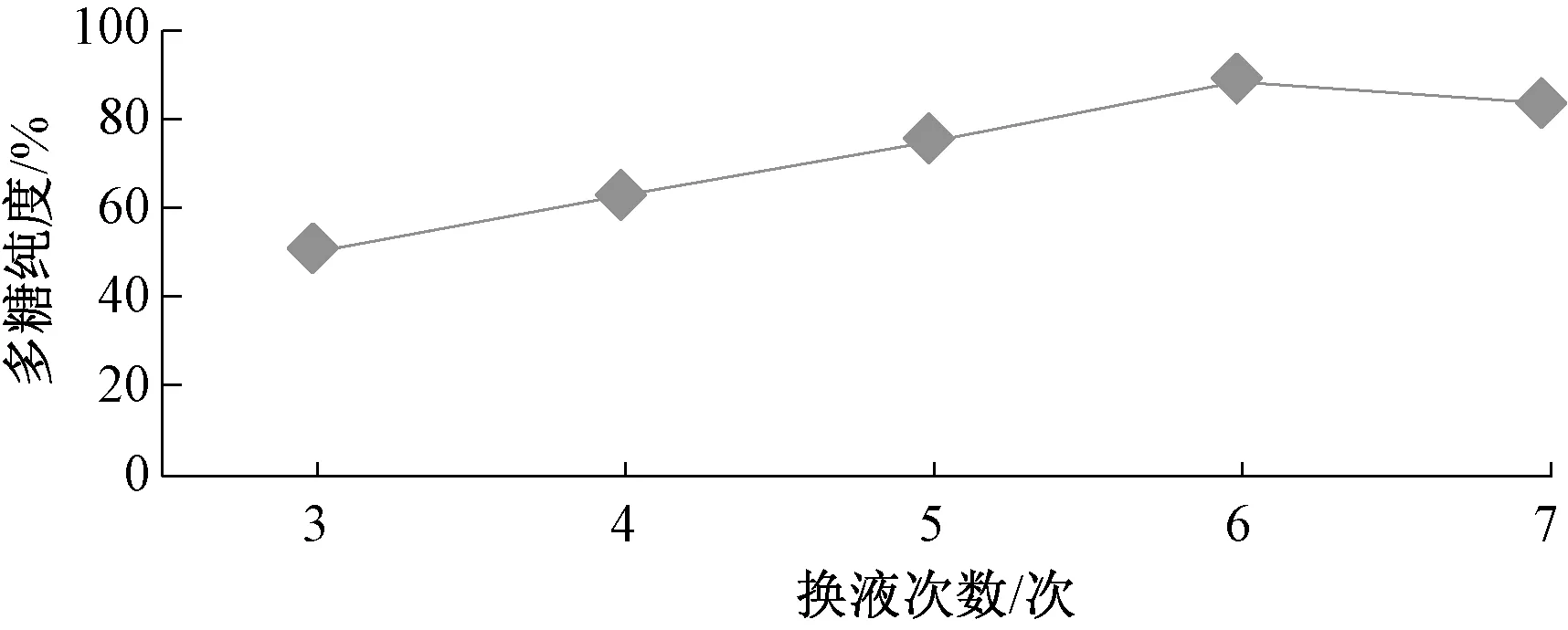
图5 换液次数对多糖的影响
2.6.4 工艺优化 在单因素试验基础上,根据Box-Behnken中心组合设计原理,选择透析温度(A)、透析时间(B)、换液次数(C)作为影响因素,多糖纯度(Y)作为评价指标,进行3因素3水平响应面分析,结果见表1。
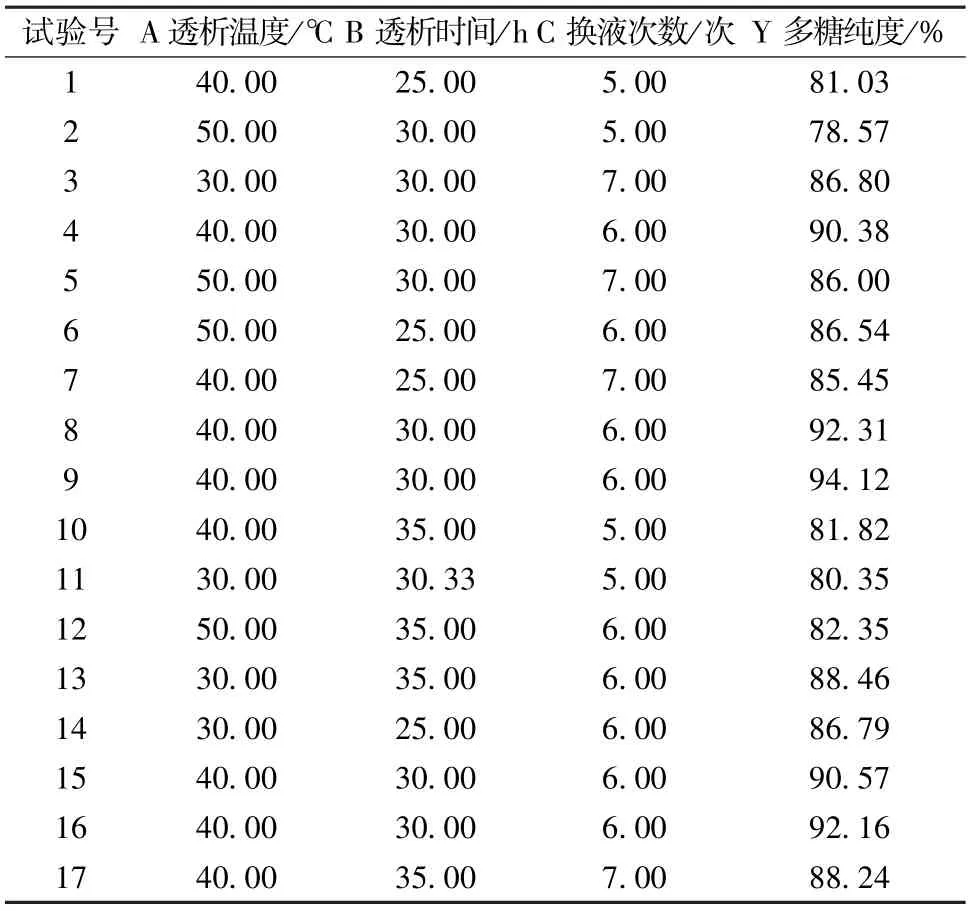
表1 试验设计及结果
然后,应用Design Expert 8.0.6.1软件对表1数据进行多元回归拟合,得方程Y=-270.689 00 +3.451 45A+6.200 10B+64.378 00C-0.029 300AB+0.024 500AC+0.100 00BC-0.035 390A2-0.093 360B2-5.439 00C2,方差分析见表2。由表可知,模型具有显著性(P<0.05),而失拟项不显著(P>0.05);各因素影响程度依次为换液次数>透析温度>透析时间;回归方程拟合度和可信度均较高(R2=0.901 5,=0.884 6),预测性良好。
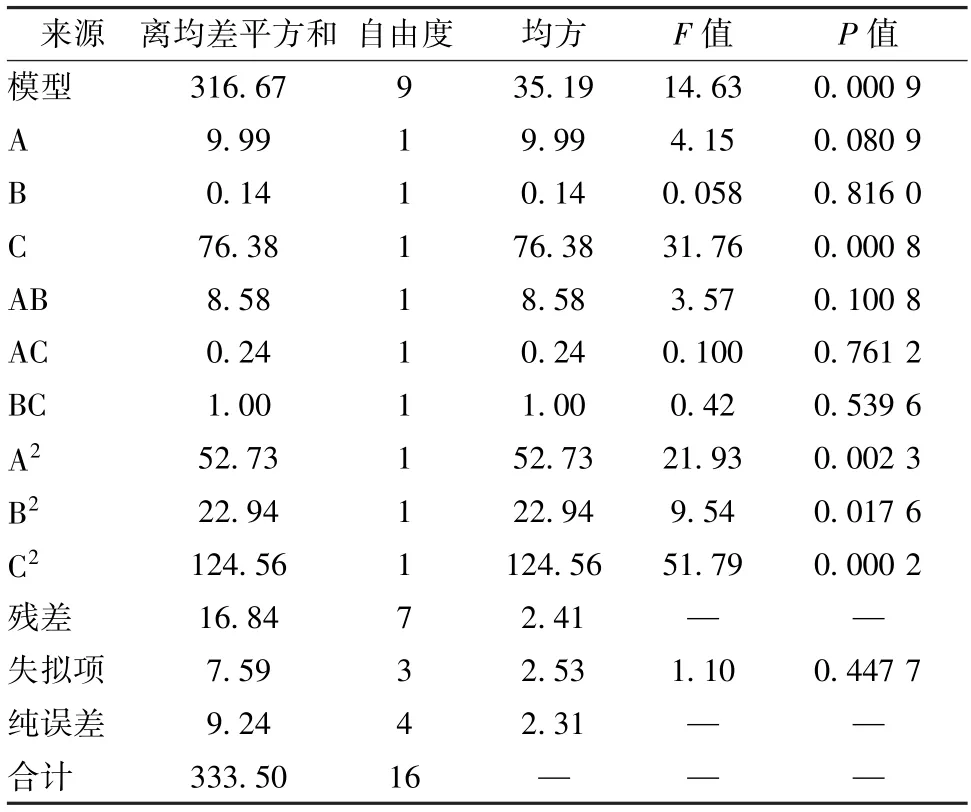
表2 方差分析
2.7 响应面分析 通过Design Expert 8.0.6.1软件绘制响应面,见图6。由图可知,最优工艺为透析温度36 ℃,透析时间31 h,换液次数6次,多糖纯度为92.17%。
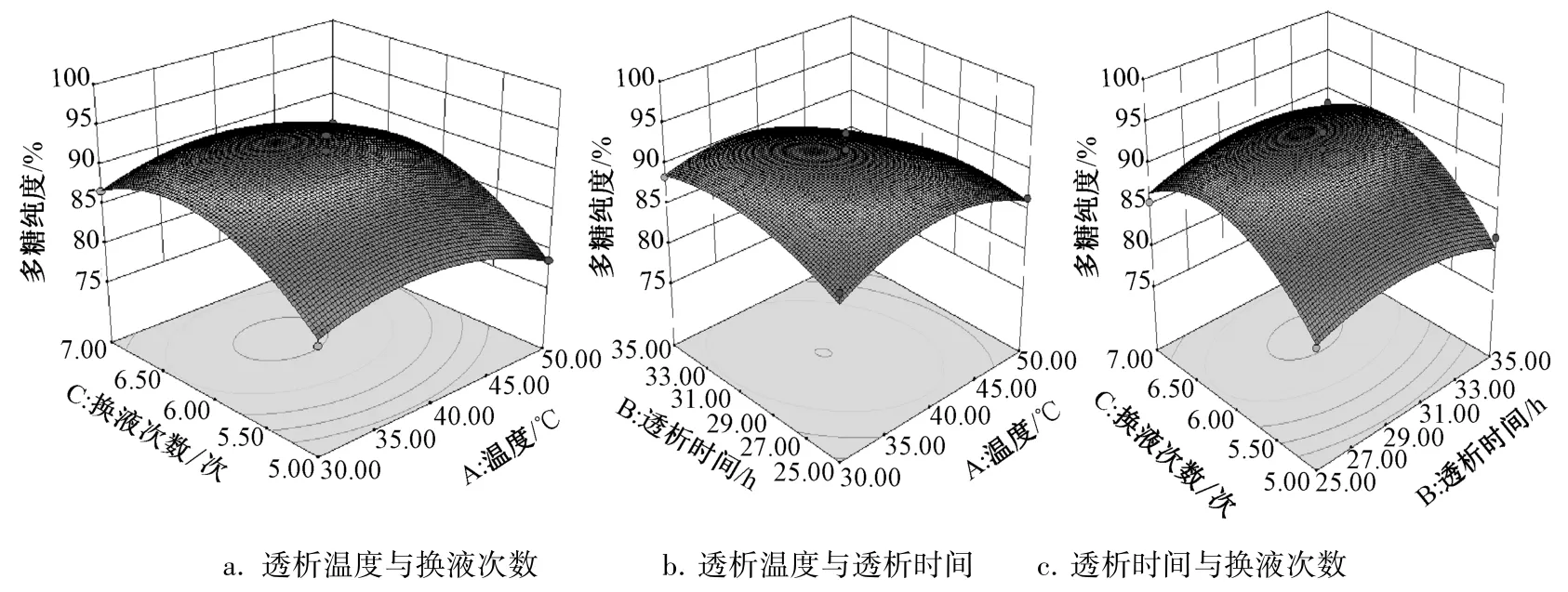
图6 各因素响应面图
2.8 验证试验 取药材粗粉5 g,加40倍量水,100 ℃下回流煎煮4 h,离心,取上清液,加乙醇至80%静置过夜,离心,加水复溶,Sevage 法除蛋白,在透析温度36 ℃、透析时间31 h、换液次数6次条件下进行多糖透析,冷冻干燥,得无色透明胶状多糖,称定质量,重复3次。结果,多糖提取率分别为9.64%、9.92%、9.58%,平均9.71%(RSD=1.85%);纯度分别为90.26%、92.71%、92.70%,平均91.89%(RSD=1.54%),与理论值92.17% 相当,表明工艺优化效果理想。
2.9 多糖毒性研究
2.9.1 心脏毒性 斑马鱼按雌雄比2 ∶1或1 ∶1的比例放入配鱼缸中,次日早上利用光照刺激使其交配,待其产卵0.5~1 h 后,收集受精卵于胚胎培养液中,置于28.5 ℃孵箱中孵育48 h,其间每天更换胚胎培养液并弃除死卵,随机分组放入24孔板中,每孔10只,分为多糖6.25、12.5、25、50、100 μg/mL 组和空白组,浸泡给药后,斑马鱼继续放入28.5 ℃孵箱中孵育。每12 h 观察1次,记录0.5 min内心跳次数,同时观察胚胎心包及心脏形态,重复3次,每次用同一批胚胎,结果见图7。由图可知,不同质量浓度多糖对斑马鱼心率均无明显影响(P>0.05)。
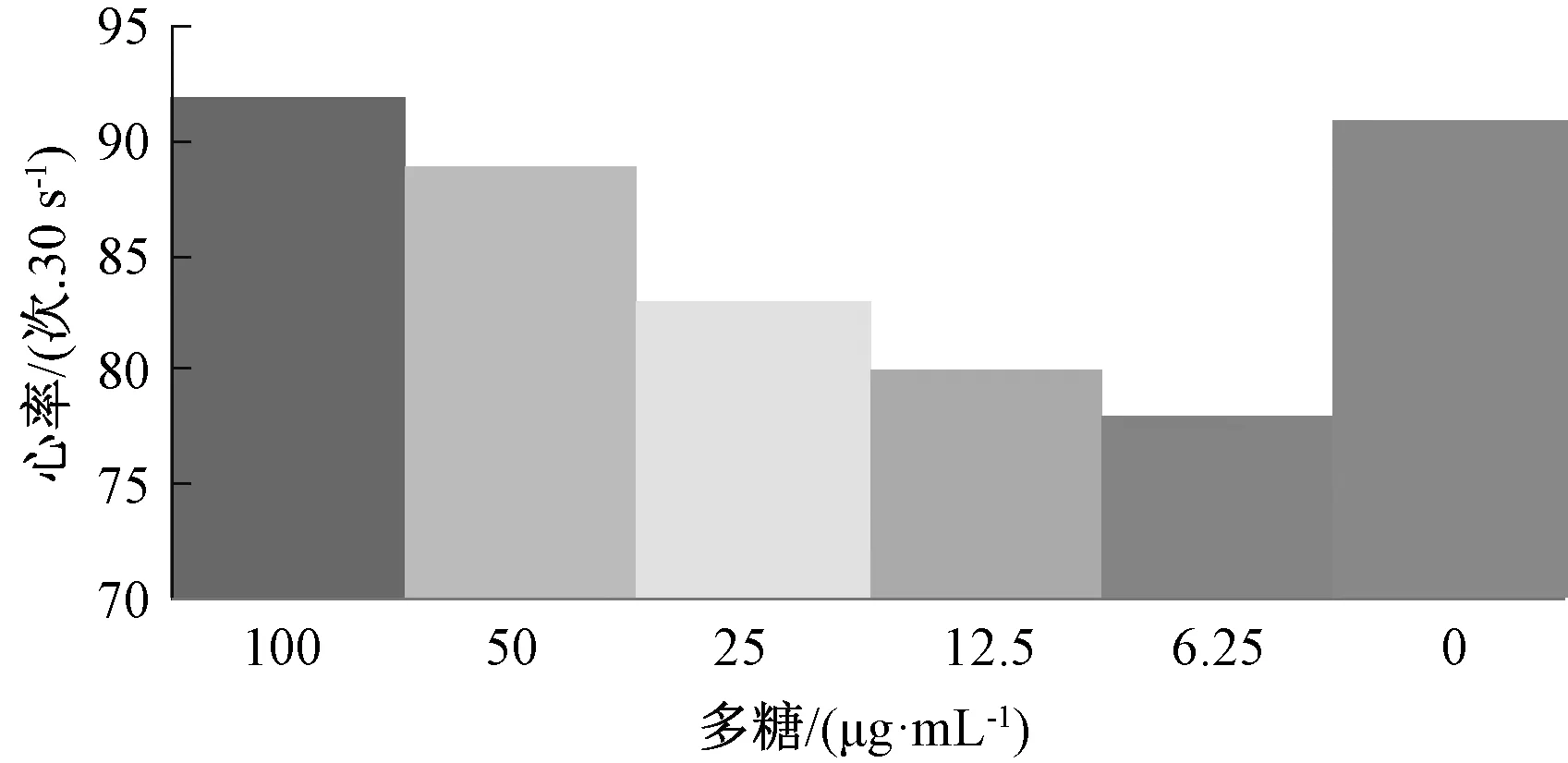
图7 多糖对斑马鱼心率的影响
2.9.2 胚胎毒性 选择受精后10 h 发育正常的斑马鱼胚胎,随机分组放入24孔板中,每孔10枚胚胎,分为多糖6.25、12.5、25、50、100 μg/mL 组和空白组,浸泡给药后,胚胎继续放入28.5 ℃孵箱中孵育,每12 h 观察1次,记录胚胎死亡率,重复3次,每次用同一批胚胎,结果见图8。由图可知,不同质量浓度多糖对斑马鱼胚胎死亡率均无明显影响(P>0.05)。
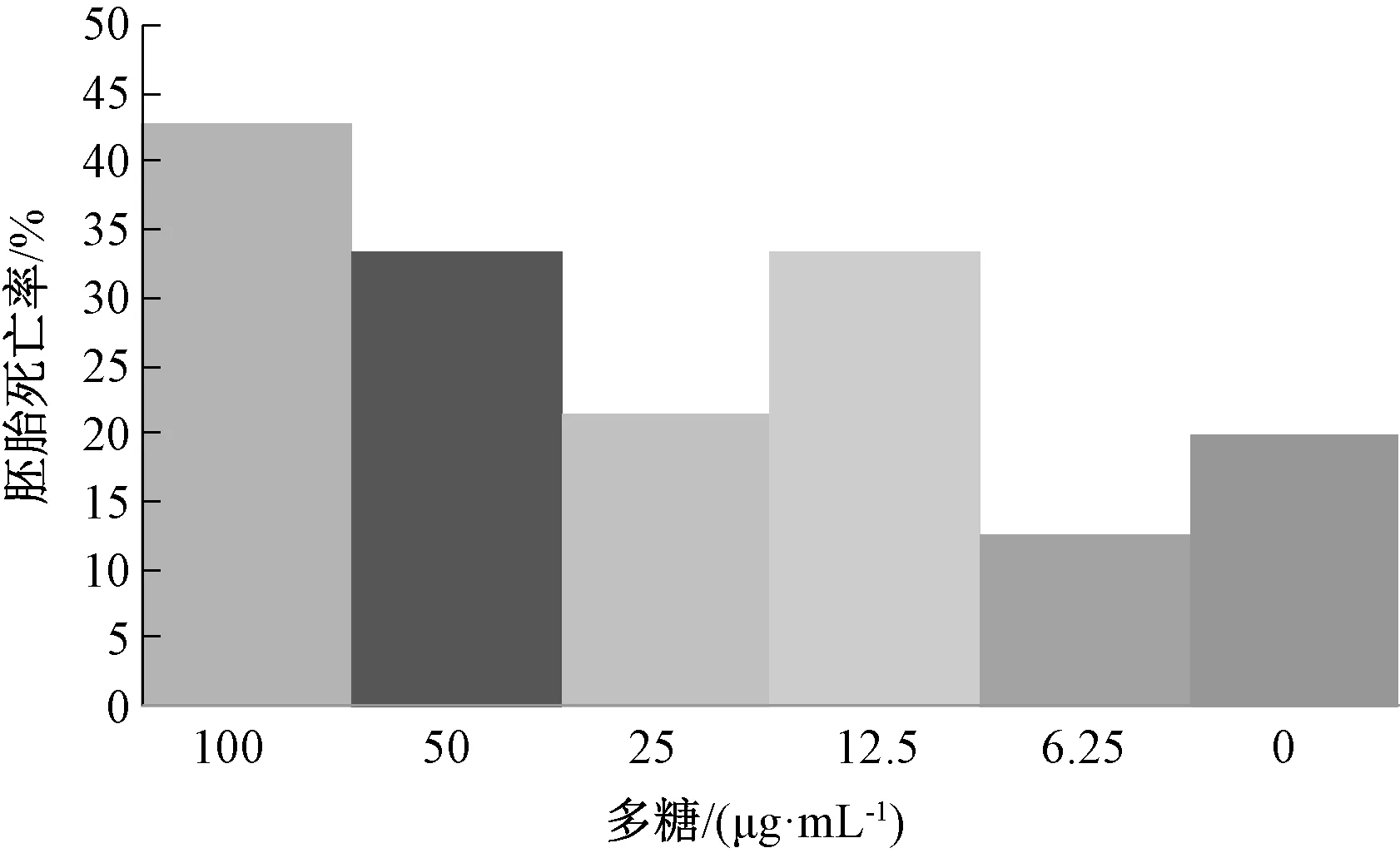
图8 多糖对斑马鱼胚胎死亡率的影响
3 讨论
传统多糖含有量测定方法大多为苯酚-硫酸法或蒽酮-硫酸法[11-12],这是因为多糖醇沉后还原糖含有量可忽略不计,但在除蛋白过程中,各种试剂会造成多糖降解而产生还原糖,三氟乙酸法、中性蛋白酶除蛋白均是如此。由于多糖透析的目的是除去小分子还原糖,故本实验采用苯酚-硫酸法、DNS 法测定多糖含有量。
Box-Behnken 响应面法是近年来发展起来的一种新的多变量统计分析技术[13],可应用于多变量统计学分析,能对几个因素的相互影响作出全面统计学分析,通过对拟合后的回归方程进行分析,以寻找最优工艺参数,而且,它可更好地处理离散水平值,具有试验数相对较少、精密度高等优点,能对各因素之间的交互作用进行研究[14]。本实验采用Box-Behnken 响应面法优化附子多糖纯化工艺,不仅使多糖透析时间降低到31 h,比传统工艺下的72 h 缩短一半以上,还将其纯度提升到91.89%,更适合工业化生产。
附子具有回阳救逆、补火助阳的功效,但有大毒。本实验考察了附子多糖毒性,发现该成分无明显心脏、胚胎毒性,安全性高,可为其开发利用提供参考。

