半冬性甘蓝型油菜资源在春性环境下的利用价值
柳海东,李开祥,徐 亮,杜德志
(青海大学农林科学院,青海省春油菜遗传改良重点实验室,国家油菜改良中心青海分中心,农业农村部春油菜科学观测实验站,青海省春油菜工程技术研究中心,西宁 810016)
油菜是世界四大油料作物之一,是中国主要的油料作物[1],其菜籽不仅可以作为食用油,加工后的菜饼可以作为蛋白饲料;而且是重要的工业原材料之一[2]。甘蓝型油菜(Brassicanapus,AACC,2n=38)是由白菜(B.rapa, 基因组AA,2n=20)和甘蓝(B.oleracea, 基因组CC,2n=18)通过两两自然杂交,天然加倍形成的异源四倍体[3],目前已经有7500a的栽种历史[4]。
菌核病是油菜主要病害之一,是由广谱性的真菌核盘菌所引发[5],菌核病会引起油菜茎秆腐烂,从而影响种子的产量和质量,在中国每年油菜菌核病发病率为10%~30%,由菌核病引起油菜籽减产10%~80%[6-7]。目前,对油菜菌核病的防治主要采取化学方法,防治成本较高,也造成环境污染,(培)选育抗(耐)菌核病的新品种是经济、有效、环保的防治途径。育种家通过传统方法已选育出一些菌核病抗性较强甘蓝型油菜品种,如半冬性甘蓝型油菜品种‘中双2号’‘中双11号’‘中双9号’‘湘油15号’等[8],春性甘蓝型油菜品种‘青杂5号’[9]等。杜德志等[10]研究表明,在春性环境下,春性甘蓝型油菜菌核病抗性比半冬性品种弱。目前,尚未见春性、半冬性、中间型(春性×半冬性)3种生态型之间有关菌核病抗性比较的报道。
油菜由于在生长过程中对温度响应的不同而分为冬性、半冬性和春性,在中国,冬性和半冬性油菜主要种植在长江流域,春油菜主要分布在甘肃、内蒙、青海、新疆、西藏等高海拔冷凉地区[11-12],春性甘蓝型油菜的亲本资源主要从加拿大、瑞典等春油菜国家引进,数量较少,遗传基础较为狭窄;由于菌核病主要发生在雨水多、湿度较大的环境下,在春油菜国家不是主要病害,所以,经受的人工和自然选择压都较小,从而导致引进的资源抗菌核病性普遍较弱[13]。中国油菜菌核病在长江流域和南方地区经常发生,该地区培育的半冬性品种(系)经过长期菌核病抗性的自然和人工选择,抗(耐)性普遍较强。近年来,青海省农林科学院从长江流域引进一些半冬性品种,通过与春性甘蓝型油菜杂交,创建了一批含有半冬性遗传成分的新型甘蓝型油菜,为了进一步探明不同生态型甘蓝型油菜在菌核病抗性、产量相关性状等方面的差异,本研究选取8份半冬性品种,8份春性品种(系)和8份(春性×半冬性)中间型品系,利用AFLP标记对其遗传差异进行分析,通过苗期叶片接菌、花期茎秆牙签接菌及田间自然发生3种方法调查菌核病抗性,考察主要农艺性状和叶绿素含量,以期为半冬性资源在春性环境下利用提供理论依据。
1 材料与方法
1.1 材料
春性甘蓝型油菜品种(系)有‘1235-1’‘青油14号’‘46号’‘Ag-5’‘90繁89-265’‘Qu’‘伟杰’‘topars’,主要来源于中国青海、内蒙、加拿大、美国、瑞典等国家;8个半冬性甘蓝型油菜品种有‘沪油15’‘浙油758’‘赣油16’‘黔油12’‘tx65’‘阳光2009’‘华双5号’‘中双7号’,主要由上海、浙江、江西、贵州、湖南、湖北等地引进;春性×半冬性中间型8个,是通过春性品种与半冬性品种杂交,其中‘D64-2’来自于‘春性46号’ב中双9号’,‘913-2’与‘931-2’来自于春性‘Qu’ב中双9号’,‘71-1’与‘77-1’来自春性‘Ag-5’ב中双7号’,‘135-1’来自春性‘1235-1’בtx65’,‘934-1’来自‘Qu’ב中双7号’,‘988-2’来自‘90繁89-265’ב浙油758’,通过小孢子培养和人工高世代自交获得的一批纯合品系(表1)。对上述24份材料进行菌核病抗性鉴定、农艺性状、苗期叶绿素含量测定。

表1 供试甘蓝型油菜名称、类型及来源Table 1 The text materials’ name,ecotype and origin of B.napus
1.2 方法
1.2.1 大田试验 2018年4月初将24份供试材料种植于青海大学农林科学院试验地,随机区组设计,3次重复,每个重复3行,行长1.5 m,行间距0.3 m,每行定苗10株,株距15 cm,田间管理按常规进行。
1.2.2 遗传差异分析 每个材料苗期取新鲜嫩叶1~2 cm,采用Doyle改良的CTAB法进行基因组DNA提取[14],利用AFLP标记中Po/Mc引物组合对24份材料进行基因组扫描,扩增程序参照Vos等[15]方法进行,同一位点标记记录,有带记为“1”,无带记为“0”,缺失记为“-”。
1.2.3 菌核病抗性鉴定 苗期叶片接菌法[16]:于油菜5叶期,将菌核提前接种在PDA培养基,待菌丝长满整个培养基,用打孔器在培养基边缘取直径5 mm的菌丝块,接种于第4片真叶中间,避开主叶脉,每小区接种6株,接种叶片放置在吸水纸保湿的不锈钢盘内,用保鲜膜封住盘口保湿,在15~22 ℃环境下培养,分别测定培养5 d和 10 d之后菌斑直径大小,并计算扩展速度。病斑扩展速度(cm/d) =(D10-D5)/5,式中 D10和 D5分别代表培养 10 d 和 5 d 的病斑长度。
牙签介导活体茎秆接菌:参考任莉等[17]方法并有所改进,于油菜花期,将菌核提前接种在PDA培养基,同时放置牙签10~20个,待牙签长满菌丝,用灭菌钢钉在油菜主茎离地面20 cm的地方打孔,再将带菌的牙签插入孔内,贯穿整个孔径,折断伸出主茎部分牙签,再用封口膜包住接种部位,每个小区接种10株,分别测定接种12 d和 32 d之后茎秆菌斑长度,并计算扩展速度。病斑扩展速度(cm/d) =( D32-D12) /20,式中 D32和 D12分别代表培养32 d和 12 d的病斑长度。
大田自然鉴定:于油菜成熟期,调查自然发病株数及等级,分为5级,0 级为全株茎、枝、果轴无症状;1 级为全株 1/3 以下分枝(含果轴,下同)发病或主茎有小型病斑,全株受害角果数(含病害引起的非生理性早熟或不结实,下同)在 1/4以上;2 级为 1/3-2/3 分枝数发病,或分枝发病在 1/3 以下而主茎中上部有大型病斑,全株受害角果数达 1/4-2/4;3 级为全株 2/3 以上分枝数发病,或分枝发病数在 1/3-2/3 而主茎中下部有大型病斑,全株受害角果数达 2/4-3/4;4 级为全株发病[11]。发病率和病情指数的计算公式为:
发病率=发病株数/调查总株数×100%;病情指数=∑(病级株数×代表病级)/(株数总和×4)×100。
1.2.4 苗期叶绿素含量测定 利用SPAD502进行叶片叶绿素测定[18],叶绿素含量为SPAD值,单位为“1”。测定每个单株五叶期相同位置叶片的叶绿素含量,测量时避开主叶脉,每小区测3个单株,每个单株测3次。
1.2.5 产量相关性状 材料成熟时,每小区在中间1行随机取样 8 株进行考种,考察性状为:角果粒数、单株角果数、千粒质量和单株产量等主要农艺性状。角果粒数:在主轴及上、中、下分枝花序上随机取10个正常角果,计算其平均每果饱满和略欠饱满的种子数;单株角果数:全株具有一粒以上饱满或略欠饱满种子的角果总数;千粒质量:将整个小区完熟种子混匀称千粒质量;单株产量:整株所有种子称量结果。分别对每个小区的初花期进行记载,花期记录以小区内每个植株第一朵花开为标准,当小区中25%的植株达到开花标准后则认为是该小区的初花期,初花期=25%开花时间-播种期。
1.3 数据统计
聚类分析采用Ntsys-pc软件中非加权类平均法(unweighted pair group method arithmetic averages, UPGMA)进行分析[19-20]。利用Excel进行方差分析、多重比较和t检验。数据以“平均数±标准误”表示。
2 结果与分析
2.1 不同生态型甘蓝型油菜遗传差异分析
利用AFLP标记Po/Mc组合,选取扩增效果清晰易读(图1),多态性丰富的引物37对,共产生152个多态性位点,利用这些多态性位点进行聚类分析。结果表明,在遗传相似系数0.54处将24份不同生态类型甘蓝型油菜品种划分为两大类,第Ⅰ类包括8个半冬性品种和两个(春性×半冬性)中间型品系‘77-1’和‘135-1’,第Ⅱ类包括8份春性品种和6份(春性×半冬性)品系;在遗传相似系数0.58处将所有材料分为4个亚群,第Ⅰ亚群包括8个半冬性品种和1个(春性×半冬性)品系‘77-1’,第Ⅱ亚群只含有1个(春性×半冬性)品系‘135-1’,第Ⅲ亚群包括8份春性品种和2份(春性×半冬性)品系‘934-1’‘988-2’,第Ⅳ亚群包括4份(春性×半冬性)品系‘D64-2’‘931-2’‘71-2’和‘913-2’。结果说明,半冬性品种与春性品种之间具有较大的遗传差异,且不同生态类型甘蓝型油菜品种(系)之间遗传差异大于相同类型品种(系)之间遗传差异(图2)。

1~24泳道分别代表24个不同品种(系),与表1中24个材料编号对应 Electric lanes 1-24 represent 24 different varieties(lines), corresponding to the 24 materials’ numbers in table 1, respectively
图1 AFLP引物Po1/Mc3扩增结果
Fig.1 Amplified profile by AFLP primer Po1/Mc3

图2 不同生态型甘蓝型油菜基于AFLP 标记的聚类图Fig.2 Dendrogram ofdifferent ecotypes of B. napus based on AFLP markers
2.2 不同生态型甘蓝型油菌核病抗性分析
离体叶片接种鉴定结果表明,接菌5 d后,8个春性品种叶片菌斑显著大于春性×半冬性品系和半冬性品种,春性品种病斑直径为2.38~3.72 cm,春性×半冬性品种(系)病斑直径为1.04~ 2.37 cm,半冬性品种病斑直径为0.59~2.21 cm;接菌10 d后,春性品种病斑直径为6.60~ 7.49 cm,春性×半冬性品种(系)病斑直径为 4.11~6.58 cm,半冬性品种病斑直径为2.40~ 6.30 cm,大多数春性品种、春性×半冬性品种(系)和半冬性之间病斑直径两两差异达到显著(P<0.05)或极显著水平(P<0.01);多数春性品种病斑扩展速度与半冬性品种、春性×半冬性品种(系)之间差异显著(P<0.05),但半冬性品种与春性×半冬性品种(系)之间差异不显著,半冬性品种中‘黔油12’较之其他同类型品种,病斑直径及扩展速度较快,表现较为感病,春性×半冬性品种(系)中‘D64-2’和‘988-2’菌斑直径较小,扩展速度较慢,说明抗性较强(表2)。
牙签介导活体茎秆接种发展速度较慢,约一周后形成病斑,12 d后,春性品种病斑发展到 4.70~7.81 cm,经过20 d,扩展到14.95~54.86 cm,扩展速度较之其他两种生态型品种(系)最快;春性×半冬性品种(系)病斑长度由12 d时的2.53~5.68 cm扩展到32 d时的12.20~20.02 cm,其中扩展最快的品系是‘135-1’,病斑长度和扩展速度较慢的品系是‘988-2’和‘934-1’,说明这两品系抗性较强;半冬性品种12 d时病斑长度为1.13~3.52 cm,32 d后,扩展到9.10~14.16 cm,病斑长度和扩展速度都显著小于前面两种类型,半冬性品种中,‘黔油12’病斑长度及扩展速度较快,表现较为感病(表3)。
田间自然鉴定结果显示(表4),春性品种发病率在22.17%~41.98%,病情指数为12.63~31.36,发病率最高的为‘1235-1’,最低的为‘伟杰’;春性×半冬性品种(系)发病率在16.15%~23.57%,病情指数为7.1~14.29,发病率最高的为‘135-1’,发病率最低的为‘934-1’;半冬性品种发病率在23.78%~6.93%,病情指数为3.02~16.37,发病率最高的为‘黔油12’,最低的为‘浙油758’。春性品种发病率和病情指数显著高于中间型和半冬性的大多数品种(P<0.05)。不同生态型之间发病率和病情指数以春性品种最高,中间型次之,半冬性品种最低,说明半冬性品种最抗病,中间型次之,春性品种抗病性最差。
对大多数品种而言,3种不同方法鉴定结果表现一致,半冬性品种‘黔油12’在3种方法中较之同类型其他品种表现为感病,抗性较弱,‘浙油758’无论在叶片染菌,牙签染菌还是自然发病都表现出极强的抗性,春性×半冬性品系‘934-1’‘988-2’和‘D64-2’表现出较强的抗性。3种生态型品种在3种方法之下都表现出春性抗病性最弱,春性×半冬性次之,半冬性最强,三者之间两两都达到显著或极显著水平(图3)。

表2 离体叶片接种法测定不同生态型甘蓝型油菜菌核病抗性Table 2 S.sclerotiorum resistance of different B.napus accessions detected with in vitro leaf inoculation method
注:数值后不同小写和大写字母表示在 0.05 和 0.01 的水平上达显著或极显著差异。下同。
Note:Values followed by different letters are significantly different at the 0.05(small letter) or 0.01(capital letter) probability levels. The same below.
以上结果说明不同和相同生态类型甘蓝型油菜品种之间菌核病抗性存在差异,半冬性品种抗性最强,不易感病,而春性×半冬性品种(系)次之,春性品种最弱,易感病,说明利用半冬性品种可以有效提高甘蓝型春油菜菌核病抗病能力。
2.3 不同生态型甘蓝型油菜叶绿素含量分析
对24份不同生态类型的甘蓝型油菜品种(系)进行叶绿素含量测定,并对测定结果进行分析。从表5可以看出,在青海生长条件下,春性品种叶绿素含量高于半冬性品种,并达到极显著水平(P<0.01),春性×半冬性品种(系)的叶绿素含量显著高于半冬性品种(P<0.05),春性品种与春性×半冬性品种(系)之间叶绿素含量没有差异。
2.4 甘蓝型油菜品种(系)产量相关因子及初花期分析
对同一生态型内不同甘蓝型油菜品种(系)的产量相关因子及初花期进行多重比较,从表6可以看出,在半冬性品种中,‘中双7号’单株产量和每角粒数最高,分别为21.93 g和27.29个,单株产量最低的为‘赣油16’(8.68 g),该品种全株有效角果数也在8个品种中最少,为169.86个,千粒质量大于3.9 g的品种有‘tx65’‘华双5号’‘沪油15’和‘中双7号’,其余差异不明显,初花期在半冬性环境下最长的为‘沪油15’,达到 92 d,最短的为‘黔油12’(78 d);8个中间型品种(系)中单株产量和全株有效角果数排前两位的分别为‘934-1’(25.77 g,406个)和‘931-2’(23.97 g,347个),每角粒数多的品系千粒质量较小,如‘D64-2’‘135-1’,中间型品种(系)花期差异不大,最早和最晚只相差4 d;春性品种中单株产量排前4位的分别为‘Qu’‘伟杰’‘青油14’和‘46号’,排后两位的为‘90繁89-265’和‘1235-1’,每角粒数、千粒质量和全株角果数也是呈现不同程度的差异,初花期在不同品种之间存在差异,‘青油14’初花期在所有品种中最短,为68 d,而‘伟杰’初花期最长,为82 d,两者相差14 d。综上所述,同一生态型内不同甘蓝型油菜品种(系)产量相关因子存在不同程度差异,说明相同生态型不同品种各有特性。
为了明确上述5个农艺性状在不同生态型甘蓝型油菜品种(系)之间是否存在差异,进一步对初花期、每角粒数、千粒质量、单株产量、全株角果数等农艺性状进行综合分析。结果表明,春性品种和中间型品种(系)在初花期上显著短于半冬性品种;在每角粒数性状上,春性品种显著多于半冬性品种,而中间型品种(系)与其他两种生态型甘蓝型油菜品种之间没有差异;春性品种和中间型品种(系)的单株产量分别显著高于半冬性品种;3个不同生态类型的品种在千粒质量和全株角果数上并没有表现出差异(表7)。

表3 牙签介导活体茎秆接种测定油菜对菌核病的抗性Table 3 Responses to S.sclerotiorum resistance of 24 genotypes inoculated stem in vivowith toothpick on 12 d and 32 d

表4 不同生态型甘蓝型油菜田间菌核病抗性比较Table 4 Comparison of resistance to S.sclerotiorum in the farmer field by natural infection of different ecotypes
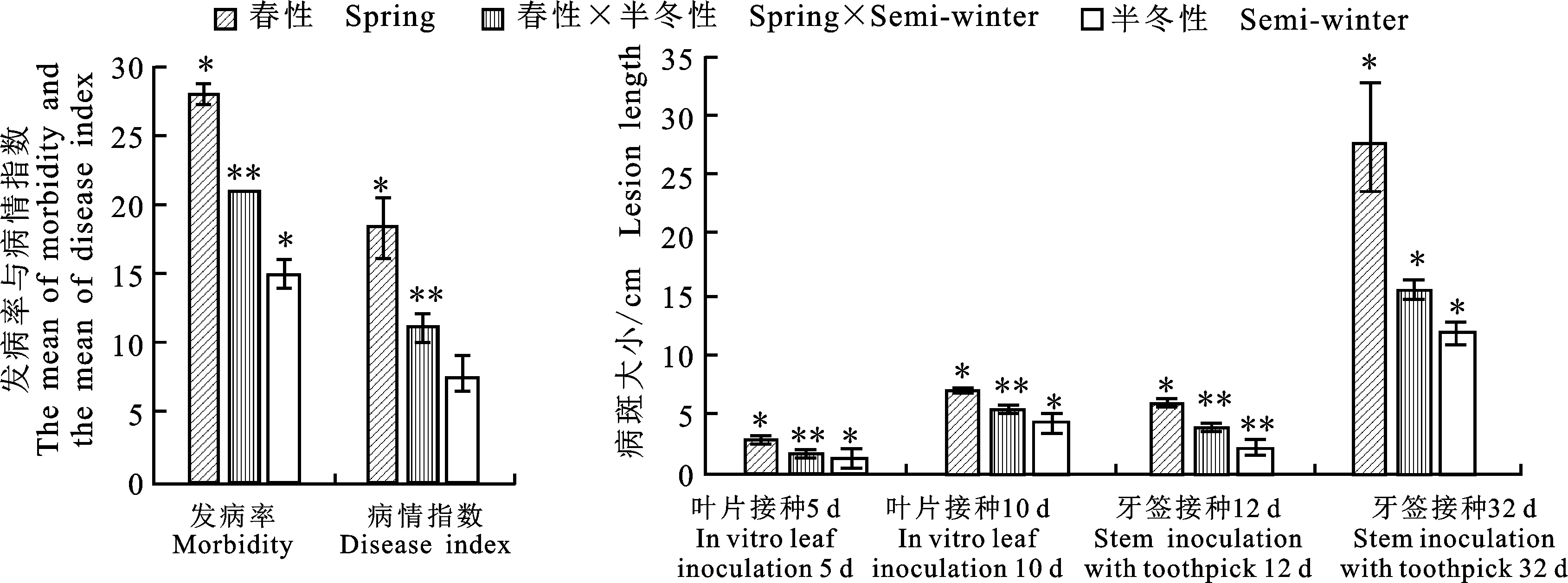
左图为大田自然发病鉴定结果,右图为不同接种方法鉴定结果 The left plate shows the natural infection result ofS.sclerotiorum, and right one is the artificial infection result ofS.sclerotiorum;*表示差异达到显著水平(P<0.05) Significant difference atP<0.05 probability level,**表示差异达到极显著水平(P<0.01) Significant difference atP<0.01 probability level

图3 不同生态类型甘蓝型油菜菌核病抗性比较Fig.3 Comparison of resistance to S.sclerotiorum among different ecotypes B.napus
注:*差异显著(P<0.05); **差异极显著(P<0.01)。
Note:Asterisk are significantly different(P<0.05)(single asterisk) or(P<0.01)(double asterisk) probability levels byttest.

表6 同一生态型甘蓝型油菜产量相关因子比较Table 6 Comparion of yield components within same ecotype B.napus

表7 不同生态类型甘蓝型油菜产量相关因子t检验Table 7 T text for yield components indifferent ecotypes B. napus
注:数据右上角1、2、3分别表示春性与春性×半冬性之间t值,春性与半冬性之间t值,春性×半冬性与半冬性之间t值;*差异显著 (P<0.05)。
Note:the number 1, 2 and 3 in the top right corner departerment of thetvalue between the spring varieties and the middle type varieties, between the spring varieties and the semi-winter varieties and between the middle type varieties and the semi-winter varieties, respectively.
3 讨论与结论
为了进一步探明半冬性甘蓝型油菜在春油菜环境下的利用价值,本研究选取8份半冬性品种作为半冬性甘蓝型油菜的代表,主要是由于这8份材料在春油菜环境下能够正常成熟,虽然花期与春油菜有差异,但大多数花期与春性品种相差不大,不影响其利用,这些半冬性品种来自长江流域不同地区,其中有7份来自长江中下游的5个地区,‘黔油12’来自贵州;8份春性品种一部分选自早期从加拿大、美国、瑞典、中国内蒙古等国家和地区引进的品种,如‘Ag-5’‘Qu’‘伟杰’等,这些品种是春油菜种质资源创建的原始亲本,还有一些春油菜本地品种,如‘1235-1’‘90繁89-256’等;8个中间型品种(系)的原始亲本至少有一个或两个都来源于本研究所选用的春性品种和半冬性品种,如‘D64-2’来自于‘春性46’ב中双9号’‘71-1’与‘77-1’来自春性‘Ag-5’ב中双7号’。本研究对24份不同生态类型的甘蓝型油菜品种(系)进行遗传差异分析,结果表明,在遗传相似系数0.54处将春性和半冬性品种区分开来,但春性×半冬性品种(系)跟春性品种聚在一起,说明不同生态类型品种在基因交流过程中只发生少量有效片段的渗入,大部分基因片段还是以春性为主。在遗传相似系数0.58处将全部的春性品种、半冬性品种和部分春性×半冬性品种(系)区分开来,中间型部分跟半冬性聚在一起,部分跟春性品种聚在一起,主要原因是导入半冬性遗传成分有多有少。说明不同生态类型品种间遗传差异较大,通过导入半冬性遗传成分可以有效扩大不同生态类型品种间遗传差异,这些研究结论与前人研究结论一致[21-22]。
油菜菌核病的鉴定主要分为人工接种和大田自然鉴定两类,人工接种方法包括苗期叶片接菌[16]、花期茎秆牙签接菌、叶柄接种[17]。大量研究表明,苗期叶片离体接种不能客观反映材料抗性,花期接菌方法可有效反映不同材料抗性差异[16-17,23]。本研究采用苗期离体叶片接菌、花期活体茎秆牙签接菌和大田自然鉴定3种方法对不同生态型甘蓝型油菜菌核病抗性进行鉴定分析,3种鉴定结果显示不同生态型品种之间抗性趋势基本一致,3种生态型品种在3种方法之下都表现出春性抗病性最弱,春性×半冬性次之,半冬性最强,三者之间两两都达到显著或极显著水平,在各生态型内部不同品种之间,3种方法鉴定结果表现一致性较差,但个别品种如‘黔油12’,在3种方法中较之同类型其他品种抗性较弱,浙油758无论在叶片染菌,牙签染菌还是自然发病都表现出极强的抗性。春性×半冬性品系‘934-1’‘988-2’和‘D64-2’表现出较强的抗性,主要原因可能是这3个中间型品系的半冬性亲本‘中双9号’‘中双7号’和‘浙油758’菌核病抗性较强。前期众多的研究结果表明:在春性环境下,半冬性甘蓝型油菜菌核病抗性强于春性甘蓝型油菜[10-11,22,24],中国春油菜亲本资源主要从加拿大、瑞典等国家引进,而这些国家菌核病不是主要病害,所以自然选择和人工选择压较小,导致这些引进资源菌核病抗性普遍较弱[13],在油菜的抗菌核病育种上,现在尚无较好的抗源,加之菌核病抗性表现为部分显性[25],所以,在现有甘蓝型油菜种质资源中通过聚合有效抗源可以提高油菜的抗耐病性[10-11,24,26]。本研究中,中间型材料通过在春性资源中导入半冬性遗传成分,其菌核病抗性显著高于春性品种,这说明通过不同生态型资源之间有效基因交流,可改良其性状。
本研究对不同生态型甘蓝型油菜产量相关性状进行分析,中间型品种(系)和春性品种的单株产量、春性品种的每角粒数分别高于半冬性品种。研究表明,油菜每角粒数与每个角果中胚珠发生数、胚珠发育和蜜蜂传粉等因素有关[27-29],春性品种每角粒数显著高于半冬性品种,原因可能是春性品种在春性环境下选育,对环境适应性较强,自身发育也比较完善,而半冬性品种在春性环境中由于其生育期较长,花期较晚,可能会导致胚珠发育迟缓或部分胚珠败育,从而不能有效完成受精。在单株产量方面,每角粒数也是影响单株产量的因素之一,春性品种每角粒数显著高于半冬性品种,所以造成春性品种单株产量显著高于半冬性品种;另一方面,由于半冬性品种成熟其较晚,春性条件下会造成成熟度不好,因而对单株产量产生一定的影响。前期研究结果表明春性甘蓝型油菜苗期叶绿素含量显著高于半冬性甘蓝型油菜品种[30],本研究结果也证明该结论,另外,通过中间型与其他两种类型比较,中间型品种(系)的叶绿素含量显著高于半冬性品种(表5),叶绿素含量的高低会影响光合速率[31],这也可能是春性品种单株产量高于半冬性品种的原因之一。
本研究首次证明中间型(春性×半冬性)品种(系)在菌核病抗性显著强于春性品种,在春油菜菌核病抗性育种中,可以通过导入半冬性遗传成分来选育高抗菌核病的油菜资源,半冬性油菜也可以通过导入春性甘蓝型油菜基因片段来改良叶绿素含量及产量等性状。

