MRI-DWI、CT灌注扫描在评估肝癌介入术后肿瘤活性中的应用比较
河南科技大学第一附属医院介入科(河南 洛阳 471003))
杜廷伟 赵浩锋 王 彤
手术切除在肝癌治疗中发挥了重要作用,但该疾病起病隐匿、早期症状不显著等因素使多数患者就诊时已处于局部晚期或已发生远处转移,丧失手术指征[1]。经肝动脉化疗栓塞术(TACE)将化疗药物以碘化油乳化后注入瘤灶发挥局部治疗作用,对改善患者生存期和生活质量有重要意义[2]。肿瘤残余与复发直接关系到患者的预后,及时明确对指导进一步治疗有重要意义。数字减影血管造影(DSA)是目前判断肿瘤活性的金标准,但为有创检查,重复性较差。核磁共振弥散加权成像(MRI-DWI)对肝癌TCAE术后病灶评估有较高的灵敏度和准确度,但也存在检查耗时较长、易受伪影干扰等弊端,CT灌注扫描(CTPI)可反映肿瘤供血特点及肿瘤内微循环灌注情况[3],可能对评估肝癌TACE术后肿瘤活性有一定帮助。对此,本研究观察MRI-DWI与CTPI在评估肝癌患者TACE术后肿瘤活性中的应用情况,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析我院2017年3月至2018年3月58例(69个病灶)肝癌TACE术后患者临床资料。纳入标准:符合肝癌规范化病理诊断指南(2015版)[4]中诊断标准者;行TACE术治疗者;于TACE术后3~5周行MRI-DWI、CTPI、DSA检查者;自愿签订知情同意书者。排除标准:合并其他恶性肿瘤者;严重心肝肾功能不全者;存在凝血功能异常、消化道出血史者;临床资料不全者。其中男47例,女11例;年龄38~71岁,平均(57.3±9.7)周;肿瘤类型:局块型35例,结节型23例。
1.2 方法MRI:取仰卧位,脚先进,扫描范围膈顶至肾脏;采用美国GE1.5T磁共振成像仪,8 通道体部相控阵线圈;常规平扫T2W1 FRFSE序列、T2W1 FIESTA序列、T1W1 FSPGR序列;DWI采用单次激发SE-EPI序列,TR6000ms,TE随b值变化而变化(37.4~90.2ms),层厚6mm,间隔2mm,FOV40×32cm,矩阵128×160,在X、Y、Z三个方向上施加扩散梯度,扩散敏感系数b取50、100、150、200、400、600、800、1000s/mm2。
CTPI:采用日本TOSHIBA AquilionONE320排CT机,选取病变中心最大层面及与之相邻的4层作为感兴趣区,优先选择碘油缺损区域为靶层面;对比剂采用碘普罗胺,50~70ml以6~8mL/s速率经肘静脉注射,生理盐水20ml以相同速率冲管;对比剂注入后连续动态扫描共23次,描参数:管电压100kv,管电流60mA,FOV 400mm,球管旋转l周0.5s。将数据导入体部灌注分析程序进行图像对位,再将对位图像数据导入体部灌注分析程序。
DSA:患者取平卧位,常规消毒铺巾,穿刺处局麻后,经右侧股动脉穿刺插管,以5F-RH导管行腹腔干和肠系膜上动脉造影,观察血管闭塞程度及残余灶染色情况;造影剂为300mg/mL的碘普罗胺,注射速度4~6mL/s;发现活性病灶再次行TACE治疗,未发现者继续随访。
MRI-DWI、CTPI、DSA检查结果由2名影像科高年资主任医师进行观察、分析,分别就病灶的活性做出诊断,异议时商议达成一致。
1.3 统计学分析数据分析用SPSS19.0软件处理,计数资料以百分比表示,χ2检验;P<0.05为差异有统计学意义;采用一致性分析的Kappa值分析,Kappa值>0.7 为一致性较高,处于0.4~0.7为一致性中等,<0.4为一致性较弱。
2 结 果
2.1 MRI-DWI诊断肝癌TACE术后活性病灶的价值 MRID W I 诊 断 肝 癌T A C E 术 后 活 性病灶的灵敏度、特异度、准确度、阳性预测值、阴性预测值分别为95.92%(47/49)、9 0.0 0%(1 8/2 0)、94.20%(65/69)、95.92%(47/49)和90.00%(18/20),Kappa值0.859。见表1。
2.2 CTPI诊断肝癌TACE术后活性病灶的价值CTPI诊断肝癌TACE术后活性病灶的灵敏度、特异度、准确度、阳性预测值、阴性预测值分别为91.84%(45/49)、8 5.0 0%(1 7/2 0)、89.86%(62/69)、93.75%(45/48)和80.95%(17/21),Kappa值0.757。见表2。MRI-DWI与CTPI诊断肝癌TACE术后活性病灶的灵敏度、特异度、准确度、阳性预测值、阴性预测值差异均无统计学意义(P>0.05);MRI-DWI与DSA诊断一致性高于CTPI。
2.3 肝癌TACE术后活性病灶的影像学表现MRI-DWI:TACE术后1个月复查,MRI-DWI图像肿瘤复发区为高信号,碘油沉积区表现为低信号,检出活性病灶45个;MRI动态增强扫描碘油沉积区出现局部缺损及肿瘤染色,增强扫描可见肿瘤实性成分明显强化。病例男46岁,TACE术后1个月MR-DWI示肿瘤周围大量高信号影(图1),MRI动态增强扫描肿瘤动脉期明显强化,门脉期呈“快进快出”式信号减低(图2)。
CTPI:TACE术后1个月复查,增强CT动脉期扫描见瘤区可辨强化区,CTPI见瘤区表现为相对周围正常肝实质的高信号亮区。病例男65岁,增强CT动脉期可见肝右后叶结节状碘化油沉积区,较密实的碘化油高密度掩盖了可能存在的强化活性灶(图3),CTPI肝右后叶上下缘可见相对周围肝实质的明显高信号亮区(图4)。
3 讨 论
目前TACE是肝癌非手术治疗的首选方法。文献显示,TACE可使肝癌血清标志物甲胎蛋白(AFP)水平迅速下降,肿块缩小,疗效确切[5]。且具有操作简捷、微创、重复性好、较全身化疗毒性低等优势。肝脏是双重供血的器官,且TACE术后肿瘤病灶侧支循环形成、交通支开放,故对肝癌患者常需行数次TACE治疗。因此,TACE术后对病灶的评估尤为重要。
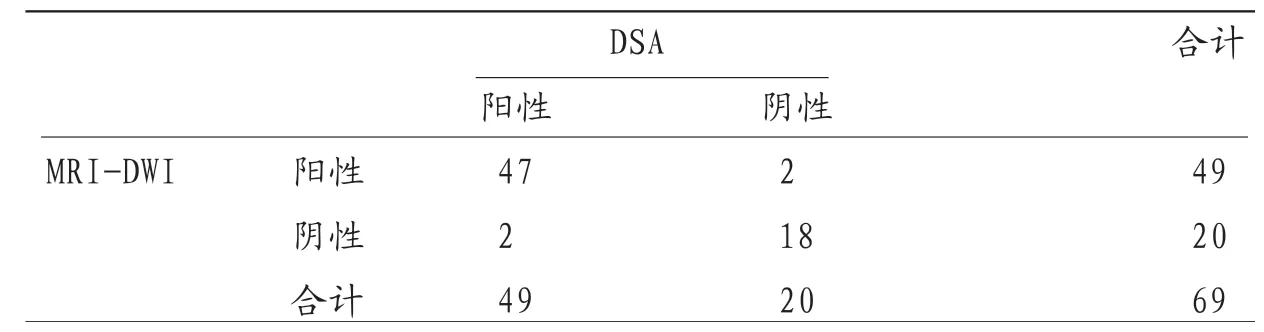
表1 MRI-DWI与DSA诊断结果比较(n)
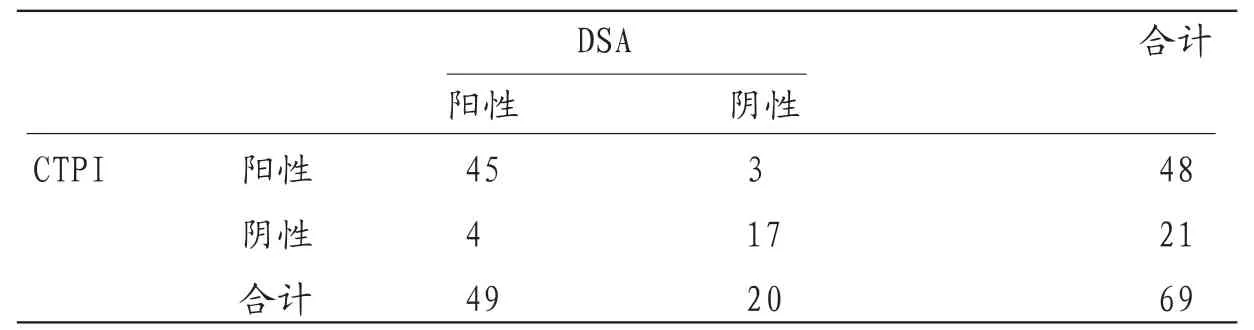
表2 CTPI与DSA诊断结果比较(n)
DWI是反映组织水分子在体内弥散运动的序列,水分子的运动状态与细胞密度、分布,组织结构,生化特性,细胞外间隙形态改变,对各种方式的治疗后反应等密切相关[6]。故MRI-DWI可通过检测活体组织内水分子运动状态改变来反映组织的形态学和生理学改变。肝癌患者TACE术后肿瘤残留及复发区,肿瘤细胞出现不同程度的肿胀、变性或坏死,细胞膜崩解消散可造成局部水分子弥散加快[7]。液化坏死组织内的水分子弥散状况与肿瘤内实性细胞成分完全不同,MRI-DWI检测到这些分子水平的变化,反映在弥散图像上肿瘤活性区域表现为高信号,坏死区域则表现为低信号[8]。本研究中,MRI-DWI诊断肝癌TACE术后活性病灶的灵敏度、特异度、准确度、阳性预测值、阴性预测值分别为95.92%、0.00%、94.20%、95.92%和0.00%,Kappa值0.859,与CSA诊断一致性较高,说明MRI-DWI对肝癌患者TACE术后肿瘤活性有良好的评估作用。侯毅斌等[9]对48例肝癌患者TACE术后4~8周随访显示,DWI检测患者术后肿瘤活性的灵敏度、准确度、特异度分别为6.35%、91.86%、93.89%,与本研究基本一致。但MR-DWI检查技术也存在图像信噪比相对较低,易受伪影干扰、检查耗时较长、可能受部分良性病变干扰等问题,使其应用受到一定影响。
新血管的形成是肿瘤发生和转移的基础,肝癌患者肝动脉供血较丰富,表现出高动脉灌注量,TACE术后活性病灶也表现出高于周围正常肝脏组织的动脉灌注量[10]。CTPI连续测量可检测病灶及周围组织血流动力学特点和生理学性质,并可评估肿瘤生长情况[11]。在肝癌患者TACE术后,CTPI不仅可反映肿瘤形态学信息,亦可准确评估肿瘤血供特点和内部的微循环灌注情况,为TACE疗效和术后肿瘤活性等方面情况评估提供可靠的依据。本研究中,CTPI诊断肝癌TACE术后活性病灶的灵敏度、特异度、准确度、阳性预测值、阴性预测值分别为91.84%、85.00%、89.86%、9 3.7 5%和8 0.9 5%,Kappa 值0.757,与CSA诊断一致性较高,略低于MRI-DWI,说明CTPI对肝癌患者TACE术后肿瘤活性有良好的评估价值。刘璐璐等[12]对研究也发现,CTPI检测患者肝癌TACE术后肿瘤活性的灵敏度、特异度分别为86.7%、83.2%,与本研究基本一致。但肝癌患者常伴有不同程度的肝硬化,肝脏本身血流动力学存在一定变化,且CTPI检查存在辐射,可能对临床应用产生一定影响。
综上所述,MRI-DWI可通过检测活体组织内水分子运动状态改变来评估肝癌患者TACE术后肿瘤活性,CTPI则可通过反映肿瘤形态学信息、准确评估肿瘤血供特点及内部的微循环灌注情况检测肝癌患者TACE术后肿瘤活性,均有良好诊断价值,各有优劣,合理应用上述诊断措施对指导临床治疗有重要意义。
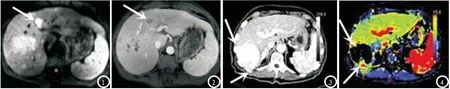
图1 MRI-DWI图像。图2 MRI动态增强扫描图像。图3 增强CT动脉期扫描图像。图4 CTPI图像。