P123辅助水热法合成单分散α-Fe2O3六方圆盘及其在锂离子电池上的应用
(硅材料国家重点实验室,浙江大学材料科学与工程学院,浙江 杭州 310027)
1 前 言
锂离子电池自1990年实现商业化应用以来,由于具有输出电压高、使用寿命长等优点,在便携式电子设备领域得到广泛应用[1-3]。目前常用的锂离子电池负极材料主要是石墨碳,由于其储能密度较低,已不能满足电动汽车、太阳能储存等对大功率高储能密度锂离子电池的要求。过渡金属氧化物材料由于其特殊的锂离子脱嵌过程中转换型反应机制,往往具有与石墨负极材料相比更高的理论比容量,作为新一代高能量密度锂离子电池负极材料具有很大的应用潜力[4-5]。
α-Fe2O3作为锂离子电池负极材料,理论比容量高(900mAh/g),价格低廉,来源广泛,一直受到研究者的重点关注。目前已有α-Fe2O3纳米颗粒,纳米管和纳米线等作为负极材料应用在锂离子电池中,展现出优异的电化学性能[6-9]。由于α-Fe2O3负极材料在电化学反应过程中不可逆的相变带来巨大的体积变化,在充放电过程中容易发生α-Fe2O3负极材料的粉化而从集流体上脱落[10-11],造成其比容量的快速下降。为了克服α-Fe2O3负极材料的体积膨胀的难题,通常采用制备具有特殊微观形貌的α-Fe2O3纳米颗粒的方法来改善它的电化学性能。
本研究采用水热制备的方法合成了六方圆盘状α-Fe2O3纳米颗粒作为锂离子电池负极材料,研究了引入三嵌段聚合物P123对水热制备α-Fe2O3六方圆盘分散性的影响,进而经碳化处理后,探讨了碳膜全包覆的α-Fe2O3/C纳米颗粒作为锂离子电池负极材料的应用。
2 实 验
2.1 样品合成
水热制备α-Fe2O3六方圆盘的方法与之前发表论文类似[12],取0.015mol的Fe(NO3)3·9H2O和0.04mol的KOH片剂溶解在40ml乙二醇和水体积比为3∶1的混合溶液中,磁力搅拌30min得到红褐色悬浊液。将获得的前驱体溶液转移至50ml聚四氟乙烯内衬中,装入不锈钢反应釜密封,在200℃的烘箱中保温30h,空气中自然冷却至室温后,将反应产物取出,分离,依次采用去离子水和无水乙醇清洗后在70℃烘箱中干燥,得到最终产物。
为了提高所合成的α-Fe2O3六方圆盘的单分散性,在水热系统中引入三嵌段共聚物P123辅助水热合成α-Fe2O3。为了在水热体系中引入P123,首先称取1g P123分散到30ml乙二醇中,经过12h的磁力搅拌,得到澄清溶液,然后加入10ml去离子水,得到用于水热合成单分散α-Fe2O3六方圆盘的前驱体混合溶液。后续的实验步骤与未引入P123的实验步骤相同,干燥后得到水热反应最终产物。
采用P123辅助水热合成的样品在电化学性能测试之前还需进行热处理。将P123辅助水热合成的样品粉末转移到磁舟中,在通有N2保护气氛的管式炉中以10℃/min的速度升温至400℃进行热处理,然后随炉自然冷却至室温得到用于锂离子电池的碳膜包覆的α-Fe2O3/C负极材料。
2.2 样品表征
采用Rigaku X射线衍射仪(XRD)进行物相分析,扫描速度2°/min,扫描范围10°~80°。采用MODEL S-4800型扫描电子显微镜(SEM)来观察样品的微观形貌。采用inVia型激光显微拉曼谱仪对碳包覆α-Fe2O3样品中的碳元素状态进行分析,设定拉曼光谱的扫描范围为200~2000cm-1。采用Q500热重分析仪(TG)对碳包覆α-Fe2O3样品中含碳量进行定量分析,测试条件为N2气氛,温度范围50~900℃,升温速率10℃/min。
2.3 电化学性能测试
在Ar手套箱中装配纽扣电池,测量α-Fe2O3负极材料的电化学性能。将α-Fe2O3负极材料、聚四氟乙烯(PVDF)、乙炔黑按75∶15∶10的质量比混合,在玛瑙研钵中研细,加入适量N-甲基吡咯烷酮(NMP)调和成膏状混合物,然后均匀涂敷在铜箔上。将涂敷电极材料的铜箔置于真空干燥箱中,120℃下干燥12h后,再冲压成直径为12mm的圆片作为负电极片,单个极片上的活性材料质量约为1~2mg。在Ar手套箱中装配纽扣电池,电解液为LBC305-1型电解液,隔膜为Celgard 2325微孔聚丙烯膜。使用CHI604D 电化学分析仪进行循环伏安和电化学阻抗测试,采用三电极体系,活性材料电极片为工作电极,金属锂片为参比电极和对电极,电压范围为0.05~3V,电流密度为900mA/g,频率范围为0.01~10000Hz。
3 结果与讨论
图1是通过水热法制备样品的XRD图谱。从图可见,未引入P123和引入P123进行水热反应获得样品的衍射峰都与六方相α-Fe2O3的标准衍射图谱(PDF#72-0469)完全吻合,没有其他物相的衍射峰存在,表明所制备的样品为纯相的α-Fe2O3。同时从图中还可看到,两个样品的衍射峰峰形尖锐,说明该水热条件下获得的α-Fe2O3结晶性良好。
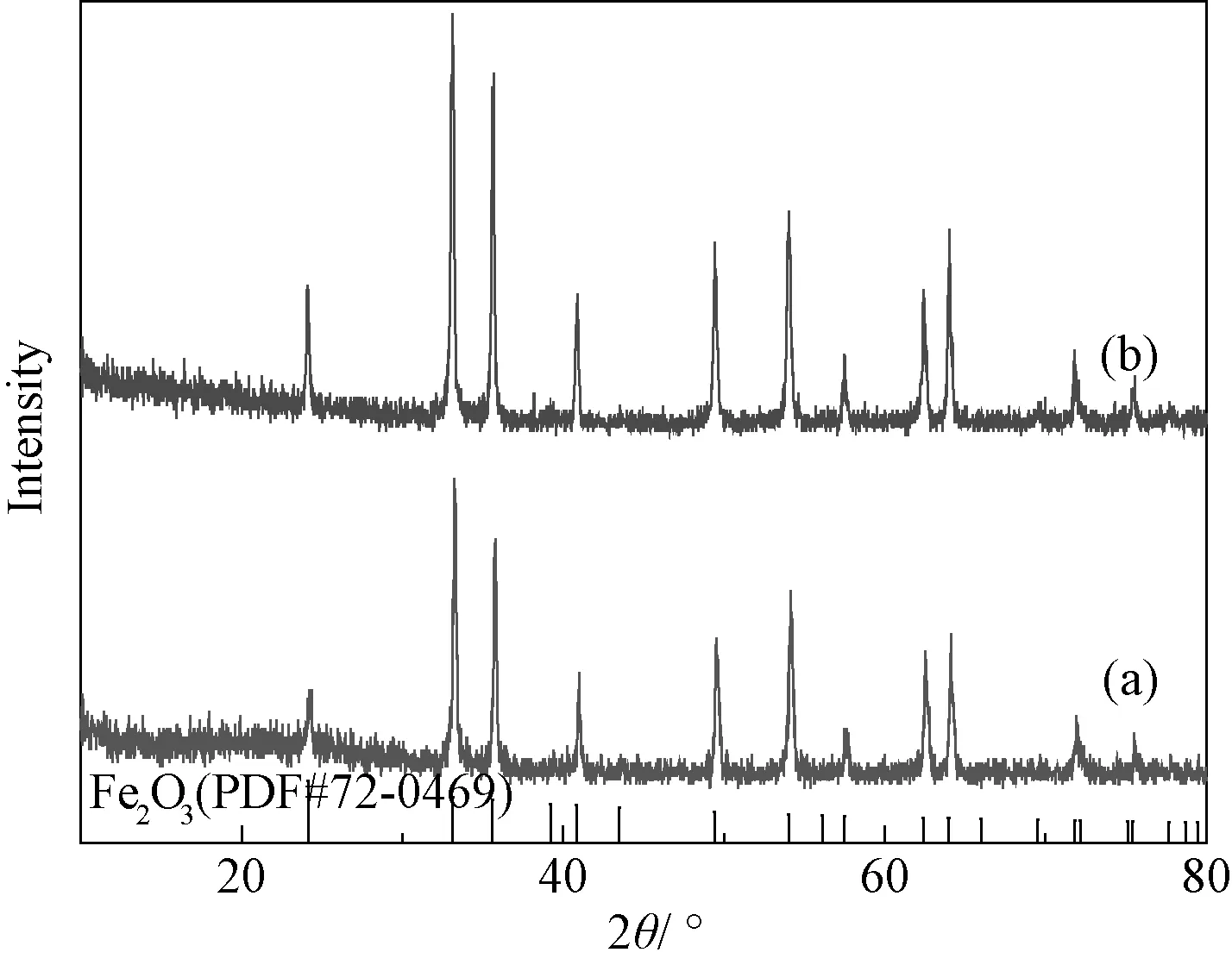
图1 水热合成样品的XRD图谱 (a)未引入P123;(b)引入P123Fig.1 XRD patterns of hydrothermal synthesis samples (a) no P123 introduced; (b) P123 introduced
图2是水热制备的α-Fe2O3样品的SEM照片。从图2(a)可以看到未引入P123时水热制备样品由六方盘状纳米颗粒组成,α-Fe2O3盘状颗粒的直径为100nm,厚度为50nm。由于α-Fe2O3在室温下具有弱铁磁性[13],α-Fe2O3材料的自发磁化使得水热制备出的α-Fe2O3六方盘状纳米颗粒沿着圆盘的轴向定向聚集,出现大量的珍珠链状二次颗粒。从图2(b)可见,P123辅助水热合成的α-Fe2O3也是由六方盘状纳米颗粒组成,盘状颗粒直径约为100nm,厚度50nm,但看不到互相堆叠的α-Fe2O3盘状颗粒。说明引入P123未改变水热制备的α-Fe2O3纳米颗粒的尺寸和形貌,但α-Fe2O3六方盘状颗粒的分散性有了很大提高。众所周知,P123是一种三嵌段共聚物,常用做表面修饰剂吸附在固相颗粒表面。在本实验中,水热反应溶剂中引入P123,在水热处理过程中P123吸附于结晶形成的α-Fe2O3纳米颗粒表面,由于P123分子之间互相的空间位阻作用[14]减少了α-Fe2O3六方盘状纳米颗粒沿圆盘轴向的定向聚集,单分散性增强。

图2 水热合成α-Fe2O3样品的SEM照片 (a)未引入P123; (b)引入P123Fig.2 SEM images of hydrothermal synthesis α-Fe2O3 samples (a) no P123 introduced; (b) P123 introduced
图3是P123辅助水热合成α-Fe2O3样品在N2气氛下400℃热处理后的XRD图谱。可以看到热处理后的样品中除了原有的α-Fe2O3的衍射峰之外还出现了少量Fe3O4的衍射峰(PDF#65-3107),这可能与表面吸附的P123有关。在N2气氛中进行热处理时,P123脱水留下的碳在高温下具有还原性,将α-Fe2O3中部分Fe3+还原为Fe2+,使得Fe3O4物相的出现。

图3 惰性氮气氛热处理后的α-Fe2O3样品的XRD 图谱Fig.3 XRD patterns of α-Fe2O3 samples after heat treatment under N2 atmosphere
图4(a)是N2气氛热处理后的P123辅助水热合成α-Fe2O3样品测得的Raman光谱。从图可见,主要的特征峰出现在1300cm-1位置,而在1600cm-1处几乎没有特征峰出现。一般认为在1300cm-1处出现的是碳材料的D峰,它代表SP3杂化状态的碳或是由于缺陷存在导致碳排列出现不对称结构的非石墨化的碳,在1600cm-1处出现的G峰则代表层状结构石墨化的碳。鉴于P123辅助水热合成的α-Fe2O3样品经N2气氛热处理后,Raman光谱主要特征峰出现在1300cm-1位置,可以确认吸附颗粒表面的P123在惰性N2气氛热处理后转化为无定形碳,形成了表面碳膜全包覆的α-Fe2O3/C纳米六方圆盘颗粒。图4(b)为碳包覆α-Fe2O3/C六方圆盘纳米颗粒的热重曲线。从图可见,在加热一开始质量就缓慢下降,在100~150℃之间有一段0.22mg的质量损失,损失质量为1.7%,这可以归因于样品中含有的一些水分的蒸发,与样品中的碳材料无关。在150~650℃之间出现了一段缓慢的失重过程,整个失重量为0.31mg,损失质量为2.4%,这部分失重主要是样品中的碳在高温下氧化形成CO2逸出所致。
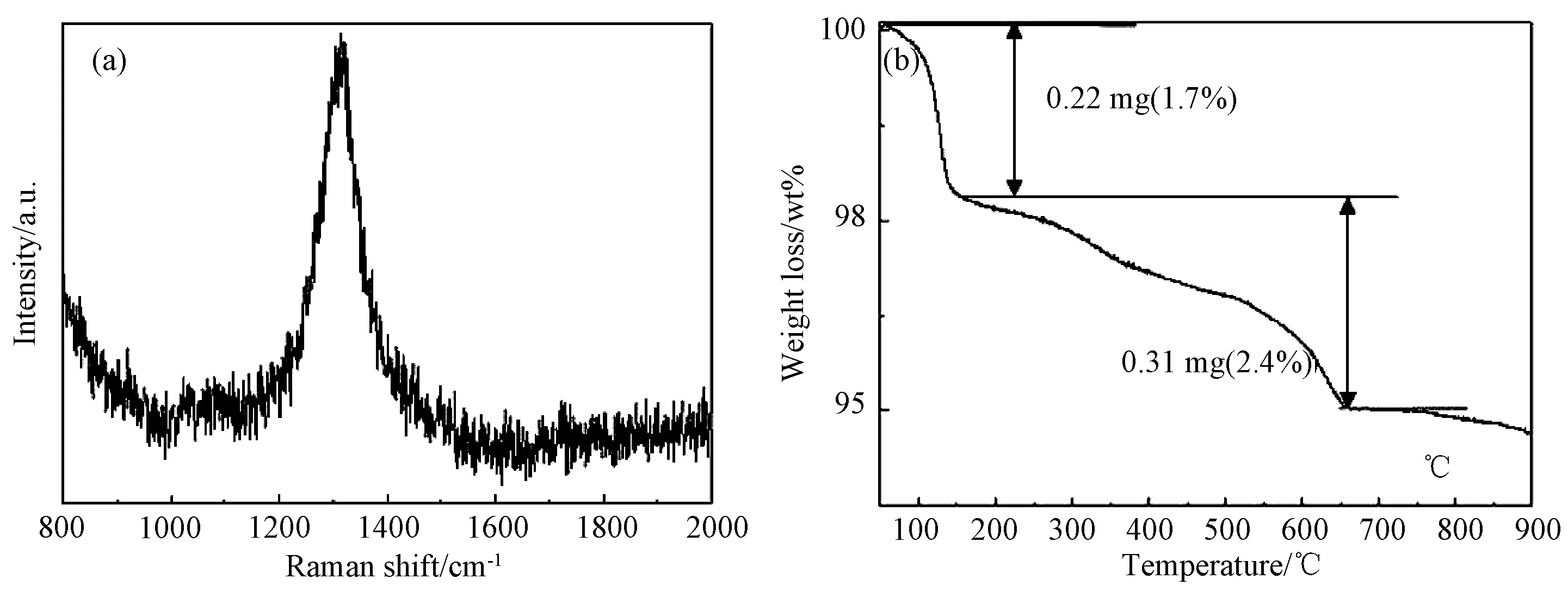
图4 碳包覆α-Fe2O3/C六方圆盘纳米颗粒的(a)拉曼图谱; (b)热失重曲线Fig.4 (a) Raman spectrum, (b) thermal gravimetric curve of carbon coated α-Fe2O3/C hexagonal nanodisks
将碳包覆α-Fe2O3/C六方圆盘纳米颗粒作为锂离子电池的负极材料,组装成纽扣电池,研究了其充放电性能。作为对比,也研究了未引入P123水热合成的α-Fe2O3负极材料的充放电性能。由于表面吸附的P123碳化形成的碳膜包覆,碳包覆α-Fe2O3/C六方圆盘纳米颗粒表现出更加优异的充放电性能。图5(a)是未引入P123合成的α-Fe2O3六方纳米盘作为锂离子电池负极材料的充放电曲线图,电压范围为0.05~3V,电流密度为900mA/g。α-Fe2O3纳米盘负极材料首次放电曲线在1V左右出现了一段比较短的放电平台,然后在0.8V处具有一段比较长而且平坦的放电平台,首次放电比容量达到1250mAh/g,对应的首次充电比容量为820mAh/g,库伦效率为65.6%。α-Fe2O3负极材料首次充放电比容量的大量损失可以归因于大量Li+在首次放电的过程中与α-Fe2O3发生不可逆的氧化还原反应生成Fe0和Li2O[15]。随着充放电循环的进行,尽管α-Fe2O3六方纳米盘负极材料充放电的库伦效率提高到接近100%,但其放电比容量迅速降低,3次充放电循环后放电比容量降低为450mAh/g,10次充放电循环后放电比容量仅剩余150mAh/g,仅为首次放比电容量的10%。后续比容量的持续下降主要原因是α-Fe2O3规则的晶体结构在氧还原反应的相变过程中被破环,造成部分Li2O产物失去反应活性所致[4]。
图5(b)是碳包覆α-Fe2O3/C六方圆盘纳米颗粒负极材料的充放电曲线图。从图中可以看到,碳包覆α-Fe2O3/C六方圆盘纳米颗粒负极材料的首次放电曲线在0.7V处出现了一段比较平坦的放电平台,首次放电、充电比容量分别为1176mAh/g和873mAh/g,库伦效率为74.2%,较未引入P123所合成的α-Fe2O3六方圆盘纳米颗粒有一定提升。随着充放电循环的进行,碳包覆α-Fe2O3/C六方圆盘纳米颗粒不仅充放电的库伦效率很快提高到100%,同时也保持了很高的放电比容量,5次充放电循环后放电比容量达900mAh/g,10次充放电循环后放电比容量仍达800mAh/g,是首次放电比容量的67%。

图5 α-Fe2O3负极材料的充放电曲线图 (a) α-Fe2O3; (b) α-Fe2O3/CFig.5 Charge and discharge curves of α-Fe2O3 anode materials (a) α-Fe2O3; (b) α-Fe2O3/C
在水热过程中引入P123一方面可以使得制备的α-Fe2O3纳米盘具有更好的分散性,碳化处理后形成的碳包覆α-Fe2O3/C六方圆盘纳米颗粒也保持了较好的分散性,在首次放电的过程中能够提供更大的比表面积与Li+结合。另一方面表面吸附的P123在惰性氮气氛热处理后,在α-Fe2O3六方圆盘纳米颗粒表面形成碳膜全包覆,获得碳包覆α-Fe2O3/C。所形成碳膜在充放电过程中为α-Fe2O3六方圆盘纳米颗粒的体积膨胀提供一定的缓冲作用,抑制了因体积变化产生的粉化。在两种因素共同作用下,碳包覆α-Fe2O3/C负极材料获得了更高的放电比容量和循环性能。
图6是碳包覆α-Fe2O3/C和未引入P123的合成的α-Fe2O3作为锂离子电池负极材料的电化学阻抗谱。从图中可以看到两种α-Fe2O3样品的电化学阻抗谱的形状类似,高频区是一个半圆,低频区为一条直线。通过对电化学阻抗谱的拟合得到α-Fe2O3/C的电化学阻抗R2为131.69Ω·cm2,远大于α-Fe2O3的电化学阻抗61.23Ω·cm2。通过分析认为α-Fe2O3/C六方圆盘纳米颗粒表面的碳膜会在一定程度上阻碍Li+的进入发生氧化还原反应。根据转换型负极材料的反应机理[16],Li+会直接与α-Fe2O3颗粒发生氧化还原反应而不需要从α-Fe2O3颗粒的表面迁移至α-Fe2O3原子的空隙中,因此未引入P123制备的α-Fe2O3负极材料的阻抗值非常小,而α-Fe2O3/C 由于其表面碳膜的存在,使得Li+需要穿过碳膜才能与α-Fe2O3发生氧化还原反应,因此造成了其电化学阻抗的增加。

图6 α-Fe2O3负极材料的电化学阻抗谱,插图是纽扣半电池的等效电路图Fig.6 Electrochemical impedance spectra of α-Fe2O3 anode materials, inset is the equivalent circuit of assembled button batteries
4 结 论
在水热合成α-Fe2O3的过程中引入三嵌段共聚物P123,由于其在α-Fe2O3颗粒表面的吸附会在水热反应过程中发挥空间位阻作用,从而减少了α-Fe2O3六方圆盘纳米颗粒的定向聚集,使得其单分散性增强。在惰性N2气氛下进行热处理后,吸附于α-Fe2O3颗粒表面的P123脱水转化为无定形碳,实现了α-Fe2O3六方圆盘纳米颗粒的碳膜全包覆,获得了碳膜全包覆的α-Fe2O3/C六方圆盘纳米颗粒。由于碳膜对充放电过程体积变化引起的粉化的抑制作用,碳膜全包覆的α-Fe2O3/C六方圆盘纳米颗粒表现出优异的充放电保持性能,10次充放电后的比容量为800mAh/g是首次放点容量1200mAh/g的67%,较未引入P123合成的α-Fe2O3六方圆盘有较大提高。

