甘草甜素对角膜上皮损伤愈合中炎症反应的抑制作用△
周永莹 孟凡兰 王婷 王玉川 应铭 李轩
角膜是眼屈光成像中的重要组成部分,由于直接暴露在外界环境中,因此角膜容易受到擦伤、感染、烧伤等各种因素的损害。在角膜上皮损伤愈合过程中,坏死的细胞会释放各种内源性因子——警报素,它可以趋化炎症细胞迅速迁移进入受损的组织,进而产生过度的炎症反应,导致不良后果,如基质纤维化、角膜溃疡等[1-3]。HMGB1作为已知的警报素之一,已被证实在角膜炎、葡萄膜炎、青光眼、糖尿病视网膜病变和视网膜变性疾病中可作为炎症因子加重炎症反应,而抑制HMGB1的表达有望成为新的治疗手段[4-7]。目前,HMGB1在角膜上皮损伤愈合中的研究尚未开展。本研究探讨HMGB1抑制剂甘草甜素对角膜上皮损伤愈合中炎症反应的抑制作用。
1 材料与方法
1.1 实验动物、试剂和仪器取SPF级健康8周龄的雄性C57BL/6J小鼠60只,体质量(20.00±1.25)g,购自协和医学院血液学研究所。甘草甜素(日本Sigma公司),ALGERBRUSHⅡ去角膜上皮刀(美国AlloyMedical公司),左氧氟沙星滴眼液(日本参天制药有限公司),盐酸丙美卡因滴眼液(比利时Alcon公司),抗白细胞介素-1(interleukin-1,IL-1)β抗体(英国Abcam公司),髓过氧化物酶(myeloperoxidase,MPO)抗体试剂盒(上海基因科技有限公司),眼科手术显微镜(德国ZEISS公司)。
1.2 方法
1.2.1 实验动物分组及处理采用随机数字表法将60只C57BL/6J小鼠分成治疗组和对照组,每组各30只,两组小鼠右眼建立角膜上皮损伤模型,左眼不做处理。治疗组和对照组在造模前1 d分别腹腔注射100 μL的2 g·L-1甘草甜素溶液或PBS,造模后每间隔6 h用5 μL的甘草甜素溶液或PBS滴眼,连续滴眼3 d。本研究遵循《实验动物管理条例》(2017修订版)的规定。
1.2.2 角膜上皮损伤模型的建立两组小鼠按照10 mL·kg-1标准腹腔注射50 g·L-1水合氯醛进行麻醉,用盐酸丙美卡因滴眼液对小鼠右眼行角膜表面麻醉;将直径为2 mm的角膜环钻置于角膜正中央后微旋一周形成压痕;接着使用已消毒的ALGERBRUSH Ⅱ去角膜上皮刀刮除直径为2 mm范围的角膜上皮,同时保持角膜缘区上皮完整。术后使用生理盐水冲洗结膜囊并用左氧氟沙星滴眼液滴眼预防感染。排除造模后发生感染的小鼠,60只小鼠均建模成功。
1.2.3 角膜上皮愈合情况的观察及分析造模后0 h、24 h、48 h、72 h,两组小鼠右眼使用100 g·L-1荧光素钠溶液着染角膜上皮,裂隙灯蓝钴灯下观察角膜上皮愈合情况,并用摄像系统拍摄图像。观察后用生理盐水冲洗结膜囊并用左氧氟沙星滴眼液滴眼预防感染。图像使用Image Pro Plus 6.0软件计算角膜上皮缺损率。
1.2.4 组织病理学检查造模后48 h、72 h,将两组小鼠用颈椎脱臼法处死,完整取下眼球,经40 g·L-1多聚甲醛固定液固定,石蜡包埋,再垂直于角膜表面连续4 μm切片。HE染色观察造模后72 h角膜组织结构,免疫组织化学染色检测造模后48 h、72 h时角膜组织IL-1β的表达以及中性粒细胞数。显微镜下观察并拍摄图像,使用Image Pro Plus 6.0软件计算基质层中IL-1β的平均光密度值(mean optical density,MOD),并对中性粒细胞数量进行计数。
1.3 统计学分析采用SPSS 20.0统计学软件分析数据,服从正态分布的计量资料采用均数±标准差表示,两组检测结果比较均采用独立样本t检验。检验水准:α=0.05。
2 结果
2.1 角膜上皮愈合的情况造模后24 h、48 h、72 h,治疗组角膜上皮缺损率分别为(78.75±5.81)%、(21.58±4.53)%、(0.83±0.72)%,明显低于对照组的(87.74±3.57)%、(32.21±4.02)%、(3.80±1.86)%,差异均有统计学意义(均为P<0.01)。这说明治疗组的上皮增殖能力强于对照组。见图1。
2.2 角膜组织的HE染色结果造模后72 h,HE染色结果显示:治疗组角膜上皮生长2~3层,上皮细胞排列欠规则;对照组角膜上皮生长0~2层,上皮细胞排列紊乱。这表明甘草甜素溶液促进了角膜上皮层的修复。见图2。
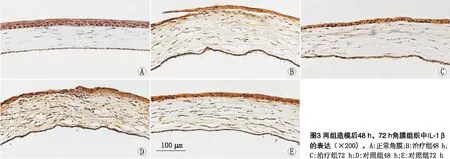
2.3 角膜组织中IL-1β的表达情况免疫组织化学染色结果显示,正常角膜组织中,IL-1β仅在角膜上皮层和内皮层表达,角膜基质层中不表达。造模后48 h,两组角膜基质层中均可观察到IL-1β的阳性表达,治疗组角膜基质层中IL-1β的MOD为0.39±0.06,明显低于对照组(0.60±0.04),差异有统计学意义(P<0.01)。造模后72 h,两组角膜基质层中IL-1β的阳性表达均降低,治疗组角膜基质层中IL-1β的MOD为0.21±0.03,明显低于对照组(0.31±0.03),差异有统计学意义(P<0.01)。见图3。

图1 两组造模后0 h、24 h、48 h、72 h角膜上皮缺损情况(×25)

图2 两组造模后72 h时角膜组织的HE染色结果(×400)
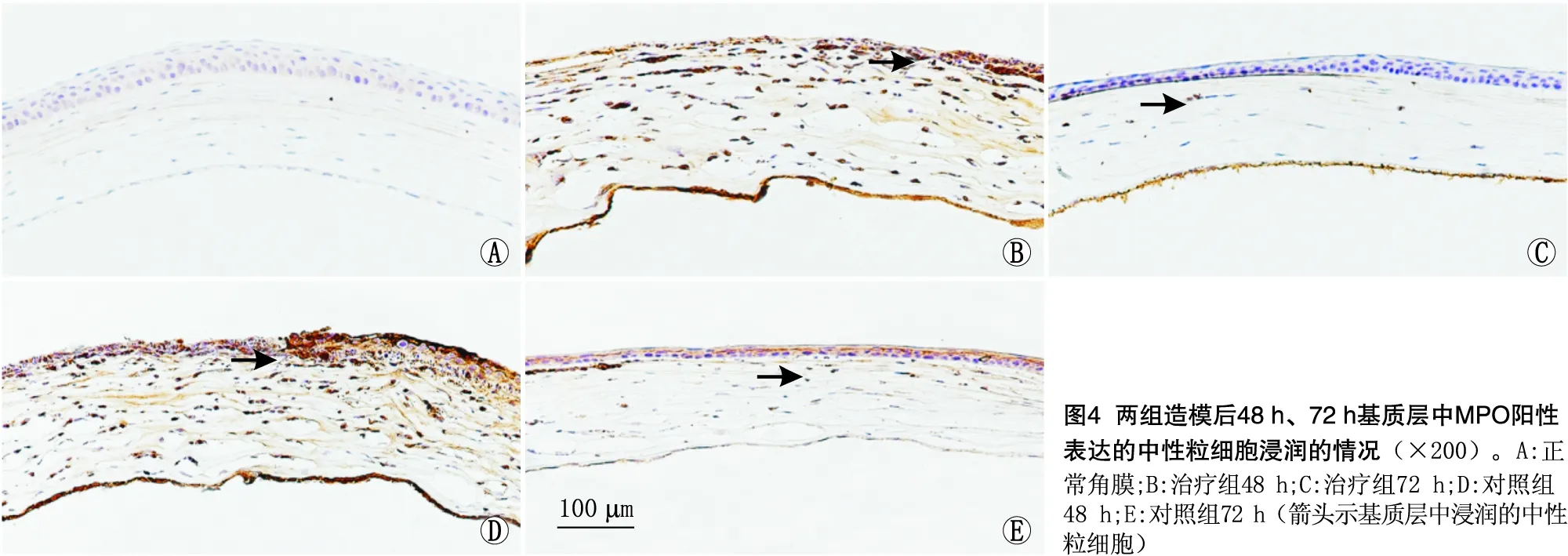
2.4 角膜内中性粒细胞的浸润情况MPO蛋白是中性粒细胞的标志性蛋白,通过检测MPO的表达可显示角膜内中性粒细胞浸润的情况。免疫组织化学染色结果显示,正常角膜基质层中无中性粒细胞浸润。造模后48 h,两组角膜基质层中均可观察到MPO阳性表达的中性粒细胞,着色呈棕褐色,中性粒细胞主要聚集在裸露的基质和增殖上皮的交界区;治疗组角膜基质层的中性粒细胞数量为每200倍视野(93.33±3.18)个,较对照组[(142.66±4.50)个]明显减少,差异有统计学意义(P<0.01)。造模后72 h,两组角膜基质层的中性粒细胞数量大幅度减少,治疗组为每200倍视野(10.66±5.13)个,较对照组[(40.00±6.08)个]明显减少,差异有统计学意义(P<0.01)。见图4。
3 讨论
角膜上皮损伤时,异常的愈合过程将会导致角膜水肿、新生血管及瘢痕的形成,造成视力不佳。目前已经证实中性粒细胞及其裂解产物可选择性地黏附于角膜伤口的前缘,延缓角膜上皮的愈合[8]。另外,角膜上皮损伤时释放的细胞因子,IL-1β、肿瘤坏死因子-α等,也可引起角膜基质溶解、炎症细胞浸润、新生血管形成,从而延缓上皮愈合[9]。因此,降低角膜基质层中IL-1β的表达以及中性粒细胞的浸润将有助于促进角膜上皮损伤愈合。
HMGB1作为一种重要的警报素,在青光眼、铜绿假单胞菌角膜炎等眼病中,既可通过NF-κB通路引起下游IL-1β的高表达,也可作为细胞因子趋化中性粒细胞的迁移,进而加重炎症反应[10-11]。甘草甜素作为HMGB1的有效抑制剂,是一种天然的三萜乙二醇结合物,存在于甘草的根、茎中;与其他的抗HMGB1单克隆抗体相比,其不仅可以抑制HMGB1的表达,还具有抗炎、抗病毒等多种药理活性[12]。
本研究采取专用的去角膜上皮刀来制作角膜上皮损伤模型,与其他角膜上皮损伤模型(如乙醇加刀片刮除法)相比,此方法使研究更接近真实的角膜上皮损伤愈合过程。造模后48 h和72 h,治疗组角膜基质层中IL-1β的表达和中性粒细胞浸润程度均降低;表明甘草甜素溶液减轻了角膜上皮损伤愈合时的炎症反应。同时,荧光素钠染色和HE染色的结果都表明,甘草甜素溶液促进了角膜上皮层的愈合。因此,甘草甜素可降低HMGB1的表达,进而降低基质中IL-1β的过表达以及中性粒细胞的浸润,最终减轻角膜上皮损伤后炎症反应,促进角膜上皮愈合。

