猪蓝耳病对母猪繁殖性能的影响及防控措施
高忠臣
(景顺养殖有限公司,山东 菏泽 274717)
猪繁殖与呼吸综合征(PRRS)俗称猪蓝耳病,繁殖与呼吸综合征病毒(PRRSV)是猪呼吸道综合征(PRDC)最重要的病原之一,分为欧洲型和美洲型,也是目前养猪业最重要的猪病之一。我国的PRRS以美洲型为主,主要引起种猪群的繁殖障碍、仔猪、生长育肥猪群的呼吸道问题。猪群感染PRRS 后会造成免疫抑制,易出现各种混合感染和继发感染。该病毒容易变异、毒株多样、感染时间长,因此防控难度较大[1-2]。文章从实践出发,阐述了PRRS 对母猪繁殖性能的影响,分析了其防控难点,同时,基于原有实践基础提出了应用替米考星对猪蓝耳病综合防控的措施,文章旨在帮助养猪生产企业生产一线员工深入了解PRRS 对母猪繁殖性能的影响,同时为有效防控PRRS 提供应用策略和参考依据,进而有效改善猪场母猪生产效率。
1 PRRS 对母猪繁殖性能的影响
PRRS 是 由PRRSV 感 染 而 引起的一种烈性传染病,患病母猪通常会表现早产、流产以及死胎数增加等不良临床症状,给养猪业带来了巨大损失[3]。有关PRRS 影响母猪繁殖性能的报道较多。最近的一项研究通过调查养猪场的数据,分析了PRRS 对母猪繁殖性能的危害,研究人员以美国中西部猪场为研究对象,比较了患病前后母猪繁殖性能的变化,数据显示,PRRS暴发年份母猪与未暴发年份母猪相比,PSY 和母猪年产窝数分别降低了7.4%和2.4%,而流产胎儿数则增加了26.0%[4]。相似的调查,和应东[5]对182 头母猪和哺乳仔猪进行了观察统计,发现312 头仔猪全部感染PRRSV,死亡率高达100%;而患病妊娠母猪流产率高于50%,同时87 头母猪出现死亡现象。也有研究指出,患PRRS 妊娠母猪在妊娠后期发生流产、早产、死胎、产弱仔和木乃伊胎,流产率高达50%~70%、死产率达35%以上,木乃伊胎率达25%[6]。这表明PRRS 给母猪繁殖性能带来了极其不利的影响,严重影响了猪场的养殖效益。而另一项研究则从反面阐明了PRRS 会对母猪繁殖性能产生消极影响,该研究比较了母猪是否接种PRRS 疫苗后的繁殖性能差异,结果显示,未接种PRRS 疫苗的母猪产活仔数以及断奶仔猪数均显著低于接种PRRS 疫苗组的母猪[7]。
同时PRRSV 可通过胎盘进行垂直传播,进而感染胎儿,造成母猪流产、早产以及产死胎等不良现象[8],从而对仔猪产生不利影响。有研究显示仔猪感染PRRSV 的可能性为50%~100%,并且1 日龄仔猪最容易感染,感染仔猪通常表现为呼吸急促,少数病猪耳朵发紫,有时表现腹式呼吸、咳嗽、厌食、发热达40.0 ~41.0℃,生长缓慢,病猪后期皮肤青紫发绀,常因继发感染,使病情恶化,进而导致仔猪病死率增加[6]。张亮[9]对PRRS 阳性猪场进行了调查分析,观察到患病仔猪体温明显升高(平均温度高达40.5 ℃),患病猪精神涣散,在圈舍内不愿走动,卧地不起,背毛较乱,采食量下降,料槽内饲料较未发病之前剩余量明显增多。夏文龙等[10]将健康仔猪与患PRRS 仔猪接触以构建仔猪感染模型,结果发现接触感染后的仔猪于第4 天时3头仔猪平均体温达40.6 ℃,第6 天高于41.0 ℃并持续高热,分别于第12 天、第13 天死亡。这表明PRRS极易感染仔猪,造成高热等不良现象,导致死亡,进而降低母猪的繁殖性能。
PRRS 是由PRRSV 感染的一种烈性传染病,众多研究显示PRRSV具有免疫抑制作用,会对母猪免疫功能产生不利影响并对其繁殖性能造成不利影响。猪感染PRRSV 后出现强烈的免疫抑制作用,同时PRRSV 会对猪巨噬细胞系统产生破坏作用,降低了母猪的抗感染能力,降低其免疫性能,最终产生混合感染或继发感染等不良现象,对母猪的繁殖性能带来消极影响[3]。屈雪琪等[11]指出,猪免疫器官(脾脏等)含有丰富的巨噬细胞,而PRRSV主要在单核巨噬细胞系统中进行复制,进而侵染免疫器官,因此猪感染PRRSV 后往往会出现全身性的淋巴结和脾脏的坏死现象,正是由于这些免疫器官或组织的大面积破坏,致使猪体液免疫能力和细胞免疫能力下降,抗感染能力降低,最终导致母猪出现感染而影响其繁殖性能。王天户等[12]研究了PRRSV 感染的免疫机制,对40 日龄断奶仔猪进行人工感染PRRSV,攻毒后检测免疫器官指数等相关指标,研究结果显示,感染组仔猪脾、肺门淋巴结、腹股沟淋巴结、颌下淋巴结、肠系膜淋巴结等全身淋巴结指数均显著或极显著增加(P <0.05 或P <0.01);剖检结果显示感染组仔猪在接毒第10 天时出现肺门淋巴结、腹股沟淋巴结、颌下淋巴结轻度充血水肿;在第17 天时出现肺门淋巴结肿胀,其他淋巴结轻度肿胀,脾轻度淤血;在第25天时出现肺门淋巴结和颌下淋巴结出血、肿大;电镜观察到接毒10 d后脾和淋巴结均出现许多淋巴细胞组织凋亡, 凋亡的淋巴细胞变小现象;研究认为PRRSV 感染猪会导致出现免疫抑制的原因有二,第一个原因是PRRSV 感染前期引发广泛性淋巴细胞及巨噬细胞凋亡;第二个原因则与淋巴组织广泛性的坏死有关。
2 PRRS 防控的难点
PRRS 是威胁我国猪场的重要疾病,目前对于控制该病缺乏非常有效的措施,防控难度大的原因有以下几点。
2.1 PRRSV 变异迅速
新的毒株不断出现。PRRSV作为一种RNA 病毒[13],毒株很多,不同毒株之间可以发生重组[14]。该病毒自从30 年前被发现以来,一直不断地变异。在美国就有MN184等变异毒株[15];2006 年我国出现了NSP2 缺失的高致病性PRRSV[16],对养猪业造成了巨大的冲击。2014年我国又出现了类NADC30 毒株[17]。该毒株毒力介于JXA1 和VR2336 之间,是中等毒力的毒株。但已有证据表明类NADC30 毒株的特点在于其高度易变,极易与国内的毒株重组,后续分离到的毒株与最初在河南分离的毒株部分差别很大,一些地区猪场发病情况较为严重[18]。原因可能是变异导致其毒力发生变化,最终导致临床上有不同表现。可以预测,随着时间的推移,将会不断有新的PRRSV 毒株的出现。
2.2 临床诊断PRRS 比较困难
PRRS 临床症状易与其他传染病混淆,如猪瘟、猪流感、猪败血性链球菌、放线杆菌胸膜肺炎等;剖检变化无显著的特异性眼观病变。PRRS 的病理变化主要集中在呼吸系统和淋巴系统上,但是无法从剖检变化上确诊。
2.3 PRRSV 的实验室检测有局限性
反转录聚合酶链式反应(RT-PCR)是最常用的实验室检测PRRSV 抗原的方法,该方法灵敏度高,可对组织、唾液及疾病急性发病期血清进行检测。RT-PCR检测可区分经典PRRSV 和非典型PRRSV[19],但不能很好地区分疫苗毒株与野毒毒株。因此,RT-PCR检测结果要与猪只的免疫情况结合起来进行综合诊断。酶联免疫吸附试验(ELISA)检测用来测定PRRS抗体,但不能很好地区分是野毒感染还是疫苗免疫产生的抗体。因此完整的诊断必须结合临床症状、流行病学、PCR 检测、病理学诊断(有时也需要ELISA 检测)。在临床上,仅依靠S/P 值对猪场进行判定往往和现场发病情况并不吻合,如高S/P 值的猪只可能临床上很健康,而低S/P 值的猪可能在发病中。因此不能用这种方法去生搬硬套,也不能用S/P 值去判定疫苗的保护效果。
2.4 PRRSV 会引起免疫抑制而造成猪呼吸道疾病综合征(PRDC)
PRRSV 可以调节巨噬细胞和树突状细胞(DCs)的细胞因子产量,调控抗原递呈相关分子的表达,从而抑制天然免疫和特异性免疫反应,引起免疫抑制[20-21]。免疫抑制的产生还与PRRS 病毒的感染有关。PRRS 病毒感染猪群后,主要在肺泡巨嗜细胞、淋巴细胞和单核细胞内复制,在复制的过程中,病毒会诱导感染细胞和周边未感染细胞的死亡和凋亡,导致肺泡巨噬细胞、单核细胞、淋巴细胞等免疫细胞数量的大量减少,而肺泡巨噬细胞等具有吞噬、杀死外来病原,并将病原进行抗原处理、递呈给免疫系统的功能,一旦这类细胞在PRRS 病毒的感染过程中死亡,那么必然导致机体的整体免疫能力大大下降,因此出现免疫抑制[22]。在感染期间,由于免疫抑制的存在,动物对其他病原的免疫反应能力下降,抗体产生迟缓、低下,机体对细菌的入侵清除能力下降,继发细菌感染的机会大大增强。因此,由于免疫抑制的存在,PRRS 感染的猪场,猪瘟、猪伪狂犬病等常见疾病的抗体水平不高,整齐度低,且常伴随非常严重的副猪嗜血杆菌[23]、胸膜肺炎放线杆菌、链球菌、巴氏杆菌的感染[24]。尽管PRRS 阳性猪群随处可见,但是临床上的发病情况却差异显著。林昭男等采用定量PCR 的方法检测了不同的PRRS 带毒猪群,发现病猪体内的病原含量与临床症状成正相关。PRDC 发病率高的猪群PRRSV 的病毒血症明显高于健康猪群。攻毒后14 ~120 d 检测到中和抗体,14 ~120 d 可以检测到IFN-γ 介导的细胞免疫反应。病毒主要在扁桃体、肺和淋巴组织中持续性复制。出生后感染的猪体内,PRRSV 能持续性存在长达150 d;而先天感染的猪体内甚至能存在长达210 d 之久[25]。嗜巨噬细胞和持续性感染是PRRSV 的特性。注射疫苗以后一般需要3 ~4 周才能产生保护力。
2.5 传播途径多种多样,生物安全措施效果往往效果不佳
PRRS 的主要传播途径为水平传播、垂直传播。除了猪只之间的直接传播之外,还有物品或蚊虫引起的间接传播,包括:设备、工作服、靴子、垫料、水、饲料、活载体、悬浮微粒等。Scott Dee 等发现携带PRRSV 的空气尘埃造成的传播距离可达9.1 km。PRRSV 可以通过公猪的精液传给母猪,也能通过母猪的胎盘屏障传给胎儿。在哺乳、保育、生长及育肥屠宰猪群各阶段PRRSV 都可以通过转群、注射针头、排泄物及苍蝇等昆虫媒介而流行传播。种猪群引入后备种猪也是PRRSV 流行传播的常见途径;许多猪场不能严格执行全进全出,导致PRRSV 感染的生长育肥猪群成为内部循环感染的重要传染源,通过水平传播或间接传播等方式,发生逆向或正向感染,导致仔猪群、母猪群和/或大的生长育肥猪群感染甚至发病。
2.6 PRRS 疫苗免疫无法做到完全保护
国内PRRS 疫苗生产厂家有30 多家。疫苗包括灭活疫苗和弱毒疫苗。弱毒疫苗包括以CH-1R、R98、VR2332 为代表的经典毒株疫苗,以及以JXA1-R、HuN4-F112、TJM-F92、GDr180 株为代表的HPPRRS 毒株疫苗。关于PRRS 不同毒株之间的交叉保护效果,专家们还存在争议。
3 PRRS 的综合防控措施
目前国内外常用的PRRS 的控制方法包括三方面的结合:良好的饲养管理和生物安全;优质疫苗的科学免疫;合理的药物保健程序。
3.1 建立良好的饲养管理与生物安全
严格控制猪群的流动,避免不同批次和不同猪群的接触,尽量做到全进全出。引种:尽量避免一次性引入大量后备母猪;尽量避免一次性从多个来源同时引进后备母猪(或后备公猪)。保持良好的温度、湿度,降低饲养密度;防止饲料的霉变或者营养不足;封群,清群与重新建群;分胎次饲养、多点式饲养;后备猪群隔离驯化;空气过滤与卡车清洗。
3.2 合理的疫苗免疫
一个猪场PRRS 的免疫,最好先做全群抗体检测分析(按规范的采血方案),将猪场猪群PRRS 的感染状况进行分类,分为阴性场、稳定不活跃场、稳定控制场、稳定活跃场及不稳定场,来决定是否进行PRRS 疫苗免疫。同时了解仔猪PRRSV 抗体转阳的时间确定仔猪最佳免疫时机。选择质量较好的疫苗也很重要,保证疫苗抗原含量充足,没有毒力返强的潜在风险,对猪群没有应激。同时需要制定合理的免疫程序,一般建议母猪群进行定期的“一刀切”普免,仔猪7~14 日龄注射。后备母猪群在混群之前至少4 周进行免疫。
3.3 做好药物保健
控制继发感染PRRS。感染以后免疫系统受损,机体免疫力下降,很容易发生各种细菌性的继发感染,导致发病率和死亡率更高。控制好细菌的继发感染可以控制由于继发细菌性感染而造成的死亡,减少经济损失。有些药物譬如替米考星可以在巨噬细胞内富集,杀菌的效果更明显。同时细胞内环境的改善还能有助于巨噬细胞对抗病毒性感染。PRRS 感染猪体后首先在局部组织的巨噬细胞内复制,然后迅速向淋巴组织、肺扩散,最终到达肺泡巨噬细胞表面,通过与肺泡巨噬细胞膜表面上的受体结合,诱导细胞吞噬病毒而进入细胞。PRRS病毒进入巨噬细胞后,将同细胞内的溶酶体融合,溶酶体内含有丰富的各种蛋白酶,这些酶必须在酸性的环境下才能发生酶促水解反应,PRRS 病毒在溶酶体内通过这些酶的作用脱去病毒表面的核衣壳。H.J. Nauwynck(1999)研究发现,PRRS 的复制过程需要大量的H +进入溶酶体,使环境pH <7,呈偏酸性的环境。如果没有足够的H+进入,如果溶酶体内的pH 环境发生改变,PRRS 病毒的脱壳将失败。
4 替米考星在控制PRRS 中的作用
替米考星是一类大环内酯类类抗生素,该抗生素被口服后可迅速被吸收,具有良好的组织穿透力,能快速聚集于肺脏,并主要聚集在肺脏,而在血液中的浓度极低。研究资料表明,替米考星连续400 mg/kg 饲喂10 d,在肺部组织的含量是在血液中的11 倍(2.59/0.23)。
替米考星进入肺部组织后,偏向于巨噬细胞、单核细胞、淋巴细胞,尤其肺泡巨噬细胞,而且从亚细胞器的分布来看,替米考星主要分布于肺泡巨噬细胞内的溶酶体内,其细胞内外的浓度差可以高达75 倍,而PRRS 感染动物机体后,病毒的复制过程中最重要的脱壳过程就在此处完成,替米考星的这种偏嗜于肺泡巨噬细胞溶酶体的特性,刚好就为替米考星抑制PRRSV 的复制提供了可能。同时,替米考星有2个碱性基团,其pKa 值分别为7.4和8.5,替米考星的这种碱性基团的特性,以及在巨噬细胞内的高含量,可以改变巨噬细胞的内环境,提高巨噬细胞对抗PRRS 毒的能力。
据美国明尼苏达州立大学Thomas W.Molitor 与美国礼蓝公司联合研究报道(2001),如果将PRRSv 直接暴露于替米考星溶液中,让替米考星先作用于PRRS 病毒,处理完毕的PRRS 病毒再感染肺泡巨噬细胞,结果发现替米考星并不能杀死或者抑制PRRS 病毒的复制,对PRRS 病毒的活性也没有任何影响;但是如果反过来,先将肺泡巨噬细胞用替米考星处理后,再感染PRRS 病毒,发现PRRS 病毒在肺泡巨噬细胞内的复制量大大降低,明显存在抑制作用,但存在剂量依赖性。在替米考星的浓度达到0.1 ~1 μg/mL 时,PRRS 病毒的复制量比没有使用替米考星处理的对照组下降约30%~40%;如果替米考星的量达到10 μg/mL 时,PRRS 病毒的复制几乎停止。美国伊利诺斯州立大学Yijun Du(2011)等人研究也再次发现替米考星无论对PRRSV 欧洲型还是北美型在猪肺泡巨噬细胞中复制均有抑制作用。泰国学者Chung Hoang(2014)也发现,替米考星对广泛流行于亚太地区的高致病性猪PRRS 病毒的复制也同样存在抑制作用。
Xiao 等人报道,一家1 200头的母猪场的保育猪发病较为严重,经实验室和临床等多方面诊断为猪蓝耳病所致。使用替米考星进行治疗,以有效成分计,每吨料添加替米考星400 g 和磺胺氯达嗪钠375 g,连续使用14 d,该组为试验组。同时,设立对照组,对照组使用其他厂家生产的替米考星和磺胺氯达嗪钠,使用剂量和天数均相同。
由试验结果(表1 和表2)可知,每吨饲料中添加替米考星400 g组,可显著降低猪蓝耳病导致的保育期间高死淘率。第1 批试验,对照组死亡率高出试验组19.2%;第2 批试验,对照组死亡率高出试验组6.91%,两组试验差异极显著。
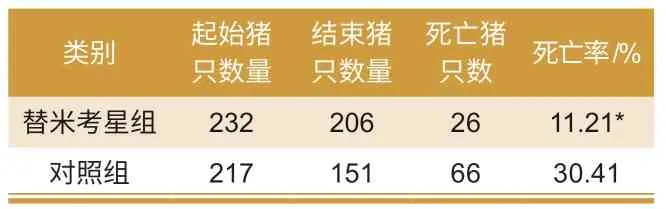
表1 第1 批试验结果
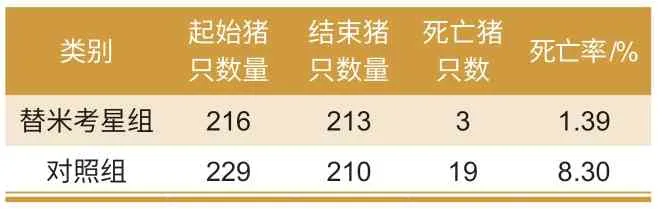
表2 第2 批试验结果
鉴于替米考星在保育期间有效防控猪蓝耳病所造成高死淘率的优异表现,在300 头猪场自2018年6月份起,以有效成分计,每吨饲料添加替米考星200g 和磺胺氯达嗪钠375 g,每季度使用1 次,每次使用15 天,对比使用前后的PSY,由原来的PSY18.3 头,提高至PSY 20.5头,PSY 提高2.2 头。

